Рак поджелудочной железы паллиативные операции

Ниже дан краткий обзор радикальных и паллиативных вмешательств при раке ПЖ.
В настоящее время хирургическое лечение остается единственно эффективным методом, однако опухоль можно удалить только на ранних стадиях (до 15% опухолей головки ПЖ), а операционный риск чрезвычайно высок. Радикальную операцию можно выполнить всего лишь у 1 — 5% больных, что обусловлено, в первую очередь, поздней диагностикой.
Выделяют следующие радикальные операции: гастропанкреатодуоденальная резекция, панкреатэктомия, дистальные комбинированные резекции ПЖ, расширенная субтотальная и тотальная панкреатодуоденэктомия. Радикальные операции технически очень сложны, их могут выполнить только высококвалифицированные хирурги в крупных центрах. Летальность после этих операций составляет от 27% при дистальной резекции ПЖ — до 17—39% при расширенной панкреатэктомии, пятилетняя выживаемость не превышает 8%. Последний факт обусловлен, прежде всего, тем, что у 50% больных в послеоперационном периоде возникает рецидив опухоли и в 90—95% случаев на первом году после операции развиваются отдалённые метастазы.
Существует мнение, что панкреатодуоденальную резекцию необходимо выполнять во всех случаях при подозрении на рак ПЖ даже без гистологической или цитологической верификации. Данное мнение отчасти обусловлено тем, что даже при лапаротомии и интраоперационном гистологическом исследовании частота ложноотрицательных ответов превышает 10%.
Перед операцией можно лишь предварительно судить о возможности удаления опухоли. Окончательное решение принимают после интраоперационного осмотра органов брюшной полости при исключении отдалённых метастазов и местной распространённости процесса. Наиболее часто во время операции обнаруживают такую причину нерезектабельности опухоли, как опухолевая инфильтрация забрюшинной клетчатки, включая нервные сплетения и поражение метастазами регионарных лимфатических узлов.
Панкреатодуоденальная резекция — основной тип радикальной операции при расположении опухоли в головке ПЖ. Нельзя её выполнить при прорастании опухолью нижней полой вены, аорты, верхней брыжеечной артерии и воротной вены. Для принятия окончательного решения следует отделить ДПК и головку ПЖ от подлежащих нижней полой вены и аорты, что позволяет судить и о вовлечённости верхней брыжеечной артерии; важна также оценка возможности диссекции воротной вены и верхней брыжеечной вены.
Удалённый при панкреатодуоденальной резекции анатомический препарат состоит из общего желчного протока, жёлчного пузыря, головки, шейки и секреторной части ПЖ, ДПК, проксимальной части тощей кишки, малого и части большого сальника, дистальной половины желудка. Кроме тою, иссечению подлежит паракавальная клетчатка, удаляют супрапилорические, инфрапилорические, передние и задние панкреатодуоденальные лимфатические узлы, лимфатические узлы гепатодуоденальной связки и по ходу общей печёночной артерии. Иссекают верхнюю брыжеечную вену (при изолированном опухолевом её поражении) или место се слияния с воротной веной. Такая лимфодиссекция улучшает прогноз, в то время как травматичность вмешательства увеличивается незначительно.
Простое перечисление удалённых органов свидетельствует о сложнейшей технике вмешательства. Ведь хирургу ещё предстоит выполнить серию восстановительных манипуляций — панкреатоностомию, билиодигестивный анастомоз (см. рис. 5-21), гастроеюностомию и межкишечный анастомоз. Средняя продолжительность операции составляет 6,5—7 ч.

Рис. 5-21. Стандартная панкреатодуоденальная резекция (операция Уиппла). Схема. В ходе операции удаляют общий жёлчный проток, жёлчный пузырь, двенадцатиперстную кишку, антральный отдел желудка, головку и часть тела поджелудочной железы: а — линии резекции; б — картина после резекции и перед реконструкцией (А-А — панкреатоеюноанастомоз, В-В — холедохоеюноанастомоз, С-С — гастроеюноанастомоз); в — состояние после резекции
Важны три технических приёма во время выполнения панкреатодуоденальной резекции — объём резекции паракавальной клетчатки и забрюшинной сосудистой диссекции, а также сохранение пилорического отдела желудка.
Особое внимание резекции паракавальной клетчатки уделяют потому, что именно в этой зоне чаще всего возникают рецидивы опухоли. Резекцию сосудов осуществляют при изолированном опухолевом поражении верхней брыжеечной вены или места её соединения с воротной веной. Прорастание верхней брыжеечной артерии чаще всего сопровождается обширным метастазированием в забрюшинные лимфатические узлы, что исключает возможность удаления опухоли.
Существуют мнения, что необходимо удалять узлы чревного сплетения, что позволяет существенно уменьшить выраженность болевого абдоминального синдрома в послеоперационном периоде, особенно в поздние сроки, когда заболевание прогрессирует.
Сохранение пилородуоденального сегмента при панкреатодуоденальной резекции улучшает пищеварительные функции и способствует более быстрому восстановлению массы тела больных.
Важно выявить зону первичного расположения опухоли в ПЖ, в первую очередь для исключения периампуллярных и ампулярных аденокарционом, имеющих значительно лучший прогноз.
Результаты стандартной панкреатодуоденальной резекции во многих больницах неудовлетворительные.
Послеоперационная летальность состав.ляет 12,3%, 1 год проживает 43,1% больных, средняя выживаемость больных составляет 15,5 мес, пятилетняя выживаемость не превышает 3,5—16.7%.
Неудовлетворительные отдалённые результаты, высокая послеоперационная смертность и техническая сложность панкреатодуоденальной резекции послужили основанием для отказа от радикальных вмешательств при раке ПЖ. Однако следует помнить, что репрезентативность результатов сравнительных исследований, проводимых в разных странах, может быть неодинаковой ввиду различий в диагностических критериях и подходах к стадированию рака ПЖ. В частности, в Японии применяют собственную классификацию опухолей ПЖ, отличающуюся от применяемых в США и Европе.
Выживают после гастропанкреатодуоденальной резекции лишь те больные, у которых по данным гистологического исследования послеоперационного материала по краям резекции нет опухолевых клеток. Напротив, в случаях их обнаружения больные живут приблизительно столько же, сколько больные после химиолучевого лечения.
При подтверждённом раке ПЖ выполняют ещё более объёмные операции — тотальную панкреатэктомию и расширенную панкреато-дуоденалъную резекцию. Необходимость в панкреатэктомии обусловлена важностью удаления мультифокальных очагов рака в ПЖ и более радикальным иссечением регионарных лимфоузлов (лимфатических узлов корня селезёнки, вокруг хвоста ПЖ). Несмотря на расширенный объём операции, показатели послеоперационной летальности сократились, однако отдалённые результаты от расширения объёма операции не улучшились, преимущественно за счёт развития тяжёлого сахарного диабета.
Расширенная панкреатодуоденальная резекция предусматривает удаление сегмента воротной вены и вовлечённых в опухолевый процесс артерий с реконструкцией сосудов. Кроме того, удаляют забрюшинные лимфатические узлы от чревной артерии до бифуркации подвздошных артерий. Разработчик техники этой операции Фортнер добился уровня отдалённой выживаемости 20% при послеоперационной летальности 23%.
При нерезектабельной опухоли, наличии или угрозе возникновения желтухи, гастродуоденальной непроходимости, если предполагаемая продолжительность жизни больного составляет более 6—7 мес, производят паллиативные вмешательства, в частности наложение билиодигестивного и гастроеюнального шунта (см. рис. 5-22).

Рис. 5-22. Паллиативные вмешательства при нерезектабельном раке поджелудочной железы. Схема: а — наложение обходного холецистоеюноанастомоза. В подавляющем большинстве случаев больные хорошо переносят операцию, несмотря на выраженную желтуху у ряда из них. Вмешательство обеспечивает достаточный отток жёлчи в кишку и уменьшение (или снижение выраженности) желтухи; б — другой тип обходного билиодигестивного анастомоза, который накладывают при угрозе прорастания опухоли в пузырный проток; в — гастроеюностомия; показана при блокировании опухолью двенадцатиперстной кишки
При предполагаемой продолжительности жизни 1-2 мес показано эндоскопическое введение стента в жёлчные протоки. Установка эндопротеза вместо хирургического шунтирования (холедоходуоденостомии и гастроэнтеростомии) подходит больным с тяжёлыми сопутствующими заболеваниями и липам старческого возраста. Она позволяет уменьшить число осложнений и смертность. Использование новых стентов из металлической сетки даст возможность увеличить продолжительность их нахождения в протоках и снизить частоту возникновения холангита. Рецидивирование желтухи после установления стента чаще всего связано с его обтурацией вследствие сладжа жёлчи; в этом случае проводят замену стента.
Предоперационное дренирование жёлчных протоков с целью уменьшения холестаза не приводит к увеличению продолжительности жизни больных. Недавно описана методика дренирующих малоинвазивных операций с целью декомпрессии жёлчевыводяших путей с помощью ЭУС, позволяющей более точно произвести стентирование.
Пример паллиативной операции — введение спирта (50 мл) или фенола в зону чревного сплетения дая купирования болевого абдоминального синдрома. Такой подход позволяет уменьшить боли или даже купировать их на короткое время, однако у 2/3 пациентов болевой синдром рецидивирует в течение месяца. Блокаду чревного сплетения можно выполнять повторно, однако эффективность следующих процедур более низкая. Тем не менее блокада чревного сплетения более эффективна, чем применение наркотических анальгетиков в сроки до 6 нед.
Появление методики нейролизиса чревного сплетения с использованием ЭУС повысило эффективность вмешательства ввиду большой точности определения зоны введения спирта. Боль проходит у 52% пациентов, а у 30% удаётся уменьшить суточные дозы наркотических анальгетиков.
Существуют указания об эффективности торакоскопической сплапхнэктомии в лечении болевого абдоминального синдрома. Для улучшения результатов хирургического лечения его дополняют химио-и лучевой терапией. Применяют эти методы не только после операции, но и интраоперапионно (введение в воротную вену или печёночную артерию фторурацила, митомицина). Возможны различные схемы комбинации лучевой, химиотерапии и хирургического лечения, введение препаратов в ткань опухоли под контролем ЭУС.
В последние годы всё чаще применяют трансплантацию ПЖ, селективную трансплантацию островковых и ацинарных клеток, что позволяет существенно улучшить качество жизни больных после панкреатэктомии по поводу ранних стадий негенерализованного рака ПЖ.
Маев И.В., Кучерявый Ю.А.
Опубликовал Константин Моканов
Источник
12 апреля 2019 г.
Просмотров: 3112
В последние десятилетия отмечается рост пациентов со злокачественными опухолями органов гепатопанкреатодуоденальной зоны. При этом частота диагностики рака этих органов на ранних стадиях практически не повысилась. В основном пациенты продолжают поступать в стационары только при развитии осложнений, наиболее частым из которых является механическая желтуха. Рак головки поджелудочной железы находится на втором месте среди причин подпеченочной желтухи (30–35%),уступая лишь холедохолитиазу (35–40%),третье место занимает рак внепеченочных желчных протоков (10–12%),затем — рак большого сосочка двенадцатиперстной кишки (1–2%).

При этом, по данным литературы, только в 10–20% случаев при выявлении рака поджелудочной железы пациентам выполняется радикальная операция, несмотря на которую большинство умирает в первый год после вмешательства. К сожалению, большая часть больных по разным причинам не может рассчитывать на радикальное лечение. Лечение больных этой категории осложняется наличием обтурации желчных путей, холангита, а в большинстве случаев и печеночной недостаточности. Общепризнано, что оперативное вмешательство, выполненное при нарастающей механической желтухе, является чрезвычайно рискованным и сопровождается высокой летальностью, достигающей 20-60%, что наряду с возрастающей частотой опухолевого поражения поджелудочной железы, несомненно, обусловливает актуальность данной проблемы.
В последние годы основными методами декомпрессии желчных путей считаются минимально инвазивные: ретроградные (эндоскопические) или антеградные (чрескожные чреспеченочные). Активное использование в клинической практике современных антеградных чрескожно-чреспеченочных) и ретроградных (эндоскопических) минимально инвазивных вмешательств позволяет эффективно сочетать диагностические и лечебные мероприятия, направленные в первую очередь на достижение билиарной декомпрессии. При этом следует признать, что при исторически сложившемся приоритете эндоскопических вмешательств ретроградный доступ в желчные протоки тем не менее, очевидно, перестал быть безальтернативным.
Антеградные методы декомпрессии желчевыводящей системы, реализуемые в виде чрескожно-чреспеченочной холангиостомии, продленного наружно-внутреннего дренирования, антеградного эндобилиарного стентирования, могут служить альтернативой эндоскопическим методам при их неэффективности или невозможности выполнения. При этом чрескожные миниинвазивные вмешательства позволяют либо успешно подготовить пациентов к основному этапу операции, в случае возможного выполнения радикального хирургического лечения, либо могут стать окончательным вмешательством, являясь примером паллиативного лечения. Целью нашего исследования явилась оценка эффективности паллиативного лечения с применением антеградных миниинвазивных технологий при раке поджелудочной железы.
Материалы и методы
За период с января 2010 по декабрь 2016 года в хирургическом отделении Орловской областной клинической больницы под наблюдением находилось 160 больных со злокачественным поражением поджелудочной железы, осложненным синдромом механической желтухи. В связи с чем все пациенты были госпитализированы в экстренном порядке. Больные доставлялись в стационар скорой медицинской помощью, направлялись другими лечебно-профилактическими учреждениями города и области, а также обращались самостоятельно. Женщин в исследуемой группе было 76 (47,5%),мужчин — 84 (52,5%). Возраст больных колебался от 48 до 76 лет. Проводилось комплексное обследование больных, включающее исследование клинико-лабораторных данных (общий и биохимический анализ крови, общий анализ мочи, коагулограмма и др.),выполнялось ультразвуковое исследование брюшной полости, гастродуоденоскопия, по показаниям эндоскопическая ретроградная холангиопанкреатография и мультиспиральная компьютерная томография, а также ряд других инструментальных исследований в зависимости от сопутствующей патологии.
При поступлении уровень прямого билирубина в исследуемой группе больных колебался от 68 до 580 мкмоль/л. Уровень общего билирубина в отдельных случаях достигал 780 мк-моль/л. Известно, что чем выше уровень гипербилирубинемии, тем больше вероятность развития у больного некорригируемой печёночной недостаточности и прогрессирующей полиорганной недостаточности. В связи с этим наличие гипербилирубинемии и билиарной гипертензии требует проведения срочных хирургических вмешательств, направленных на декомпрессию желчных путей. При этом билиарная декомпрессия должна быть прогнозируемо эффективной и управляемой.
У всех пациентов, находящихся под нашим наблюдением, при ультразвуковом исследовании были выявлены признаки актуальной желчной гипертензии, что наряду с невозможностью выполнения по различным причинам ретроградного эндоскопического дренирования явилось основанием для антеградного дренирования желчных путей под сонофлюороскопическим контролем по срочным показаниям (1-2 сутки от момента поступления в стационар). При этом во всех случаях антеградные миниинвазивные вмешательства несли не только лечебную, но и диагностическую нагрузку. Так как выполняемая интраоперационная антеградная холангиография позволяла уточнить уровень и степень блока. Адекватность выполненного чрескожного чреспеченочного дренирования оценивалась по изменению интенсивности желтухи, по суточному дебиту желчи, степени снижения гипербилирубинемии в биохимическом анализе крови, а также по устранению признаков билиарной гипертензии при динамическом ультразвуковом исследовании. После снижения уровня билирубина крови, дообследования и стабилизации состояния пациентов решался вопрос о переводе наружной холангиостомы в наружно-внутреннюю или об антеградном эндобилиарном стентировании.
Результаты исследования
Чувствительность, специфичность и диагностическая точность холангиографии во время постановки холангиостомы при раке поджелудочной железы составила соответственно 91,2%, 80,1% и 85,3%. Всего в группе пациентов со злокачественным поражением поджелудочной железы выполнено 204 минимально инвазивных вмешательств. Распределение характера вмешательств было следующим: наружная холангиостомия — 62,7% (128); антеградное эндобилиарное стентирование — 25% (51); наружно-внутреннее дренирование протоков — 10,3% (21); чрескожно-чреспеченочная микрохолецистостомия — 2% (4).
Учитывая, что у 51 пациента (32%) в исследуемой группе при проведении клинико-инструментальных и морфологических исследований был подтвержден неоперабельный характер поражения поджелудочной железы, выполнение радикального оперативного лечения не представлялось возможным. В связи с этим окончательным видом хирургического лечения, направленным на улучшение качества жизни, у данных больных, явилось антеградное стентирование внепеченочных желчных протоков.
Стентирование, по данным литературы, является более предпочтительным и менее травматичным способом восстановления пассажа желчи у больных с неоперабельным раком поджелудочной железы, так как значительно улучшает качество жизни больного.
В каждом исследуемом случае стентирование выполнялось вторым этапом после предварительной чрескожно-чреспеченочной холангиостомии или наружно-внутреннего дренирования. Техника стентирования заключалась в проведении металлического проводника через опухолевую структуру за зону большого сосочка двенадцатиперстной кишки под сонофлюороскопическим контролем, по которому в последующем производилась транспапиллярная установка стента. После выполненного стентирования в обязательном порядке производили постановку страховочной наружной холангиостомы, которая позволяла выполнять динамическую антеградную холангиографию для контроля процесса раскрытия стента и адекватности его функционирования в раннем послеоперационном периоде.
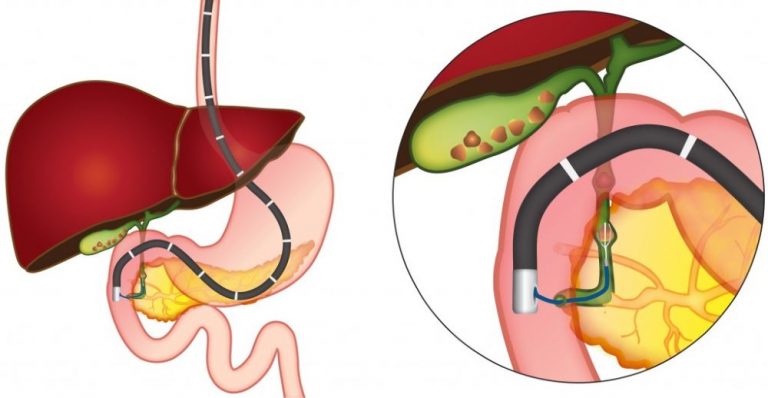
Выбор стента по диаметру раскрытия, длине и типу покрытия осуществлялся индивидуально в каждом конкретном случае в зависимости от протяженности зоны поражения. Использование покрытого стента при неоперабельном раке поджелудочной железы имеет ряд преимуществ, так как позволяет предотвратить возможное прорастание опухолевой или грануляционной тканью ячеистой стенки стента, тем самым вызывая обтурацию его просвета. Однако учитывая транспапиллярное положение устанавливаемого стента, применение покрытых форм было ограничено у пациентов с сохраненной проходимостью и функцией панкреатического протока.
Использование в подобных случаях покрытых форм стента значительно повышало риск перекрытия устья панкреатического протока. Как правило, в большинстве случаев сразу же после установки нитинолового саморасправляющегося стента под рентгенологическим контролем отмечали поступление контрастного препарата в просвет двенадцатиперстной кишки. Однако при этом рентгенологически сохранялась зона сужения в пораженном участке билиарного тракта. Полное раскрытие стента, сопровождавшееся свободным поступлением контрастного вещества в просвет двенадцатиперстной кишки, определялось в течение 24-48 часов с момента его установки. Восстановление пассажа подтверждалось контрольной антеградной холангиографией.
Обсуждение результатов
Осложнения после проведенных миниинвазивных вмешательств возникли в 26 случаях, и были связаны у 12 пациентов (7,5%) с дислокацией холангиостомического дренажа; в 4 случаях (2,5%) с развившимся острым холециститом; в 2 случаях (1,2%)с развившимся острым панкреатитом; у 5 пациентов с гидротораксом (3,1%). В отдаленные сроки после стентирования у 3 (1,9%) больных развился рецидив механической желтухи, обусловленный нарушением функции эндобилиарного стента.
В 2 наблюдениях через 4-5 мес. с момента постановки непокрытого стента произошла обтурация его внутреннего просвета за счет прорастания опухолевыми тканями ячеистой стенки.
В 3-м наблюдении рецидив желтухи развился через 6 мес. с момента постановки покрытого эндобилиарного стента и был обусловлен сдавлением его просвета разрастающейся опухолевой тканью. Двум пациентам из данной группы наблюдения выполнено антеградное рестентирование покрытым стентом по методике «стент в стент». В 3-м случае рецидива желтухи, связанного со сдавлением покрытого стента, рестентирование не проводилось. Пациенту было выполнено наружно-внутреннее дренирование.
Среди осложнений, развившихся после проведения антеградного эндобилиарного стентирования в ранний послеоперационный период, были зафиксированы острый холецистит (4 пациента) и острый панкреатит (2 пациента). В 3 случаях после установки непокрытого стента и в 1 после установки покрытого у пациентов отмечены клинико-эхографические признаки острого холецистита. У одного больного выполнена лапароскопическая холецистэктомия, у трех других произведена постановка чрескожно-чреспеченочной микрохолецистостомии под контролем УЗИ, на фоне которой клинические проявления острого холецистита удалось полностью купировать. Клиническая картина острого панкреатита, развившаяся в течение 24-48 часов после выполненного стентирования у двух пациентов, полностью купировалась на фоне проведенной консервативной терапии.
Мы в своем опыте не наблюдали смещений и миграций стентов после установки. Таким образом, антеградное эндобилиарное транспапиллярное стентирование саморасправляющимися металлическими стентами обеспечивает надежное и длительное дренирование желчных протоков, является малотравматичным, довольно безопасным и эффективным методом билиарной декомпрессии при механической желтухе, обусловленной неоперабельным раком поджелудочной железы. Летальный исход возник у 12 больных, что составило 7,5%, и был обусловлен прогрессированием основного заболевания и нарастанием полиорганной недостаточности.
Выводы
У пациентов с неоперабельным раком поджелудочной железы выполнение антеградного эндобилиарного стентирования представляет собой окончательный вариант хирургического лечения, позволяющий при минимальном объеме вмешательства обеспечить адекватный дренирующий эффект желчевыводящих путей. Кроме того, отсутствие наружных дренажей улучшает качество жизни пациента, его психологическое состояние, позволяет активизировать его в более ранние сроки, избавляет от необходимости приема желчи внутрь.
Литература:
- Альянов А.Л., Мамошин А.В., Борсуков А.В., Мурадян В.Ф. Эффективность применения минимально инвазивных технологий в лечении больных с синдромом механической желтухи // Ученые записки Орловского государственного университета. Серия: Естественные, технические и медицинские науки. 2015. № 4. С. 280-284.
- Гальперин Э.И., Ветшев П.С. Руководство по хирургии желчных путей. М.: Издательский дом Видар-М, 2006.
- Данилов М.В., Фёдоров В.Д. Повторные и реконструктивные операции при заболеваниях поджелудочной железы.М.: Медицина, 2003.
- Долгушин Б.И., Авалиани М.В., Буйденок Ю.В. и др.Эндобилиарная интервенционная онкорадиология.М.: ООО “Медицинское информационное агентство«.2004. — 224 с.
- Затевахин И.И., Цициашвили М.Ш., Дзарасова Г.Ж. и др.Возможности доплеровской сонографии в оценке функционального состояния печени при механической желтухе // Анн. хирург. гепатолог. 2001. Т. № 1. С. 113-124.
- Ившин В.Г., Якунин А.Ю., Лукичев О.Д. Чрескожные диагностические и желчеотводящие вмешательства у больных механической желтухой. Тула, 2000. — 312 с.
- Израилов Р.Е. Миниинвазивные технологии в лечении больных с опухолями органов билиопанкреатодуоденальной зоны: автореф. дис… докт. мед. наук / Р.Е. Израилов.Москва, 2011. — 47 с.
- Кубышкин В.А., Вишневский В.А. Рак поджелудочной железы. М., 2003.
- Охотников О.И., Яковлева М.В., Григорьев С.Н., Пахомов В.И. Антеградные эндобилиарные вмешательства в лечении осложненной желчнокаменной болезни // Анн.хирург. гепатолог. 2013. Т. 18. № 1. С. 29-37.
- Патютко Ю.И., Котельников А.Г. Хирургия рака органов билиопанкреатодуоденальной зоны. М.: Медицина, 2007.
- Costamagna G., Pandolfi M. Endoscopic stenting for biliary and Pancreatic malignancies. J ClinGastroenterol 2004; 38: 59–67.
- Hans-Joachim Wagner. With or Against the Bile Flow?Radiology. 2002; 225: 7-9.
- Katsinelos P., Paikos D., Kountouras J. et al. Tannenbaum and metal stents in the palliative treatment of malignant distal bileduct obstruction: a comparative study of patency and cost effectiveness. SurgEndosc 2006; 20: 1587–1593.
- May A., Ell C. A New Self-Expanding Nitinol Stent for Palliation of Malignant Biliary obstruction. Endoscopy 2004; 36: 329–333.
- Mehmet M.D., Aksungur E., Seydaolu G. Percutaneousplacement of biliary metallic stents in patients with malignanthilar obstruction, unilobar versus bilobar drainage. Journal ofVascular and Interventional Radiology. 2003; 14: 1409-1416.
- Yushidome H., Miyazaki M., Shimizu H. et al. Obstructivejaundice impairs hepatic sinusoidal endothelial cell functionand renders liver susceptible to hepatic ischemia/ reperfusion //J. Hepatology. 2000. V.33 (1). P.59-67.
Источник: Научно-практический журнал «Паллиативная медицина и реабилитация» № 1. 2018.
Источник
