Рак поджелудочной железы октреотид
ЗАБОЛЕВАЕМОСТЬ
- Заболеваемость нейроэндокринными опухолями желудочно-кишечного тракта и поджелудочной железы составляет приблизительно 3-5 случаев на 100 000 человек в год.
- НЭО ЖКТ и ПЖ могут развиться в любом возрасте, но чаще после 50 лет.
- При выявлении глюкогоном, гастрином, ВИПом, соматостатином метастазы в регионарные лимфоузлы определяются у 60-80% больных.
- Пятилетняя выживаемость при карциноиде составляет, в среднем, 50-67%. Лучшая медиана выживаемости бывает при локализации опухоли в прямой кишке (88%), бронхе (74%) и аппендиксе (71%).
Клинико-патогенетическая характеристика основных НЭО
| Тип опухоли | Секретируемые гормоны или амины | Клиническая симптоматика |
| Карциноид | Серотонин | Карциноидный синдром: приливы, диарея, бронхоспазм, гипертензия, поражение сердца. |
| Гастринома | Гастрин | Синдром Золлингера-Эллисона, тяжелые пептические язвы |
| ВИПома | Вазоинтестинальный полипептид | Тяжелая диарея («панкреатическая холера», синдром Вернера-Моррисона) |
| Инсулинома | Инсулин | Гипогликемия |
| Глюкагонома | Глюкагон | Диабет, мигрирующая некротическая эритема, раздражение и покраснение языка |
| Соматостатинома | Соматостатин | Дисфункция желчного пузыря, ЖКБ, нарушенная толерантность к глюкозе |
КАРЦИНОИД
Одна из наиболее часто встречающихся опухолей диффузной нейроэндокринной системы!
Опухоль секретирует:
- серотонин
- брадикинин
- 5-гидрокситриптофан
- простагландины
- ВИП
- гистамин
Это приводит к развитию карциноидного синдрома.
КАРЦИНОИДНЫЙ СИНДРОМ
Проявления:
- приливы (63-94%). Внезапное появление глубокой красной или фиолетовой эритемы верхней части туловища, в основном лица и шеи. Сопровождается неприятным ощущением тепла, слезотечением, зудом, отеком лица и конъюнктивитом, саливацией и потоотделением, ощущением пульсации.
- диарея (68-84%)
- бронхоспазм (3-19%)
- одышка (3-19%)
- телеангиэктазии (25%)
- изменения сердца (11-53%)
- пеллагроподобный синдром с гиперкератозом и пигментацией (2-6%)
- поражение сердца – карциноидный кардиальный синдром (синдром Хедингера)выявляется более чем у 50% больных.
Синдром обусловлен развитием фиброзных изменений в эндо- и миокарде правых отделов сердца с поражением клапанов.
Характерны стеноз и недостаточность трехстворчатого клапана и клапана легочной артерии.
КАРЦИНОИДНЫЙ КРИЗ
- Может возникать спонтанно или провоцироваться стрессами, алкоголем, некоторой пищей (например, сыром), инъекциями катехоламинов.
- Первоначальные приступы длятся 2-5 минут, а в дальнейшем их продолжительность может увеличиваться до нескольких часов.
- Кризы чаще возникают при суточной экскреции 5-ГИУК более 200 мг и провоцируются стрессами, наркозом, биопсией или операцией, химиотерапией, давая высокую летальность.
КЛАССИФИКАЦИЯ НЭО (ВОЗ, 2002 г.)
- Высокодифференцированная нейроэндокринная опухоль (доброкачественная).
- Высокодифференцированная нейроэндокринная карцинома (низкой степени злокачественности).
- Низкодифференцированная нейроэндокринная карцинома (мелкоклеточная).
- Смешанная экзокринная и эндокринная карцинома.
- Опухолевоподобное поражение.
Характеристика высокодифференцированных НЭО
- низкий пролиферативный потенциал
- способность секретировать различные биологические вещества
- низкая чувствительность к химиотерапии.
К ним относятся различные карциноиды передней, средней и задней кишки, феохромоцитома, медуллярный рак щитовидной железы.
Характеристика низкодифференцированных НЭО
- высокозлокачественные опухоли с высоким пролиферативным потенциалом
- чувствительны к химиотерапии и лучевой терапии.
К ним относится мелкоклеточный рак легкого и других органов.
Характеристика смешанных экзокринных и эндокринных карцином
- к ним относятся различные опухоли поджелудочной железы (кроме карциноидов)
- чувствительность к химиотерапии данных опухолей умеренная.
КЛАССИФИКАЦИЯ КАРЦИНОИДНЫХ ОПУХОЛЕЙ (ВИЛЬЯМС И САНДЛЕР, 1963)
- Верхние (2-9%) (передняя кишка): опухоли дыхательных путей, тимуса, пищевода, желудка, двенадцатиперстной кишки, поджелудочной железы. Характерна низкая секреция серотонина, повышенная – гистамина и различных гормонов, атипичное течение карциноидного синдрома, частое метастазирование в кости.
- Средние (75-87%) (средняя кишка): опухоли тонкой кишки, аппендикса, слепой кишки, восходящего отдела ободочной кишки. Гиперсекреция серотонина и других вазоактивных субстанций, карциноидный синдром.
- Нижние (1-8%) (задняя кишка): опухоли поперечно-ободочной и нисходящей ободочной кишки, сигмовидной и прямой кишки. Карциноидный синдром не характерен, частое метастазирование в печень.
Классификация в зависимости от наличия или отсутствия карциноидного синдрома
- Гормонально-активные опухоли – характерна гиперсекреция гормонов. Клинические симптомы позволяют осуществить раннюю диагностику.
- Гормонально-неактивные опухоли(нет симптомов гиперсекреции гормонов) – до 50% нейроэндокринных опухолей. Клинически проявляются при большой опухолевой массе – на этом этапе опухоль метастазирует, а также может проявляться симптомами сдавления кишки.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА
- Определение уровня серотонина и его метаболитов в моче. Наиболее распространенный тест – измерение экскреции 5-ГИУК (5-гидроксииндолуксусной кислоты) в суточной моче. Однако данный анализ может давать ложноположительные результаты в зависимости от характера употребляемой больными пищи (цитрусовые, бананы, ананасы, киви, орехи).
- Определение уровня хромогранина А в крови (повышение уровня хромогранина А наблюдают у 87-99% больных), норма – менее 4,5 ммоль/л. Этот плазменный маркер является самым достоверным при НЭО.
- Определение уровня экскреции нейронспецифической енолазы в крови.
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
Рентгенологические методы
- рентгенография органов грудной клетки
- рентгенография пищевода и желудка
- ирригоскопия
Эндоскопические методы
- ЭГДС
- ректороманоскопия
- колоноскопия
- бронхоскопия
Ультразвуковые методы
- УЗИ
- Ультразвуковая допплерография сосудов
- Эндосонография
- Интраоперационное УЗИ
- Лапароскопическое УЗИ
Спиральная КТ с контрастным усилением и МРТ
РАДИОИЗОТОПНАЯ ДИАГНОСТИКА
- Сцинтиграфия костей скелета
- Сцинтиграфия с Октреотидом, меченным 111In
НЭО на поверхности клеток имеют рецепторы, обладающие высоким сродством к гормону соматостатину. В 87% случаев они присутствуют как в первичной опухоли, так и в метастазах. В связи с этим в последние годы для определения локализации опухоли и метастазов используется радиоизотопный метод с меченным 111In Октреотидом. Введенный внутривенно Октреотид, 111In через 24-48 ч. определяется на соматостатиновых рецепторах и позволяет визуализировать соматостатинпозитивную опухоль, а также определить возможность применения аналогов соматостатина для лечения.
Метод с применением Октреотида, 111In обладает чувствительностью 87%, специфичностью 75% и частотой совпадения диагнозов 87%.
Лечение
Хирургическое лечение
Основной метод лечения НЭО – хирургический. Возможные варианты оперативного вмешательства определяют по локализации опухоли, наличию или отсутствию метастазов и осложнений опухолевого процесса. Однако контроль симптомов при хирургическом лечении достигается не всегда!
Немедикаментозное лечение
Контроль за проявлениями карциноидного синдрома: исключение стрессов, алкоголя, соблюдение диеты.
Медикаментозное лечение
Биотерапия:
- синтетические аналоги соматостатина: раствор для инъекций Октреотид и лиофилизат для приготовления суспензии для внутримышечного введения пролонгированного действия Октреотид-депо.
- интерферон-?, пролонгированная форма ИНФ-? (PEG-интерферон).
Химиотерапия:
- монохимиотерапия: стрептозоцин, доксирубицин, фторурацил, дактиномицин, этопозид, цисплатин, дакарбазин.
- ПХТ: сочетания стрептозоцина, фторурацила и доксирубицина, цисплатина с этопозидом.
Комбинированная химиотерапия:
биотерапия + химиотерапия.
Симптоматическая терапия:
- гипотензивные препараты
- антигистаминные препараты
- диуретики
- бронходилататоры
- антидиарейные препараты.
Механизм действия ОКТРЕОТИДА-ДЕПО
- Препарат оказывает симптоматический эффект, понижая секрецию гормонов и пептидов, экскретируемых при випомах в 89%, при глюкоганомах в 75%, при инсулиномах в 65%.
- После применения Октреотида-депо при разных НЭО диарея прекращается у 40-60% больных.
- При ВИПомах Октреотид-депо полностью прекращает диарею в 38%случаев, еще у 38% больных значительно её уменьшает.
- Улучшает общее состояние в 75-85% случаев.
- Октреотид-депо контролирует гипогликемию при инсулиномах, некролитические кожные повреждения при глюкоганомах, что значительно улучшает качество жизни пациентов.
При карциноидных опухолях применение Октреотида-депо может приводить к уменьшению выраженности симптомов заболевания, в первую очередь, таких как приливы и диарея. Во многих случаях клиническое улучшение сопровождается снижением концентрации серотонина в плазме и экскреции 5-гидроксииндолуксусной кислоты с мочой.
При опухолях, характеризующихся гиперпродукцией вазоактивного интестинального пептида (ВИПомы), применение Октреотида-депо приводит у большинства больных к уменьшению тяжелой секреторной диареи, которая характерна для данного состояния, что, в свою очередь, приводит к улучшению качества жизни больного. Одновременно происходит уменьшение сопутствующих нарушений электролитного баланса, например, гипокалиемии, что позволяет отменить энтеральное и парентеральное введение жидкости и электролитов. По данным компьютерной томографии у некоторых больных происходит замедление или остановка прогрессирования опухоли, и даже уменьшение ее размеров, особенно метастазов в печень. Клиническое улучшение обычно сопровождается уменьшением (вплоть до нормальных значений) концентрации вазоактивного интестинального пептида (ВИП) в плазме.
При глюкагономах применение Октреотида-депо в большинстве случаев приводит к заметному уменьшению некротизирующей мигрирующей сыпи, которая характерна для данного состояния. У больных, страдающих диареей, Октреотид-депо вызывает ее уменьшение, что сопровождается повышением массы тела. При применении Октреотида-депо часто отмечается быстрое снижение концентрации глюкагона в плазме, однако при длительном лечении этот эффект не сохраняется. В то же время симптоматическое улучшение остается стабильным длительное время.
При гастриномах/синдроме Золлингера-Эллисона Октреотид-депо, применяемый в качестве монотерапии или в комбинации с блокаторами H2-рецепторов и ингибиторами протонного насоса, может снизить образование соляной кислоты в желудке и привести к клиническому улучшению, в т.ч. и в отношении диареи. Возможно также уменьшение выраженности и других симптомов, вероятно связанных с синтезом пептидов опухолью, в т.ч. приливов. В некоторых случаях отмечается снижение концентрации гастрина в плазме.
У больных с инсулиномами Октреотид-депо уменьшает уровень иммунореактивного инсулина в крови. У больных с операбельными опухолями Октреотид-депо может обеспечить восстановление и поддержание нормогликемии в предоперационном периоде. У больных с неоперабельными доброкачественными и злокачественными опухолями контроль гликемии может улучшаться и без одновременного продолжительного снижения уровня инсулина в крови.
У больных с редко встречающимися опухолями, гиперпродуцирующими рилизинг-фактор гормона роста (соматолибериномами), Октреотид-депо уменьшает выраженность симптомов акромегалии. Это, по-видимому, связано с подавлением секреции рилизинг-фактора гормона роста и самого гормона роста. В дальнейшем возможно уменьшение размеров гипофиза, которые до начала лечения были увеличены.
Обнаружено, что применение Октреотида-депо в дозах 30 мг и выше оказывает антипролиферативный эффект, связанный с прямым цитотоксическим действием препарата на опухоль при взаимодействии с соматостатиновыми рецепторами, а также с угнетением образования сосудов, питающих опухоль.
Режим дозирования
При эндокринных опухолях ЖКТ и поджелудочной железы для больных, у которых подкожное введение Октреотида обеспечивает адекватный контроль проявлений заболевания, рекомендуемая начальная доза Октреотида-депо составляет 20 мг каждые 4 недели.
Подкожное введение Октреотида следует продолжать еще в течение 2 недель после первого введения Октреотида-депо.
Для больных, не получавших ранее Октреотид подкожно, рекомендуется начинать лечение именно с подкожного введения Октреотида в дозе 0.1 мг 3 раза/сут. в течение относительно короткого периода времени (примерно 2 недели) с целью оценки его эффективности и общей переносимости. Только после этого назначают Октреотид-депо по вышеприведенной схеме.
В случае, когда терапия Октреотидом-депо в течение 3 мес. обеспечивает адекватный контроль клинических проявлений и биологических маркеров заболевания, возможно снизить дозу Октреотида-депо до 10 мг, назначаемых каждые 4 недели.
В тех случаях, когда после 3 мес. лечения Октреотидом-депо удалось достичь лишь частичного улучшения, дозу препарата можно увеличить до 30 мг каждые 4 недели.
На фоне лечения Октреотидом-депо в отдельные дни возможно усиление клинических проявлений, характерных для эндокринных опухолей ЖКТ и поджелудочной железы. В этих случаях рекомендуется дополнительное подкожное введение Октреотида в дозе, применявшейся до начала лечения Октреотидом-депо. Это может происходить, главным образом, в первые 2 мес. лечения.
Октреотид-депо – препарат первой линии для монотерапии или комбинированной терапии высокодифференцированных нейроэндокринных опухолей ЖКТ и поджелудочной железы, эффективно купирующий гормональные синдромы за счет подавления гиперсекреции гормонов этими опухолями, повышая качество жизни и выживаемость больных.
Источник
Нейроэндокринные опухоли (НЭО) — это гетерогенная группа новообразований, развивающихся из нейроэндокринных клеток. Такие клетки расположены в различных органах и секретируют биологически активные вещества, эффекты которых обуславливают многообразие клинической картины и трудности диагностики. Прежде чем попасть на прием к онкологу, пациентам зачастую бывают проведены консультации различных специалистов, обращение к которым вызвано симптоматикой новообразования. Ранняя диагностика НЭО в значительной мере зависит от онконастороженности непрофильных клиницистов и, конечно же, от морфологической верификации диагноза — «золотого правила» в онкологии, своеобразной точки отсчета онкологической истории.
Локализация НЭО крайне разнообразна, но чаще всего они обнаруживаются в органах пищеварительной системы (более 50 %): прямая (17,2 %) и тонкая кишка (13,4 %), желудок (6,0 %), поджелудочная железа (6–7 %). НЭО занимают второе место в общей структуре онкологической патологии ЖКТ, уступая лидерские позиции лишь колоректальному раку. Около 27 % случаев НЭО возникают в легких (согласно базе данных Surveillance, Epidemiology, and End Results (SEER) 1975-2016) [1].
Еще недавно обсуждались вопросы включения НЭО в список орфанных заболеваний. Но в настоящее время отмечается увеличение частоты встречаемости этой патологии, в том числе из-за улучшения диагностических возможностей (в частности, распространение гастроскопии, колоноскопии, капсульной эндоскопии).
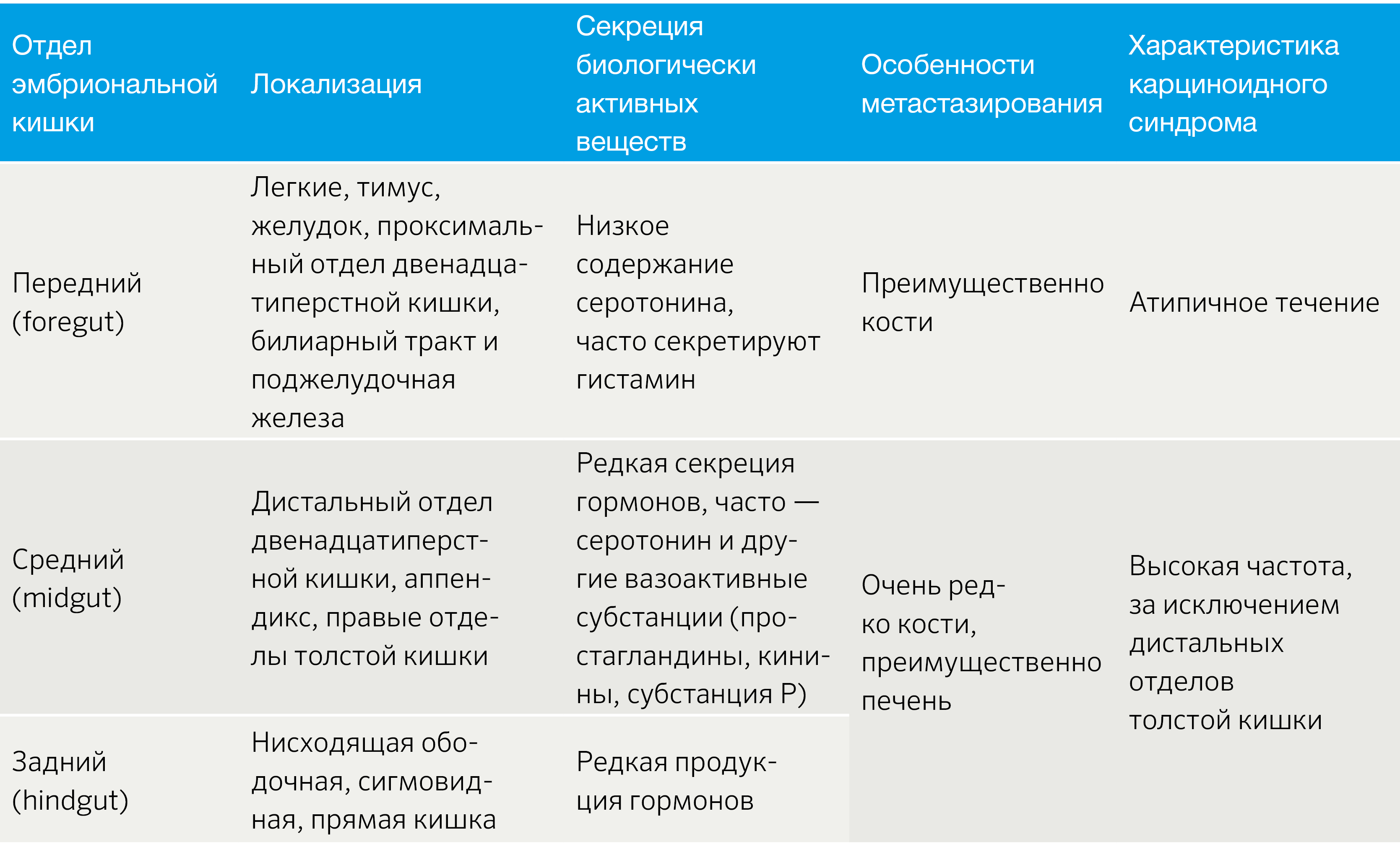
НЭО классифицируют в зависимости от отдела эмбриональной кишечной трубки: из передней, средней и задней кишки (табл. 1) [2].
Табл.1 | Классификация НЭО по эмбриогенезу [2].
Карциноидный синдром — важный клинический признак. В основном, он обусловлен эффектами серотонина, а также брадикинина, гистамина, дофамина и в меньшей степени других биологически активных веществ (БАВ).
Клинические проявления карциноидного синдрома разнообразны. Наиболее часто у пациентов отмечается гиперемия кожи лица, приливы, диарея, боль в животе. У 60 % пациентов отмечают формирование карциноидной болезни сердца, с нарушением работы преимущественно клапанного аппарата правых отделов (стеноз и/или недостаточность легочного и трехстворчатого клапанов). Серьезным осложнением является декомпенсация нарастающей сердечной недостаточности. Морфологическим субстратом служит выраженный диффузный фиброэластоз эндокарда. Возможны появления телеангиоэктазий, одышки, пеллагры, бронхоспазма. Усиливается продукция соединительнотканных компонентов, в частности, коллагена. Это ведет к фиброзированию и стенозу брыжеечных артерий, фиброзирующему стенозу уретры. Ввиду склонности к развитию спаечного процесса в брюшной полости нарастает риск формирования кишечной непроходимости.
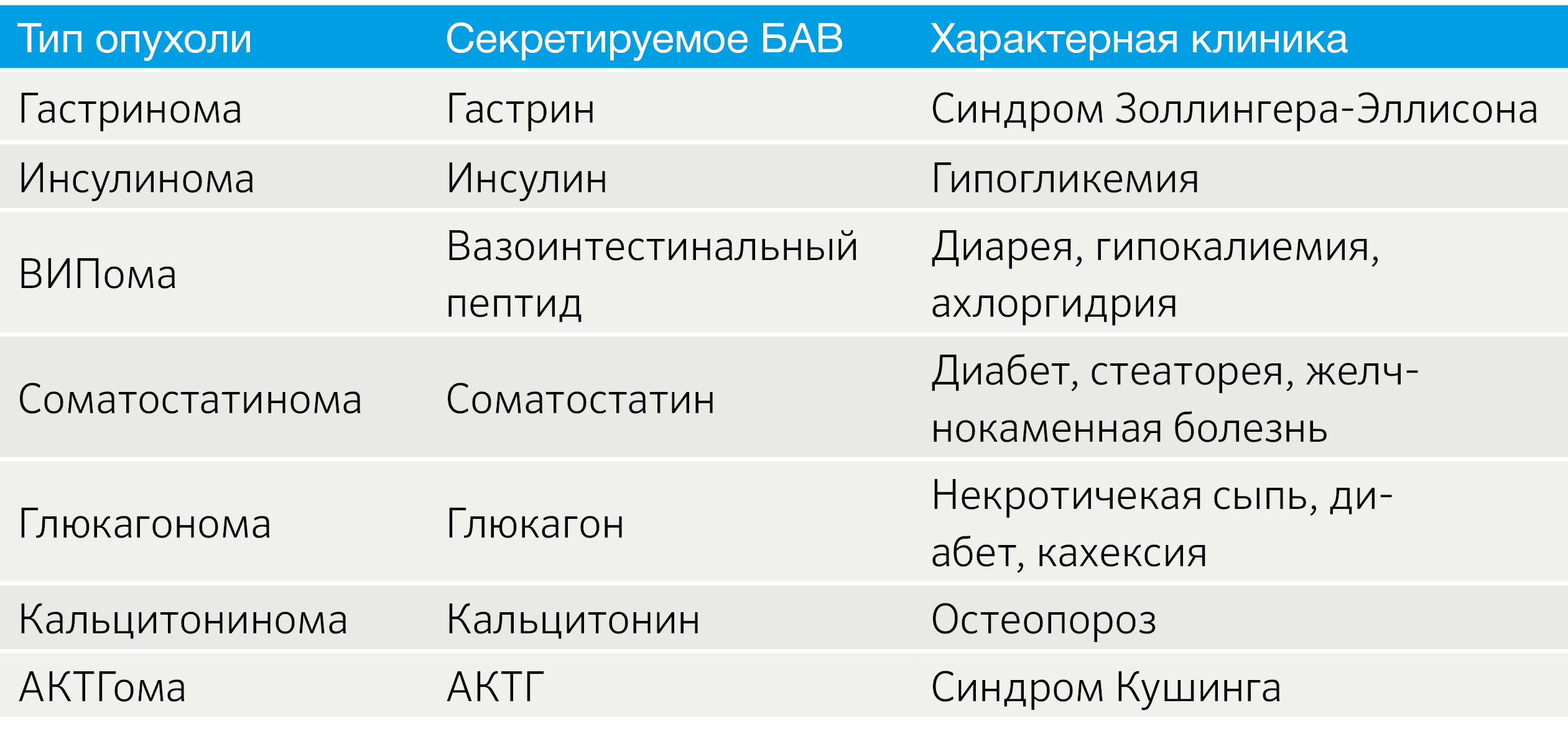
Важным аспектом является функциональный статус опухоли. В зависимости от наличия продукции БАВ выделяют функционирующие (табл. 2) и нефункционирующие новообразования [3].
Табл.2 | Функционирующие НЭО [3].
Особенности TNM-классификации определяются локализацией НЭО. НЭО легких стадируются как немелкоклеточный рак легких, для НЭО ЖКТ и поджелудочной железы разработаны рекомендации Европейского общества по изучению НЭО (ENETS) [4]. Также установление стадии TNM для всех анатомических локализаций регламентируется руководством, созданным Американским объединенным комитетом по раковым заболеваниям (the American Joint Committee on Cancer, AJCC) [5, 6]. Так как эти системы не идентичны, возникают вопросы унификации подходов к стадированию. Например, была создана модифицированная система ENETS (mENETS), для диагностики НЭО поджелудочной железы (pNET) (табл. 3) [7].
Табл.3 | Стадирование НЭО поджелудочной железы согласно модифицированной системе ENETS (mENETS) [7].
И вот мы подходим к той черепахе, на которой стоят киты онкологической диагностики. Это, несомненно, гистологическая верификация диагноза. Как и многие опухолевые заболевания, морфологические градации НЭО подвергались различным модификациям, уточнениям, дополнениям. Дискуссии в этой области в итоге привели к созданию 4-ой редакции классификации ВОЗ (2017 год) [8]. Именно она является актуальной на настоящий момент и заключение при проведении патологоанатомическом исследовании должно отвечать введенным в ней понятиям и требованиям.
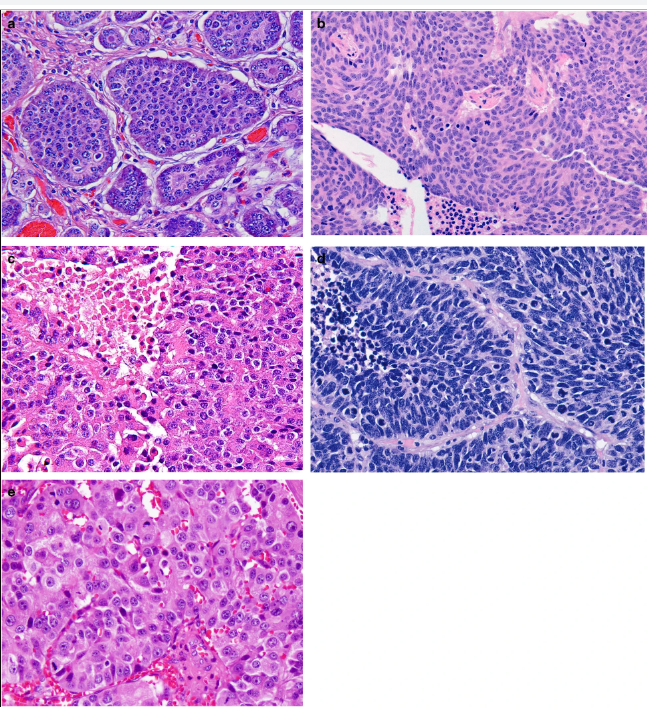
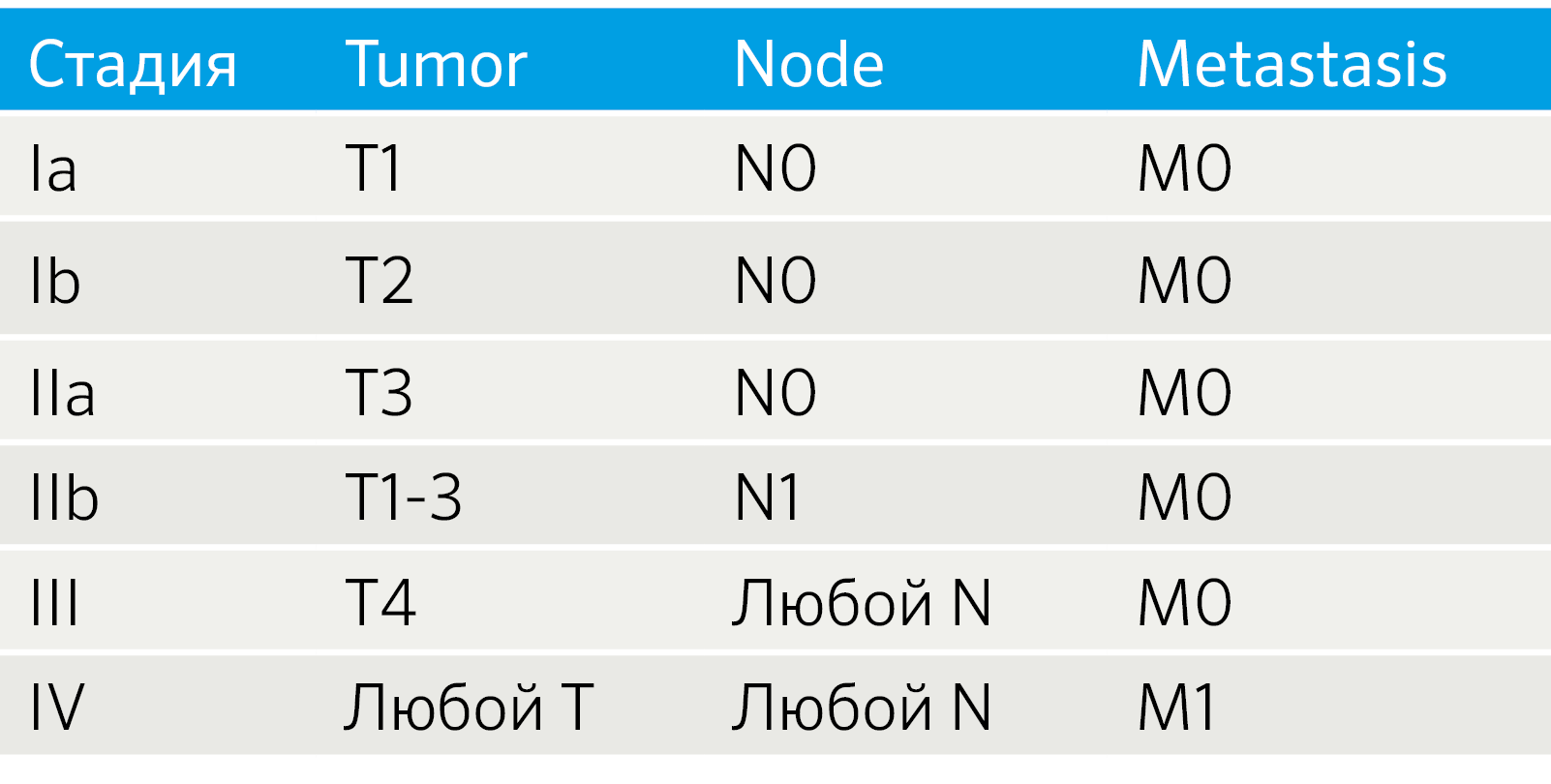
Параметрами морфологической оценки нейроэндокринных новообразований являются: гистологическое строение опухоли, определение сосудистой и периневральной инвазии, митотический индекс. Несмотря на многообразия источников НЭО, морфологическая картина является сходной (рис. 1) [9].

Рис.1 | Топическое многообразие нейроэндокринных опухолей (НЭО).
а — НЭО G1 (Grade) подвздошной кишки, б — НЭО G2 легкого (атипичный карциноид), с — НЭО G3 поджелудочной железы, d — мелкоклеточный НЭР легких, е — крупноклеточный НЭР поджелудочной железы. Окраска гематоксилин-эозин [9].
Нейроэндокринное происхождение атипичных клеток доказывает положительная экспрессия так называемых общих нейроэндокринных маркеров. Основные из них это хромогранин А, окрашивающий компоненты нейросекреторных гранул, и пептид синаптофизин, накапливающийся в мелких синаптических везикулах. Также применяется дополнительно установление экспрессии рецепторов соматостатина 2 и 5 типов (SSTR2 и SSTR5). В этом случае возможно определить чувствительность опухолевых клеток к аналогам соматостатина.
Степень злокачественности НЭО определяют на основании двух основных критериев: уровня дифференцированности опухолевых клеток и их пролиферативной активности. Традиционно выделяют три степени злокачественности (grade): G1, G2, G3. Для НЭО ЖКТ и поджелудочной железы введены понятия высокодифференцированных и низкодифференцированных новообразований (или нейроэндокринного рака (карциномы), НЭР). Высокодифференцированные НЭО объединяют G1 (менее 2 митозов на 10 репрезентативных полей зрения (РПЗ) при большом увеличении микроскопа (х400) и индекс Ki-67 ≤ 2%), G2 (2–20 митозов на 10 РПЗ и индекс Ki-67 3–20 %), G3 (> 20 митозов на 10 РПЗ и индекс Ki-67 > 20 %). Grade 3 опухоли разделяют на мелко- и крупноклеточный рак. Опухоли мелкоклеточного типа построены из однотипных клеток округлой, овальной или вытянутой формы, мелкого размера, со скудной цитоплазмой и нечеткими границами. Ядра имеют характерный вид за счет нежного хроматина и невизуализирующихся ядрышек. Определяются массивные некрозы. Крупноклеточные НЭР образованы, соответственно, клетками крупного или среднего размера, с низким ядерно-цитоплазматическим соотношением, выраженной атипией ядер, содержащих гранулярный хроматин и четкие ядрышки. В опухолевой ткани выявляются мультифокальные некрозы, значительное число митозов [8, 9].
Индекс Ki-67 определяют как средний процент окрашенных ядер при учете 500–2000 злокачественно трансформированных клеток (рис. 2) [9].
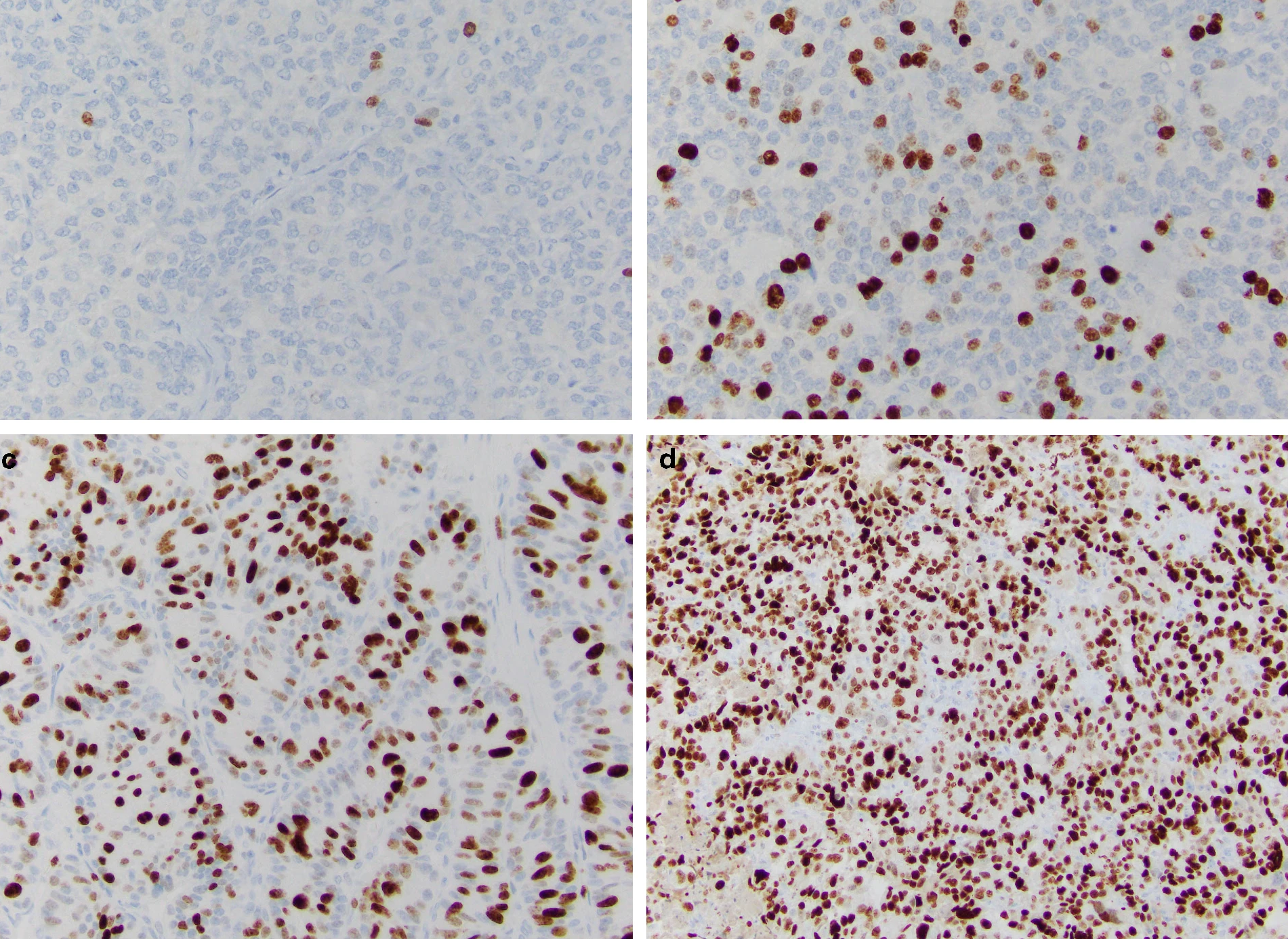
Рис.2 | Иммуногистохимическое определение индекса пролиферации (маркер Ki-67):
а — НЭО G1 (Grade) подвздошной кишки, б — НЭО G2 легкого (атипичный карциноид), с — НЭО G3 поджелудочной железы, d — мелкоклеточный НЭР легких [9].
Рассмотрим различия понятий НЭО G3 и НЭР при локализации в поджелудочной железе. Несмотря на высокую степень злокачественности НЭО G3 гистологически имеют органоидную модель строения (рис. 3), отсутствие некрозов [10]. При иммуногистохимическом исследовании опухолевая ткань сохраняет экспрессию общих маркеров нейроэндокринной дифференцировки (диффузно и интенсивно определяется экспрессия синаптофизина, зачастую хромогранина А), а также панкреатические экзокринные или эктопические гормоны. Кроме того, в них отсутствует выраженная экспрессия p53 и утрата экспрессии RB (также определяются иммуногистохимически).
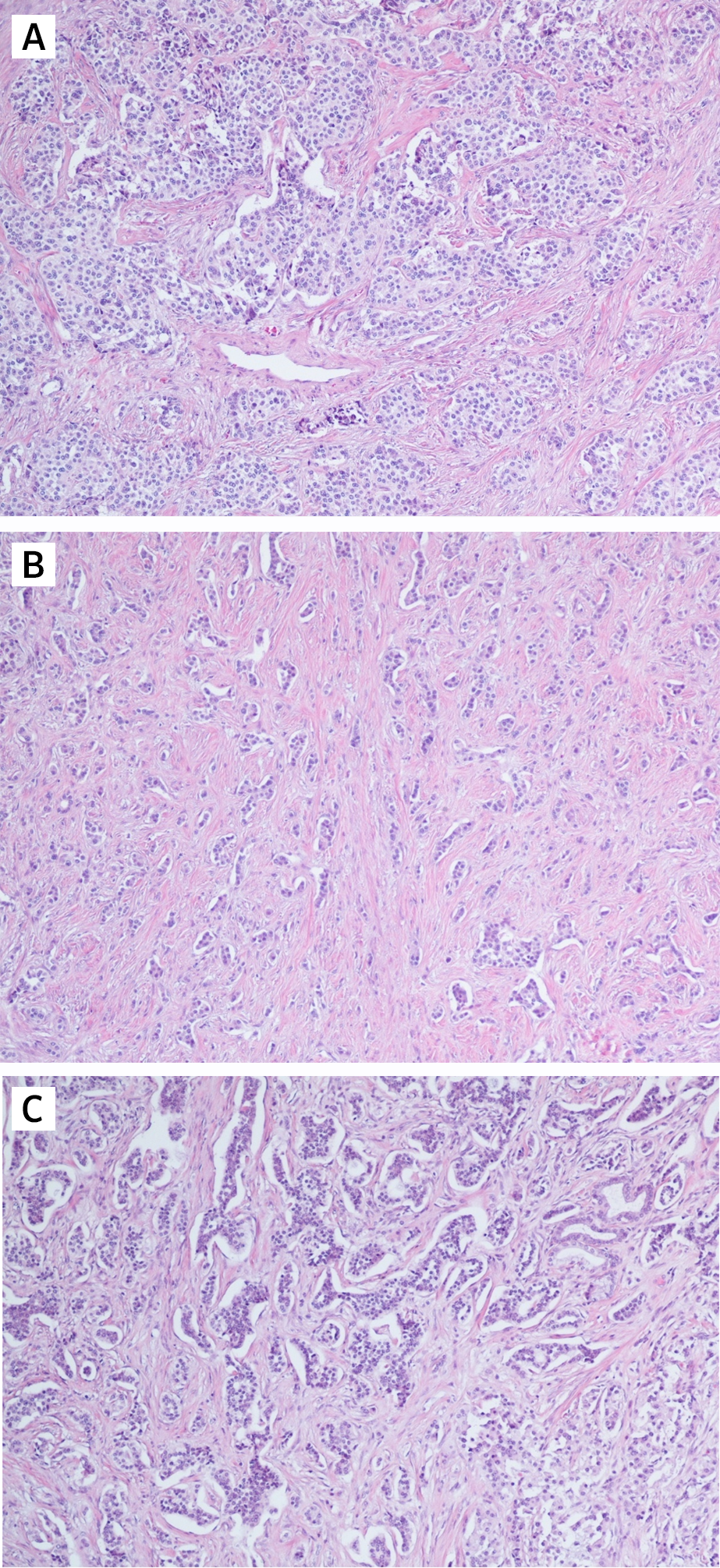
Рис.3 | Высокодифференцированная нейроэндокринная опухоль поджелудочной железы.
Отмечается наличие хорошо организованной гистоархитектуры: А — органоидный тип; В — псевдотрабекулярный тип; С — крибриформный тип. Окраска гематоксилин-эозин [10].
НЭР поджелудочной железы — это опухоли низкой степени дифференцировки и соответственно высокой степени злокачественности. Экспрессия общих маркеров нейроэндокринной дифференцировки атипичными клетками снижается: синаптофизин определяется слабо или диффузно, хромогранин А также слабо или фокально. Экзокринные гормоны отрицательны в таких опухолях [9]. Часто определяется экспрессия р53, белков ремоделирования хроматина DAXX (death-associated protein 6) и ATRX (АТФ-зависимая хеликаза), потеря экспрессии RB (белок ретинобластомы) и ISL1 (энхансер гена инсулина 1) [11].
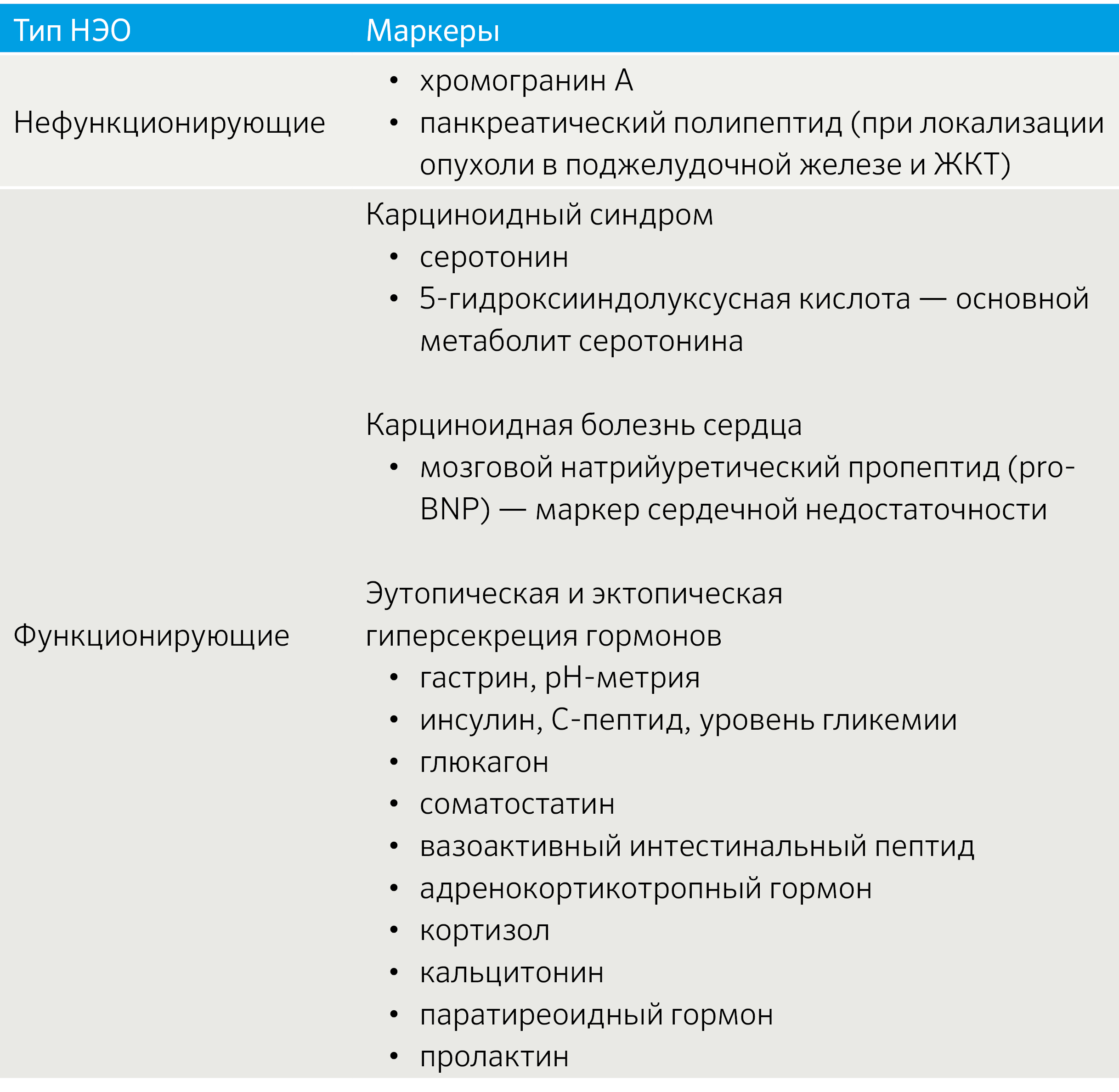
Ввиду многообразия секретирующего профиля НЭО биохимическая диагностика включает различные маркеры, комбинируемые с учетом клинической картины (табл. 4).
Табл. 4 | Спектр биохимических маркеров НЭО [2].
Методы лучевой диагностики включают «классические» КТ и МРТ с контрастированием. Для оценки метастатического поражения печени возможно проведение УЗИ органов брюшной полости.
Радионуклидная диагностика играет важную роль в топической характеристике НЭО. Она включает методы специфической метаболической визуализации (123I-MIBG), рецепторной визуализации (111In-октреотид, 68Ga-DOTA-TOС/DOTA-NOC/DOTA-TATE) и неспецифической метаболической визуализации (18F-FDG, 18F-DOPA).
123
I-метайодбензилгуанидин (MIBG) является аналогом норадреналина (норэпинефрина). Он накапливается в адренергических тканях и опухолях, происходящих из них. Сцинтиграфия с 123I-MIBG используется для диагностики нейробластомы, феохромоцитомы, параганглиомы, карциноидов бронха и тонкой кишки [12].
Для рецепторной визуализации применяют 111In (индий)-октеотид. Он выявляет высокодифференцированные нейроэндокринные опухоли, опухоли из клеток островкового аппарата поджелудочной железы (гастринома, глюкагонома, инсулинома). Также для верификации НЭО ЖКТ применяется соматостатин-рецепторная сцинтиграфия, так как большинство из них имеют рецепторы к соматостатину (SSTR) на поверхности опухолевых клеток (чаще 2 и 5 типа).
Выбор радионуклидного метода связан со степенью дифференцировки опухолевых клеток. Первичная диагностика НЭО Grade 1 и 2 проводится путем ПЭТ/КТ с радиофармпрепаратами (РФП), мечеными галлием 68 (является ПЭТ-радионуклидом). Сродство (аффинитет) РФП к конкретному подтипу трансмембранных рецепторов соматостатина определяет выбор диагностического индикатора (ПЭТ-лиганда, представленного различными модификациями DOTA). Например, для визуализации НЭО, экспрессирующих рецепторы подтипов SSTR2a и SSTR2b, применяют 68Ga-DOTA-TATE (DOTA-Tyr3-октреотад). 68Ga-DOTA-NOC (DOTA-1-Nal3-октреотид) выявляет подтипы SSTR3 и SSTR5, 68Ga-DOTA-ТOC (DOTA-Tyr3-октреотид) — рецепторы SSTR5 [13].
При отсутствии возможности проведения данного исследования следует выполнить однофотонную эмиссионную компьютерную томографию (ОФЭКТ)/КТ (гибридный метод визуализации) с соматостатин-рецепторным радиофармпрепаратом.
Для недифференцированных НЭО Grade 3 и НЭР при отрицательных результатах соматостатин-рецепторной сцинтиграфии рекомендуется ПЭТ неспецифическая метаболическая визуализация с использованием других РФП. В частности, ПЭТ/КТ c 18F-фтордезоксиглюкозой (18F-ФДГ), которая неэффективна при высокодифференцированных НЭО [14]. Также рассматривают применение 18F-L–DOPA (дигидроксифенил-аланин) — меченого предшественника допамина, который эффективен для обнаружения медуллярного рака щитовидной железы, НЭО, параганглиомы и феохромоцитомы [15].
Современные классификации НЭО в значительной мере основаны на общей морфологии, которую эти новообразования демонстрируют в различных анатомических участках. Закономерно предположить, что такая структурная схожесть является результатом общей «нейроэндокринной» мультигенной программы, стимулирующей дифференцировку нейроэндокринных клеток. Но схожесть не означает идентичность, и несомненно существующая тканеспецифичность нейроэндокринных клеток диктует характерною индивидуальную гормональную продукцию. Профиль экспрессии БАВ атипичными клетками определяет клиническую картину и прогноз заболевания. Поэтому важно иметь возможность точно определяет источник опухоли. С использованием все расширяющихся диагностических возможностей такой подход становится реальным, формируя персонализацию терапевтических стратегий в нейроэндокринной онкологии.
Список литературы:
1. Surveillance, Epidemiology, and End Results (SEER) Program (www.seer.cancer.gov) Research Data (1975-2016), National Cancer Institute, DCCPS, Surveillance Research Program, released April 2019, based on the November 2018 submission.
2. Kloppel G. Neuroendocrine Neoplasms: Dichotomy, Origin and Classifications. Visc Med. 2017;33:324–30.
3. Oronsky B., Ma P.C., Morgensztern D., Carter C.A. Nothing But NET: A Review of Neuroendocrine Tumors and Carcinomas. Neoplasia. 2017;19(12):991–1002.
4. https://www.enets.org/current_…
5. Сайт AJCC https://cancerstaging.org/Page…
6. Amin M.B. et al. (Eds.). AJCC Cancer Staging Manual (8th edition). Springer International Publishing: American Joint Commission on Cancer; 2017.
7. Luo G.et al. Modified Staging Classification for Pancreatic Neuroendocrine Tumors on the Basis of the American Joint Committee on Cancer and European Neuroendocrine Tumor Society Systems. Journal of Clinical Oncology 2017;35(3):274-280.
8. Lloyd R.V., Osamura R.Y., Klöppel G., Rosai J. WHO Classification of Tumours of Endocrine Organs. 4th ed. Lyon: International Agency for Research on Cancer; 2017. 355 p.
9. Rindi G. et al. A common classification framework for neuroendocrine neoplasms: an International Agency for Research on Cancer (IARC) and World Health Organization (WHO) expert consensus proposal. Mod Pathol. 2018;31:1770–1786.
10. Surgical pathology images of pancreatic neuroendocrine tumors of pancreas, contributed by Sabrina Sopha, M.D. https://www.pathologyoutlines.c…
11. Scarpa A. et al. Whole-genome landscape of pancreatic neuroendocrine tumours. Nature. 2017;543:65–71.
12. Maxwell J.E., O’Dorisio T.M., Howe J.R. Biochemical Diagnosis and Preoperative Imaging of Gastroenteropancreatic Neuroendocrine Tumors. Surg Oncol Clin N Am.2016;25(1):171-94.
13. Wild D.et al. Comparison of 68Ga-DOTANOC and 68Ga-DOTATATE PET/CT within patients with gastroenteropancreatic neuroendocrine tumors. J Nucl Med. 2013;54(3):364-72.
14. Navalkissoor S, Flux G, Bomanji J. Molecular radiotheranostics for neuroendocrine tumours. Clin Med (Lond). 2017;17(5):462–468.
15. Pretze M., Wängler C., Wängler B. 6-[18F]fluoro-L-DOPA: a well-established neurotracer with expanding application spectrum and strongly improved radiosyntheses. Biomed Res Int. 2014;2014:674063
Источник
