После резекции поджелудочной железы ее культя ушивается

Великий Пирогов как-то сказал: «Операция – позор для медицины». Сюда надо добавить – и для пациента тоже.
Наше постоянное нежелание лечить начинающиеся недомогания, ожидание того, что само пройдет со временем, пренебрежение элементарными нормами здорового поведения приводят нас на операционный стол. Абсолютно неожиданно.
Любая операция – огромный стресс для организма. Операции на поджелудочной железе в 25% случаях приводит к летальному исходу, а в 100% к инвалидности. Продолжительность жизни пациентов после операции невелика.
Виды хирургических вмешательств на поджелудочной железе
Сегодня на поджелудочной железе операции проводят следующими методами:
- Ушивание. Данный метод используется в случаях когда есть маленькие повреждения краев органа, которые не нарушают целость органа.
- Некрэктомия. Данный метод используют при наличии обширного гнойного воспаления, которое затрагивает близ лежащие органы.
- Цистоэнтеростомия назначается при наличии псевдокист с отсутствующим нагноением содержимого.
- Марсуниализация назначается для удаления псевдокист с тонкими, несформированными стенками или если присутствует гноение ее содержимого.
- Трансдуоденальная сфинктеровирсунгопластика назначается для лечения стенозе.
- Вирсунгодуоденостомия. Этот метод выполняется при непроходимости протоков.
- Папиллотомия. Используется для удаления доброкачественных опухолей или злокачественных опухолей маленьких размеров.
- Продольная панкреатоеюностомия. Данный метод проводится в случае хронического ицдуративного панкреатита, протекающего с нарушением проходимости протоков.
- Левосторонняя резекция. Выполняется в случае очаговых поражениях тела или хвоста поджелудки с нарушением ее целостности.
- Панкреатодуоденальная резекция. Производится при сильных деструктивных патологиях головки поджелудки и развитии опухолей.
- Тотальная дуоденопанкреатэктомия. Эту операцию назначают при множественных разрывах, опухолях, поразивших все железу, при отсутствии метастазов.
- Левосторонняя спланхникэктомия с резекцией левого узла солнечного сплетения назначается при хроническом панкреатите с болевым синдромом и выраженным фиброзом железы.
- Правосторонняя спланхникэктоми. Цель данного метода — изолировать путь передачи болевого импульса от головки и желчных путей железы.
- Постганглионарная невротомия.
Причины проведения операции
При проведении операции возникает много трудностей из-за ее строения, местоположения и физиологии.
Железа состоит из железистой, нежной ткани. Сшивать ее очень трудно, повредиться она может от простого прикосновения пальцем.
Это непарный орган, железа располагается рядом с почками, вокруг нее находятся полые вены, брюшная аорта, артерия, желчные протоки, с двенадцатиперстной кишкой она имеет общее кровообращение. Часто при удалении части железы приходится удалять и двенадцатиперстную кишку. Добрать до этого органа, не повредив окружающие ткани, также очень сложно.
Из-за большой активности ферментов, которые железа вырабатывает, при отклонении от нормы, ферменты могут переваривать саму железу, вместо пищи. Если при проведении операции фермент попадет в кровь, то произойдет немедленный сильнейший шок.
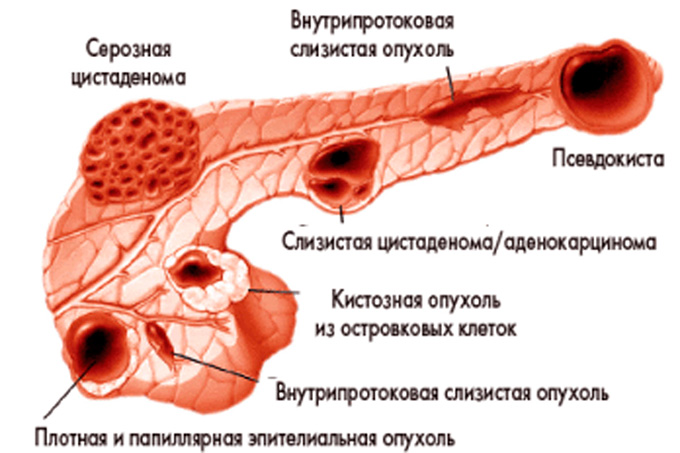
Из-за особенностей строения этого органа в его клетках могут образовываться опухали, кисты, абсцессы, камни. Все это можно вылечить только оперативным путем.
Операции на поджелудочной железе не распространены в связи их большой сложностью и высоким процентом смертности. Ограниченное число причин являются показателем к их проведению:
- панкреонекроз,
- опухоли, злокачественные и доброкачественные,
- травма с повреждением большей частью железы,
- развитие кисты,
- врожденные пороки,
- перитонит,
- камни в закупоренных протоках,
- абсцессы и свищи.
Операции часто проходят в несколько этапов, так как провести весь объем работы сразу невозможно.
Основные методы проведения операций
Поведение поджелудочной железы при ее заболевании непредсказуемо, причины многих болезней поджелудочной железы неясны. По поводу лечения большинства заболеваний существуют значительные разногласия.
Сегодня возможно проведение операции по пересадке железы, но пациент в среднем проживет после этой операции около трех лет. Железа не переносит отсутствие кровотока больше, чем в полчаса. При заморозке ее можно использовать, не больше пяти часов. При пересадке она помещается не на свое место, а в брюшину.
Пересадка поджелудочной железы является самым неизученным методом в трансплантологии.
В связи с большими техническими сложностями, пересадку железы практически не делают. Ведется поиск по новым методам проведения операции, проходят исследования в области изготовления искусственной железы.
Причины проведения операций различны, методов проведения также довольного много, не менее пятнадцати вариантов:
- ушивание повреждения поджелудочной железы,
- неврэктомия,
- цистоэнтеростомия,
- марсуниализаци кисты,
- левостороння резекция,
- папиллотомия и другие.
Операции делают опытные хирурги в самых необходимых случаях.
Восстановление
Длительность лечения пациента после операции зависит от состояния его здоровья до нее и от метода проведения операции, выбранным хирургом.
Болезнь, которая потребовала хирургического вмешательства, после него продолжает оказывать влияние на пациента, определяет методы профилактических мероприятий и стиль жизни пациента.
Восстановлению удаленных частей железы невозможно, полностью ее тоже никогда не удаляют. После операции человек страдает от отсутствия гормонов и ферментов удаленной части железы, пищеварительная деятельность организма нарушена навсегда.
В период восстановления после проведения операции на поджелудочной железе пациент длительное время находится в реабилитационном отделении больницы. Нередки бывают различные послеоперационные осложнения:
- перитонит,
- кровотечения,
- осложнение сахарного диабета,
- почечная недостаточность,
- недостаточность кровообращения.
Восстановление в медицинском центре длится до двух месяцев в стационаре, пищеварительному тракту надо приспособиться к измененным условиям функционирования.
После операции человека переводят на искусственное внутривенное питание. Длительность периода искусственного питания оказывает существенное влияние на выздоровление. Внутривенное питание проводят от 5 до10 дней. Проведение такого режима питания позволяет свести к минимуму осложнения после операции.
Послеоперационные методы реабилитации больного включают в себя следующие процедуры:
- строгое диетическое питание,
- регулярные физические нагрузки,
- использование инсулина для регулирования сахара,
- употребление ферментов для переваривания пищи.
Необходим постоянный врачебный контроль состояния пациента для предупреждения возможных осложнений.
В течение двух недель после выписки из больницы, больному рекомендуется полный покой и постельный режим.
Прогулки, чтение книг и другая посильная физическая нагрузка добавляется в расписание пациента по его самочувствию, переутомляться категорически нельзя.
Стратегия лечения разрабатывается лечащим врачом после знакомства с историей болезни, сравнения анализов до операции и после нее.
В диете должно быть исключено употребление алкоголя, жирной, острой и кислой пищи.
Хотя состояние здоровья человека после операции зависит от метода ее проведения, качества проведения лечебных процедур после нее, однако смертность после операции остается очень высокой.
Удаление поджелудочной
Хирургическое вмешательство по удалению поджелудки (панкреатэктомия) обычно назначают при лечении рака. За время операции могут удалить всю железу или какая-либо ее часть. Также могут удалить соседние органы, такие как:
- селезенка и желчный пузырь,
- лимфа узлы,
- часть тонкого кишечника или желудка.
Прогноз после операции
Прогноз после проведенного хирургического вмешательства на поджелудочной железе зависит от многих факторов:
- способ проведенной операции,
- какое было предоперационное состояние больного,
- качества диспансерных и лечебных мероприятий,
- правильное питание и активная помощь больного.
Удаление кист, острый панкреатит, камни в поджелудочной железе и другие патологические состояния, для избавления от которых проводилось операционное вмешательство, и при которых удалялся весь орган или же только часть органа не перестает влиять на общее состояние пациента и на общий прогноз.
Например, проведенная операция при раке грозит развитию рецидивов. По этой причине прогноз выживаемости после такой операции не очень высокий. Онкобольным, после операции при возникновении любых неприятных симптомов назначают специальные дополнительные обследования, чтоб вовремя определить развитие раковых рецидивов и развитие метастаз.
Жизнь без операций
В темном лесу малоизученной области болезней и операции на поджелудочной железе есть лучик надежды, который нам дарят врачи-натуропаты.
Легендарный диетолог Арнольд Эрет еще в начале 20 века писал: «Все болезни без исключения происходят исключительно от неестественной пищи и от каждого грамма излишнего питания». Подумайте, какой же неестественной стала пища в начале 21 века.

Для избавления от болезней не надо быть сыроедом или вегетарианцем, достаточно всего лишь следовать принципам живого питания, которые указал нам Эрет в одноименной книге.
Люди ищут причины болезней в чем угодно – в инфекциях, внезапных воспалениях органов, врожденных дефектах, но только не в пище. Поэтому причины многих болезней сегодня таинственны и необъяснимы. Почитайте в медицинской энциклопедии причины болезней они почти всегда неизвестны.
Привычка есть в десять раз больше, чем необходимо организму, причем в большинстве своем вредную пищу, играет с человечеством злую шутку.
Любая болезнь означает наличие чужеродных веществ, то есть шлаков в организме человека. Избавиться от них может быть просто и сложно одновременно.
Простота заключается в общеизвестных рекомендациях: резко сократить объем пищи, чтобы очистить организм. Пища должна быть натуральной и естественной. Физические упражнения ускоряют процесс очищение организма. Очень полезны солнечные ванны для оздоровления тела. Воздушные ванны имеют не меньшее значение, чем водные, потому что воздух важнее для организма, чем питание.
Сложность заключается в нежелании менять жизнь к лучшему даже под страхом смерти. И это нежелание очень трудно устранить даже при наличии большого желания. Попробуйте сами.
Диета после хирургических вмешательств на поджелудочной железке
Очень важным моментом после вмешательства на поджелудочной считается диета, а также лечебное питание. После проведенного вмешательства органы пищеварения не могут работать на полную. С помощью диеты уменьшается нагрузка на них. Меню диеты и ее длительность индивидуально назначает врач.
Обычно, при недугах и патологиях больным нужно отказаться от любых продуктов, повышающих выработку ферментов, которые способствуют расщеплению пищи. После хирургического вмешательства на поджелудочную ее функциональность нужно компенсировать медикаментозными препаратами. Для нормализации уровня сахара в крови врач может назначить инъекции инсулина. Также нередко врачи прописывают прием витамином А, Е, К, Д и В12.

Послеоперационное лечебное питание обычно состоит из следующих этапов:
1) Искусственная форма питания:
с помощью зонда,
парентеральное питание,
смешанное питание,
2) Естественная форма питание.
После проведенного оперативного вмешательства хорошее влияние оказывает искусственное питание.
Диетотерапия в этот период состоит из следующих этапов:
1-й этап. Только парентеральное питание в течении 7-12 дней. Длительность данного этапа, напрямую зависит от сложности операции.
2-й этап. Данный этап является переходом на естественное питание и тут используют частичное парентеральное питание.
3-й этап. Больному назначают полностью естественное питание. Нужно очень не спеша увеличивать нагрузку на органы пищеварения больным:
сначала, первую неделю больным назначают диета № 0,
после, на вторую неделю назначают диету № 1а,
потом, еще на неделю рекомендуется переход на диету №1б,
следующим этапом на протяжении до двух месяцев назначают первый вариант диеты №5п,
затем на период полгода-год назначают второй вариант диеты №5п.
После выписки больного из больницы необходимо ограничить прием следующих продуктов:
картофель,
мучные изделия,
специи и приправы,
цельное молоко,
кофе,
сладкое,
жареные продукты,
пища с грубой растительной клетчаткой.
Питание больного обязательно должно содержать белки, и минимально содержать жиры, сахар и углеводы.
Весь послеоперационный период больной должен находится под строгим контролем врача, чтоб предупредить развитие различных негативных патологий.
Загрузка…
Источник
Егоров Вячеслав Иванович — доктор мед. наук, зам. главного врача по онкологии Городской клинической больницы №14 им. В.Г. Короленко, профессор кафедры хирургии Института профессионального образования Первого МГМУ им. И.М. Сеченова., Городская клиническая больница №14 им. В.Г. Короленко Департамента здравоохранения г. Москвы; ГБОУВПО “Первый МГМУ им. И.М. Сеченова ” Минздрава России, v.egorov61@gmail.com, 107014, Москва, ул. Стромынка, 7, Российская Федерация
Профилактика развития и лечение панкреатической послеоперационной фистулы, или несостоятельности панкреатодигестивного анастомоза, являются серьезной и до сих пор актуальной проблемой. Дискуссия о том, какой метод выбрать для этого, продолжается. В обзоре обсуждается эффективность и целесообразность экстирпации культи поджелудочной железы и тотальной дуоденопанкреатэктомии в лечении и профилактике осложнений после резекций поджелудочной железы.
Ключевые слова:
резекция поджелудочной железы, панкреатодуоденальная резекция, тотальная дуоденопанкреатэктомия, экстирпация культи поджелудочной железы, панкреатическая фистула, недостаточность панкреатодигестивного анастомоза, pancreatic resection, pancreatodoudenectomy, total duodenopancreatectomy, pancreatic stump extirpation, pancreatic fistula, pancreatico-digestive anastomosis failure
Extirpation of Pancreatic Stump and Total Duodenopancreatectomy for Prevention and Treatment of Complications after Pancreatic Surgery
Egorov V. I.
Egorov Viacheslav Ivanovich — Doct. of Med. Sci., Head of Surgical Oncology Department of V.G. Korolenko Municipal Clinical Hospital No 14, professor of Chair of Surgery, Institute of Postgraduate Education, I.M. Sechenov First Moscow State Medical University, V.G. Korolenko Municipal Clinical Hospital No 14, Department of Health, Moscow; I.M. Sechenov First Moscow State Medical University, v.egorov61@gmail.com, 7, Stromynka Str., 107014 Moscow, Russia
Prevention and management of postoperative pancreatic fistula or pancreatico-digestive anastomosis failure still remains a major problem. There is an ongoing dispute in relation to the choice of treatment. This review article discusses advisability and effectiveness of pancreatic stump extirpation and total duodenopancreatectomy in prevention and management of postoperative complications after pancreatic resection.
Панкреатическая послеоперационная фистула (ППФ), или несостоятельность панкреатодигестивного анастомоза (ПДА), – самое частое осложнение резекций поджелудочной железы, возникающее в специализированных отделениях с частотой до 30% [1]. Более 4/5 панкреатических фистул после проксимальных, центральных и дистальных резекций излечиваются консервативно, либо с использованием современных интервенционных методов. Больные не умирают собственно от ППФ, но опасность их заключается в том, что истечение панкреатического сока в окружающее пространство может в 1,5-15% случаев приводить к аррозивным кровотечениям из магистральных перипанкреатических артерий (реже вен) и/или к развитию распространенного перитонита (1-2%), при которых летальность достигает 14-64% [2-9].
Именно аррозии перипанкреатических артерий на фоне ППФ или внутрибрюшных абсцессов являются основной причиной смерти после резекций поджелудочной железы. Чаще аррозии сосудов возникают после проксимальных резекций, когда панкреатический сок активируется одновременно с ним истекающей желчью. По этой причине внутрибрюшные и внутрипросветные кровотечения встречаются значительно реже после дистальных и центральных резекций. Для предотвращения этого осложнения предлагались различные меры: использование для ПДА желудка вместо кишки, биологические покрытия анастомозов, применение аналогов соматостатина и многочисленные модификации ПДА, однако преимущества ни одного из этих методов не были доказаны [10-23] .
Релапаротомия после ПДР по поводу ППФ – это часто операция отчаяния, последний шанс на спасение больного, который обычно в этот момент находится в критическом состоянии после профузного кровотечения или на фоне распространенного перитонита. При этом предполагается, что операция будет сопровождаться как минимум разобщением панкреатоэнтероанастомоза, риском повреждения билиодигестивного сосустья и массивной кровопотерей в случае удаления культи ПЖ. Во всех таких случаях перед хирургом стоит серьезная проблема выбора: удалять оставшуюся железу или нет. Преимуществами оставления культи ПЖ являются простота, короткое время операции , меньшая кровопотеря и сохранение эндокринной функции железы [24]. Релапаротомия может быть закончена дренированием зоны несостоятельности ПДА, наружным дренированием панкреатического протока, стентированием («bridge stenting» [25]) или окклюзией его фибринным клеем и ушиванием культи ПЖ [26]. Недостатком сохранения культи является высокий риск сохранения ППФ, повторного кровотечения и некупируемой инфекции, что фатально для этих пациентов. Удаление культи значимо снижает эти риски, но несет в себе проблемы нестабильного диабета с его осложнениями [27-29], хотя недавними исследованиями было показано, что качество жизни пациентов после тотальной панкреатэктомии не отличается от такового при диабете другой этиологии.
Smith CD и др. (1992) сообщили о том, что с 1964 по 1988гг. в Mayo Clinic, Rochester, США, было выполнено 178 (38%) релапаротомий после 479 ПДР, из них 11 больным произведена экстирпация культи ПЖ по поводу перитонита (9) и интраабдоминального кровотечения (2) с летальностью 64%. Все эти вмешательства были предприняты у крайне тяжелых больных, как последняя возможность спасения жизни [9].
Farley DR и др. (1996) из Хайдельбергского университета в г. Манхайм (Германия) сообщили о 15 экстирпаций культи ПЖ по поводу перитонита (8), кровотечения (1) и панкеронекроза(7). Все операции сопровождались выраженными техническими трудностями и кровопотерей: среднее время операции составило 2,7 часа, средняя кровопотеря – 1897 мл. Уровень осложнений и летальности составил, соответственно, 41% и 24% [30]. Авторы обоих исследований пришли к выводу, что экстирпация культи ПЖ требуется редко, но при возникновении показаний ее своевременное выполнение позволяет снизить летальность.
Gueroult S. и др. (2004) из Université Pierre et Marie Curie, Paris, Франция, рассматривая исходы экстирпации культи ПЖ у 8 больных с перитонитом (при летальности 37,5%), приходят к выводу о том, что в случае перитонита на фоне ППФ, адекватная санация брюшной полости и контроль инфекции может быть достигнут только после экстирпации культи ПЖ [31].
Tamijmarane A. И др. (2006) из Queen Elizabeth Hospital, Edgbaston, Birmingham, Великобритания, анализируя 25 наблюдений экстирпации культи по поводу перитонита (n=12), кровотечения (n=5) и их сочетания (n=8), заключают, что, несмотря на высокий уровень осложнений и летальности(48%), экстирпация культи ПЖ должна применяться для лечения осложнений резекций ПЖ [32] .
В сообщении Balzano G. И др. (2013) из San Raffaele Scientific Institute, Milan, Италия [33], сравнивались две группы больных, перенесших релапаротомию после ПДР в связи с поздним кровотечением (n = 19) и перитонитом (n = 12). В 17 случаях культя ПЖ была сохранена, а в 14 – удалена вместе с селезенкой. Летальность (27,8%), кровопотеря и необходимость в компонентах крови не отличались при сравнении групп. После экстирпации культи ПЖ релапаротомии требовались значительно реже (7% vs 59%, P < 0.01), а время пребывания в реанимации было короче (P= 0.058). Среди 11 последних пациентов, перенесших экстирпацию куьти умер только 1. В 7 случаях после экстирпации культи проводилась аутотрансплантация островковых клеток для уменьшения метаболических эффектов ТДПЭ. В заключении авторы склоняются к экстирпации культи как к предпочтительному методу лечения ППФ, осложненных кровотечением и/или перитонитом.
С течением времени становилось ясно, что критическим фактором является не экстирпация ПЖ, а время ее выполнения: чем раньше делалась операция, тем чаще пациенты выживали, а опоздание грозило смертью. Естественно, что идеально было бы предвидеть эту ситуацию и делать ТДПЭ сразу вместо ПДР, и этому был посвящен ряд исследований.
Факторами, предрасполагающими к несостоятельности ПДА являются жировая инфильтрациия поджелудочной железы (ПЖ), «сочная», мягкая железа без признаков фиброза, нерасширенный панкреатический проток, массивная интраоперационная кровопотеря и мультивисцеральные резекции [11,19,34,35].
M.S. Janot et al., к 2010г. выполнили 63 тотальных дуоденопанкератэктомий (ТДПЭ), из них у 18 пациентов ТДПЭ (28.6%) была выполнена в связи с техническими проблемами при наложении панкреатикоеюноанастомоза и у 15 (23.8%) пациентов выполнена экстирпация культи железы в связи с развившимися послеоперационными осложнениями после панкреатодуоденальных резекций (ПДР). Общее количество пациентов с вынужденной технически обусловленной первичной ТДПЭ и экстирпацией культи ПЖ в послеоперационном периоде составило 52.4% от всех ТДПЭ выполненных в клинике за 4 года. «Техническим» показанием к выполнению вмешательства была мягкая, рыхлая паренхимы железы, обычно на фоне жировой инфильтрации, неспособная удерживать швы. Обращает на себя внимание тот факт, что у 13 пациентов этой группы была протоковая аденокарцинома малых размеров (T1 и Т2), и у двух – рак терминального отдела холедоха T2. По всей вероятности, именно малыми размерами опухоли объяснялось отсутствие параканкрозных склеротических изменений железы, с сохранением рыхлой ее текстуры, что и привело к невозможности безопасного формирования соустья. Показаниями к экстирпации железы после проксимальных или дистальных резекций органа были недостаточность панкреатикоеюноанастомоза или культи железы с развитием профузного аррозивного кровотечения (8), в двух – панкреонекроз культи железы с развитием перитонита, в двух – несостоятельность билиодигестивного анастомоза; у 3 пациентов показаниями к ТДПЭ явились перфорация двенадцатиперстной кишки при эндоскопической ретроградной панкреатохолангиографии (ЭРХПГ), профузное кровотечение из распадающейся опухоли двенадцатиперстной кишки и кровотечение в просвет гигантской постнекротической кисты. Необходимо отметить, что в группе пациентов, которым ТДПЭ выполнялась ввиду технических проблем, послеоперационной летальности не было, в то время как среди пациентов, перенесших ТДПЭ в связи с послеоперационными осложнениями, летальность составила 47% [1].
Опыт клиник с большим потоком профильных больных показывает, что при совокупности факторов риска несостоятельности анастомоза или технических проблемах при его формировании, хирург интраоперационно может принять решение о выполнении первичной «профилактической» тотальной панкреатэктомии. В случае развития аррозивного кровотечения или перитонита при неэффективности консервативной терапии и методов интервенционной радиологии альтернативы ТДПЭ может не быть [13,14, 34,35, 36, 37,38].
К 2009 году, наибольшее количество ТДПЭ было выполнено в университетской клинике Хайдельберга (Германия). С 2001 по 2006 годы было сделано 147 таких операций; из них, в 23 (15,6%) случаях экстирпация культи железы была произведена по жизненным показаниям в послеоперационном периоде после резекций железы в связи панкреонекрозом ее культи и/или недостаточностью ПДА [37]. ТДПЭ составили 10% всех резекций при злокачественных заболеваниях ПЖ, из них около 15% были выполнены «по техническим соображениям», либо вследствие ППФ. Такое количество экстирпаций ПЖ в этом «высокопоточном» хирургическом отделении, а также данные других авторов, заставляют пересмотреть место ТДПЭ в хирургии ПЖ, с учетом того, что именно профессор M.W. Buchler восемью годами раньше считал, что «…панкреатоэнтероанастомоз может быть очень надежным, если накладывается опытным хирургом – панкреатологом» [35].
Основными показаниями к выполнению 57 ТДПЭ в университетской клинике г. Мюнхена (Германия) были внутрипротоковые папиллярно-муцинозные опухоли главного панкератического протока (md-IPMN), а также хрупкая структура железы, препятствовавшая наложению безопасного панкреатодигестивного анастомоза [39].
Данные представленные в литературе, персональное общение с зарубежными коллегами и мой личный опыт убеждают меня в том, что послеоперационные аррозивные кровотечения — это то, чего хирург – панкреатолог должен бояться в первую очередь. Наблюдая фатальные последствия неадекватной оценки вероятности этого осложнения, а также хорошее качество жизни больных после тотальной дуоденопанкреатэктомии, я сегодня искренне полагаю, что при наличии «хрупкой» поджелудочной железы, ее выраженной жировой инфильтрации, при сомнениях в надежности ПДА, а также при необходимости артериальной резекции во время резекции ПЖ (чаще при больших нейроэндокринных или солидно-псевдопапиллярных опухолях [40]) хирург может и должен решаться на тотальную дуоденопанкреатэктомию. Именно это и есть эффективная профилактика арозивного послеоперационного кровотечения.
Если же кровотечение случилось, и кровопотеря большая, а методы интервенционной радиологии неэффективны или недоступны, единственным шансом для больного является ТДПЭ. При этом фактор времени имеет большое значение, и задержка с операцией может быть фатальной. Необходимо иметь в виду два обстоятельства: 1. спустя 10-12 дней после ПДР при наличии ППФ экстирпация культи будет исключительно трудным и «кровавым» вмешательством из-за выраженного воспалительного инфильтрата и 2. надежда на чудо и наблюдение после остановившегося внутрибрюшного кровотечения после ПДР, осложненной ППФ, практически всегда заканчивается смертью больного.
Таким образом, ТДПЭ или экстирпация культи ПЖ может быть эффективным и часто единственным методом лечения при трудностях в процессе формирования соустья с высоким риском развития его несостоятельности или неэффективности консервативного лечения послеоперационных аррозивных кровотечений и/или перитонита после резекций поджелудочной железы. Наряду с другими, своевременное и обоснованное применение ТДПЭ является важным методом снижения уровня осложнений и летальности после резекций поджелудочной железы [30].
Список литературы
- Janot M.S., Belyaev O., Kersting S., Chromik A.M., Seelig M. H., Sulberg D., Mittelkotter U, Uhl W. H. Indications and Early Outcomes for Total Pancreatectomy at a High-Volume Pancreas Center. Clinical Study. HPB Surgery Volume 2010. Article ID 686702, 8 pages doi:10.1155/2010/686702
- Choi JJ, Choi H, Shin DS, Song IS, Bae JS. Risk factors for the pancreatic leakage after pancreaticoduodenectomy.Korean J Hepato Pancreat Surg 2005; 9: 225-232
- Sanjay P, Fawzi A, Fulke JL, Kulli C, Tait IS, Zealley IA, Polignano FM Late Post Pancreatectomy Haemorrhage. Risk Factors and Modern Management JOP. J Pancreas (Online) 2010 May 5; 11(3):220-225.
- Lee HG, Heo JS, Choi SH, Choi DW Management of bleeding from pseudoaneurysms following Pancreaticoduodenectomy World J Gastroenterol 2010 March 14; 16(10): 1239-1244
- De Castro SM, Busch OR, Gouma DJ. Management of bleeding and leakage after pancreatic surgery. Best Pract Res Clin Gastroenterol 2004; 18: 847-864
- Koukoutsis I, Bellagamba R, Morris-Stiff G, Wickremesekera S, Coldham C, Wigmore SJ, Mayer AD, Mirza DF, Buckels JA, Bramhall SR. Haemorrhage following pancreaticoduodenectomy: risk factors and the importance of sentinel bleed. Dig Surg 2006; 23: 224-228
- Rumstadt B, Schwab M, Korth P, Samman M, Trede M. Hemorrhage after pancreatoduodenectomy. Ann Surg 1998; 227: 236-241
- Таразов П.Г., Гранов Д.А., Поликарпов А.А., Козлов А.В., Попов С.А., Шаповал С.В., Гуло А.С. Рентгеноэндоваскулярная остановка артериального кровотечения после обширных хирургических вмешательств по поводу рака поджелудочной железы. Вестник хирургии им. И.И.Грекова, 2012. 1.24-308
- Smith CD, Sarr MG, vanHeerden JA. Completion pancreatectomy following pancreaticoduodenectomy: clinical experience. World J Surg. 1992 ;16(3):521-4.
- Aranha G.V., Aaron J.M., Shoup M. Critical analysis of a large series of pancreaticogastrostomy after pancreaticoduodenectomy. Arch Surg. 2006 Jun;141(6):574-9; discussion pp. 579-80.
- Ball CG, Howard TJ.Does the type of pancreaticojejunostomy after Whipple alter the leak rate? Adv Surg. 2010;44:131-48.
- Benzoni E, Zompicchiatti A, Saccomano E, Lorenzin D, Baccarani U, Adani G, Noce L, Uzzau A, Cedolini C, Bresadola F, Intini S. Postoperative complications linked to pancreaticoduodenectomy. An analysis of pancreatic stump management. J Gastrointestin Liver Dis. 2008 Mar;17(1):43-7.
- Buchler M, Friess H, Klempa I, et al. Role of octreotide in the prevention of postoperative Postoperative complications following pancreatic resection. Am J Surg. 1992;163:125-131.
- Friess H, Beger HG, Sulkowski U, et al. Randomized controlled multicentre study of the prevention of complications by octreotide in patients undergoing surgery for chronic pancreatitis [published correction appears in Br J Surg. 1996;83:126]. Br J Surg. 1995;82:1270-1273
- Kazanjian KK, Hines OJ, Eibl G, Reber HA. Management of pancreatic fistulas after pancreaticoduodenectomy: results in 437 consecutive patients. Arch Surg. 2005 Sep;140(9):849-54; discussion 854-6.
- Lai EC, Lau SH, Lau WY.Measures to prevent pancreatic fistula after pancreatoduodenectomy: a comprehensive review. Arch Surg. 2009 Nov;144(11):1074-80.
- Lillemoe KD, Cameron JL, Kim MP, et al. Does fibrin glue sealant decrease the rate of pancreatic fistula after pancreaticoduodenectomy? results of a prospective randomized trial. J Gastrointest Surg. 2004;8:766-774.
- Lowy AM, Lee JE, Pisters PW, et al. Prospective, randomized trial of octreotide to prevent pancreatic fistula after pancreaticoduodenectomy for malignant disease. Ann Surg. 1997;226:632-641.
- Ramacciato G, Mercantini P, Petrucciani N, Nigri GR, Kazemi A, Muroni M, Del Gaudio M, Balesh A, Cescon M, Cucchetti A, Ravaioli M. Risk factors of pancreatic fistula after pancreaticoduodenectomy: a collective review. Am Surg. 2011 Mar;77(3):257-69.
- Sarr MG; Pancreatic Surgery Group. The potent somatostatin analogue vapreotide does not decrease pancreas-specific complications after elective pancreatectomy: a prospective, multicenter, double-blinded, randomized, placebocontrolled trial. J Am Coll Surg. 2003;196:556-565
- Suc B, Msika S, Fingerhut A, et al. Temporary fibrin glue occlusion of the main pancreatic duct in the prevention of intra-abdominal complications after pancreatic resection: prospective randomized trial. Ann Surg. 2003;237:57-65.
- Yeo CJ, Cameron JL, Maher MM, et al. A prospective randomized trial of pancreaticogastrostomy versus pancreaticojejunostomy after pancreaticoduodenectomy. Ann Surg. 1995;222:580-588.
- Yeo CJ, Cameron JL, Lillemoe KD, et al. Does prophylactic octreotide decrease the rates of pancreatic fistula and other complications after pancreaticoduodenectomy? results of a prospective randomized placebo-controlled trial. Ann Surg.2000;232:419-429.
- Dellaportas D, Tympa A, Nastos C, Psychogiou V, Karakatsanis A, Polydorou A et al. (2010) An ongoing dispute in the management of severe pancreatic fistula: pancreatospleenectomy or not? World J Gastrointest Surg 2:381–384
- Kent TS, Callery MP, Vollmer CM Jr. (2010) The bridge stent technique for salvage of pancreaticojejunal anastomotic dehiscence. HPB12:577–582
- De Castro SM, Busch OR, van Gulik TM, Obertop H, Gouma DJ. (2005) Incidence and management of pancreatic leakage after pancreatoduodenectomy. Br J Surg 92:1117–1123
- Billings BJ, Christein JD, Harmsen WS, Harrington JR, Chari ST, Que FG et al. (2005) Quality-of-life after total pancreatectomy: is it really that bad on long-term follow-up? J Gastrointest Surg 9:1059–1066
- Kahl S, Malfertheiner P. (2004) Exocrine and endocrine pancreatic insufficiency after pancreatic surgery. Best Pract Res Clin Gastroenterol 18:947–955
- Jethwa P, Sodergren M, Lala A, Webber J, Buckels JA, Bramhall SR et al. (2006) Diabetic control after total pancreatectomy. Dig Liver Dis 38:415–419.
- Farley DR, Schwall G, Trede M.Completion pancreatectomy for surgical complications after pancreaticoduodenectomy. Br J Surg. 1996,83(2):176-9.
- Gueroult S, Parc Y, Duron F, Paye F, Parc R. Completion pancreatectomy for postoperative peritonitis after pancreaticoduodenectomy: early and late outcome. Arch Surg. 2004 Jan;139(1):16-9
- Tamijmarane A, Ahmed I, Bhati CS, Mirza DF, Mayer AD, Buckels JA, Bramhall SR. Role of completion pancreatectomy as a damage control option for post-pancreatic surgical complications. Dig Surg. 2006;23(4):229-34. Epub 2006 Aug 28
- Balzano G, Pecorelli N, Piemonti L, Ariotti R, Carvello M, Nano R, Braga M, Staudacher C. Relaparotomy for a pancreatic fistula after a pancreaticoduodenectomy: a comparison of different surgical strategies. HPB (Oxford). 2013 Feb 20. doi: 10.1111/hpb.12062. [Epub ahead of print]
- Van Berge Henegouwen MI, De Wit LT, Van Gulik TM, Obertop H, Gouma DJ. Incidence, risk factors, and treatment of pancreatic leakage after pancreaticoduodenectomy: drainage versus resection of the pancreatic remnant. J Am Coll Surg 1997. 185:18–24.
- Z’Graggen K, Uhl W, Friess H, Buchler MW. How to do a safe pancreatic anastomosis. J Hepatobiliary Pancreat Surg. 2002.9:733– 737
- Beger H., Matsumo S., Cameron J.L. Diseases of the pancreas. Current surgical therapy. Springer – Berlin, Heidelberg, New York – 2008. p.945.
- Kulu Y., Schmied B.M., Werner J., Muselli P., Buchler M.W, Schmidt J. Total pancreatectomy for pancreatic cancer: indications and operative technique. HPB 2009, 11, 469–475.
- Muller MW, Friess H, Kleeff J, Dahmen R, Wagner M, Hinz U, Breisch-Girbig D, Ceyhan GO, Buchler MW. Is there still a role for total pancreatectomy? Ann Surg. 2007 Dec;246(6):966-74.
- Friess H. Surgery in pancreatic cancer. Лекция. XI съезд Научного общества гастроэнтерологов России «Патология органов пищеварения и ассоциированные с ней заболевания», 5 марта 2011 г.
- Egorov VI, Kharazov AF, Pavlovskaya AI, Petrov RV, StarostinaNS, Kondratiev EV, Filippova EM. Extensive multiarterial resection attending total duodenopancreatectomy and adrenalectomy for MEN-1-associated neuroendocrine carcinomas. World J Gastrointest Surg. 2012 Oct 27;4(10):238-45.
- Егоров В.И., Вишневский В.А., Коваленко З.А., Лебедева А.Н., Мелехина О.В. Тотальная панкреатэктомия. Обзор литературы. Хирургия, 2012. 7. 85-92.
Источник
