Поджелудочная железа островок лангерганса

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 апреля 2020; проверки требуют 2 правки.
Островки Лангерга́нса — скопления гормон-продуцирующих (эндокринных) клеток, преимущественно в хвостовой части поджелудочной железы. Открыты в 1869 году немецким патологоанатомом Паулем Лангергансом (1849—1888). Островки составляют приблизительно 1—2 % массы поджелудочной железы. Поджелудочная железа взрослого здорового человека насчитывает около 1 миллиона островков (общей массой от одного до полутора граммов), которые объединяют понятием орган эндокринной системы.
Историческая справка[править | править код]
Пауль Лангерганс, будучи студентом-медиком, работая у Рудольфа Вирхова, в 1869 году описал скопления клеток в поджелудочной железе, отличавшиеся от окружающей ткани, названные впоследствии его именем[2][3]. В 1881 году К. П. Улезко-Строганова впервые указала на эндокринную роль этих клеток[4]. Инкреаторная функция поджелудочной железы была доказана в Страсбурге (Германия) в клинике крупнейшего диабетолога Наунина Mering и Minkowski в 1889 году — открыт панкреатический диабет и впервые доказана роль поджелудочной железы в его патогенезе[3]. Русский учёный Л. В. Соболев (1876—1919) в диссертации «К морфологии поджелудочной железы при перевязке её протока при диабете и некоторых других условиях» показал, что перевязка выводного протока поджелудочной железы приводит ацинозный (экзокринный) отдел к полной атрофии, тогда как панкреатические островки остаются нетронутыми. На основании опытов Л. В. Соболев пришёл к выводу: «функцией панкреатических островков является регуляция углеводного обмена в организме. Гибель панкреатических островков и выпадение этой функции вызывает болезненное состояние — сахарное мочеизнурение»[3].
В дальнейшем благодаря ряду исследований, проведенных физиологами и патофизиологами в различных странах (проведение панкреатэктомии, получение избирательного некроза бета-клеток поджелудочной железы химическим соединением аллоксаном), получены новые сведения об инкреаторной функции поджелудочной железы.
В 1907 году Lane & Bersley (Чикагский университет) показали различие между двумя видами островковых клеток, которые они назвали тип A (альфа-клетки) и тип B (бета-клетки).
В 1909 году бельгийский исследователь Ян де Мейер предложил называть продукт секреции бета-клеток островков Лангерганса инсулином (от лат. insula — островок). Однако прямых доказательств продукции гормона, влияющего на углеводный обмен, обнаружить не удавалось[3].
В 1921 году в лаборатории физиологии профессора J. Macleod в Торонтском университете молодому канадскому хирургу Фредерику Бантингу и его ассистенту студенту-медику Чарлзу Бесту удалось выделить инсулин.
В 1955 году Сангеру и соавторам (Кембридж) удалось определить последовательность аминокислот и строение молекулы инсулина[3].
В 1962 году Марлин и соавторы обнаружили, что водные экстракты поджелудочной железы способны повышать гликемию. Вещество, вызывающее гипергликемию, назвали «гипергликемическим-гликогенолитическим фактором». Это был глюкагон — один из основных физиологических антагонистов инсулина[3].
В 1967 году Донатану Стейнеру и соавторам (Чикагский университет) удалось обнаружить белок-предшественник инсулина — проинсулин. Они показали, что синтез инсулина бета клетками начинается с образования молекулы проинсулина, от которой в последующем по мере необходимости отщепляется С-пептид и молекула инсулина[3].
В 1973 году Джоном Энсиком (Вашингтонский университет), а также рядом учёных Америки и Европы была проведена работа по очистке и синтезу глюкагона и соматостатина[3].
В 1976 году Gudworth & Bottaggo открыли генетический дефект молекулы инсулина, обнаружив два типа гормона: нормальный и аномальный. последний является антагонистом по отношению к нормальному инсулину[3].
В 1979 году благодаря исследованиям Lacy & Kemp и соавторов появилась возможность пересадки отдельных островков и бета-клеток, удалось отделить островки от экзокринной части поджелудочной железы и осуществить трансплантацию в эксперименте. В 1979—1980 гг. при трансплантации бета-клеток преодолён видоспецифический барьер (клетки здоровых лабораторных животных имплантированы больным животным другого вида)[3].
В 1990 году впервые выполнена пересадка панкреатических островковых клеток больному сахарным диабетом[3].
Типы клеток[править | править код]
Данная диаграмма демонстрирует структурные отличия между панкреатическими островками крысы (вверху) и человека (внизу) pars ventralis pancreas (брюшная часть) — слева; pars dorsalis pancreas (спинная часть) — справа. Различные типы клеток окрашены по-разному: альфа-клетки — красным, бета-клетки — синим, дельта-клетки — фиолетовым, ПП-клетки — зелёным, эпсилон-клетки — жёлтым. Бета-клетки грызуна, в отличие от человека сгруппированы в характерное инсулиновое ядро.
Альфа-клетки[править | править код]
- Альфа-клетки составляют 15…20 % пула островковых клеток — секретируют глюкагон (естественный антагонист инсулина).
Бета-клетки[править | править код]
- Бета-клетки составляют 75…80 % пула островковых клеток — секретируют инсулин (с помощью белков-рецепторов проводит глюкозу внутрь клеток организма, активизирует синтез гликогена в печени и мышцах, угнетает глюконеогенез).
Дельта-клетки[править | править код]
- Дельта-клетки составляют 3…10 % пула островковых клеток — секретируют соматостатин (угнетает секрецию многих желез);
ПП-клетки[править | править код]
- ПП-клетки составляют 3…5 % пула островковых клеток — секретируют панкреатический полипептид (подавляет секрецию поджелудочной железы и стимулирует секрецию желудочного сока).
Эпсилон-клетки[править | править код]
- Эпсилон-клетки составляют <1 % пула островковых клеток — секретируют грелин[5][6] («гормон голода» — возбуждает аппетит).
Строение островка[править | править код]
Панкреатический островок является сложно устроенным функциональным микроорганом с определённым размером, формой и характерным распределением эндокринных клеток. Клеточная архитектура островка влияет на межклеточное соединение и паракринную регуляцию, синхронизирует высвобождение инсулина.
Долгое время считалось, что островки человека и экспериментальных животных сходны как по строению, так и по клеточному составу. Работы последнего десятилетия показали, что у взрослых людей преобладающим типом строения островков является мозаичный, при котором клетки всех типов перемешаны по всему островку, в отличие от грызунов, для которых характерен плащевой тип строения клеток, при котором бета-клетки формируют сердцевину, а альфа-клетки находятся на периферии. Однако, эндокринная часть поджелудочной железы имеет несколько типов организации: это могут быть единичные эндокринные клетки, их небольшие скопления, небольшие островки (диаметром < 100 мкм) и крупные (зрелые) островки.
Небольшие островки имеют у человека и грызунов одинаковое строение. Зрелые островки Лангерганса человека обладают выраженной упорядоченной структурой. В составе такого островка, окруженного соединительнотканной оболочкой, можно выявить дольки, ограниченные кровеносными капиллярами. Сердцевину долек составляет массив бета-клеток, на периферии долек в непосредственной близости с кровеносными капиллярами находятся альфа- и дельта-клетки. Таким образом, клеточная композиция островка зависит от его размера: относительное число альфа-клеток увеличивается вместе с размером островка, в то время как относительное число бета-клеток уменьшается[7].
См. также[править | править код]
Примечания[править | править код]
- ↑ 1 2 Foundational Model of Anatomy
- ↑ Langerhans P. Beiträge zur mikroskopischen Anatomie der Bauchspeicheldrüse : Inaugural-Dissertation, zur Erlangung der Doctorwürde in der Medicine und Chirurgie vorgelegt der Medicinischen Facultät der Friedrich-Wilhelms-Universität zu Berlin und öffentlich zu vertheidigen am 18. Februar 1869 (нем.). — Berlin: Buchdruckerei von Gustav Lange, 1869.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Клиническая диабетология / Ефимов А. С., Скробонская Н. А. — 1-е изд. — К.: Здоровья, 1998. — 320 с. — 3000 экз. — ISBN 5-311-00917-9.
- ↑ Жуковский М. А. Детская эндокринология. — 3-е изд. — М.: Медицина, 1995. — 656 с. — 8000 экз. — ISBN 5-225-01167-5.
- ↑ K. M. Andralojc, A. Mercalli, K. W. Nowak. et al. Ghrelin-producing epsilon cells in the developing and adult human pancreas (англ.). (недоступная ссылка)
- ↑ Epsilon cells (Cytokines&Cells Encyclopedia) (англ.). Архивировано 26 октября 2012 года.
- ↑ Прощина А. Е., Савельев С. В. Иммуногистохимическое исследование распределения α- и β-клеток в разных типах островков Лангерганса поджелудочной железы человека // Бюллетень экспериментальной биологии и медицины. — Изд. РАМН, 2013. — Т. 155, № 6. — С. 763—767. Архивировано 25 ноября 2015 года.
Ссылки[править | править код]
Источник
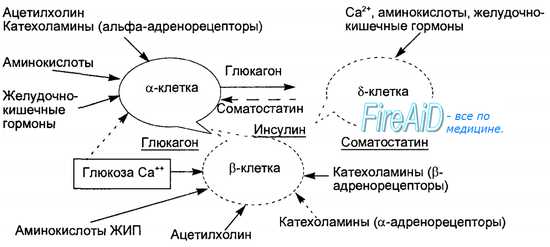
Оглавление темы “Гормон околощитовидных желез. Гормоны эпифиза. Гормоны поджелудочной железы. Гормоны половых желез. Гормоны тимуса.”: Гормоны поджелудочной железы. Островки Лангерганса. Соматостатин. Амилин. Регуляторные функции гормонов поджелудочной железы.Эндокринную функцию в поджелудочной железе выполняют скопления клеток эпителиального происхождения, получившие название островков Лангерганса и составляющие всего 1 —2 % массы поджелудочной железы — экзокринного органа, образующего панкреатический пищеварительный сок. Количество островков в железе взрослого человека очень велико и составляет от 200 тысяч до полутора миллионов. В островках различают несколько типов клеток, продуцирующих гормоны: альфа-клетки образуют глюкагон, бета-клетки — инсулин, дельта-клетки — соматостатин, джи-клетки — гастрин и РР- или F-клетки — панкреатический полипептид. Помимо инсулина в бета-клетках синтезируется гормон амилин, обладающий противоположными инсулину эффектами. Кровоснабжение островков более интенсивно, чем основной паренхимы железы. Иннервация осуществляется постганлионарными симпатическими и парасимпатическими нервами, причем среди клеток островков расположены нервные клетки, образующие нейроинсулярные комплексы.
Инсулин синтезируется в эндоплазматическом ретикулуме бета-клеток вначале в виде пре-проинсулина, затем от него отщепляется 23-аминокис-лотная цепь и остающаяся молекула носит название проинсулина. В комплексе Гольджи проинсулин упаковывается в гранулы, в них осуществляется расщепление проинсулина на инсулин и соединительный пептид (С-пептид). В гранулах инсулин депонируется в виде полимера и частично в комплексе с цинком. Количество депонированного в гранулах инсулина почти в 10 раз превышает суточную потребность в гормоне. Секреция инсулина происходит путем экзоцитоза гранул, при этом в кровь поступает эквимолярное количество инсулина и С-пептида. Определение содержания последнего в крови является важным диагностическим тестом оценки секреторной способности (3-клеток. Секреция инсулина является кальцийзависимым процессом. Под влиянием стимула — повышенного уровня глюкозы в крови — мембрана бета-клеток деполяризуется, ионы кальция входят в клетки, что запускает процесс сокращения внутриклеточной микротубулярной системы и перемещение гранул к плазматической мембране с последующим их экзоцитозом. Секреторная функция разных клеток островков взаимосвязана, зависит от эффектов образуемых ими гормонов, в связи с чем островки рассматриваются как своеобразный «мини-орган» (рис. 6.21). Выделяют два вида секреции инсулина: базальную и стимулированную. Базальная секреция инсулина осуществляется постоянно, даже при голодании и уровне глюкозы крови ниже 4 ммоль/л. Стимулированная секреция инсулина представляет собой ответ бета-клеток островков на повышенный уровень D-глюкозы в притекающей к бета-клеткам крови. Под влиянием глюкозы активируется энергетический рецептор бета-клеток, что увеличивает транспорт в клетку ионов кальция, активирует аденилатциклазу и пул (фонд) цАМФ. Через эти посредники глюкоза стимулирует выброс инсулина в кровь из специфических секреторных гранул. Усиливает ответ бета-клеток на действие глюкозы гормон двенадцатиперстной кишки — желудочный ингибиторный пептид (ЖИП). В регуляции секреции инсулина определенную роль играет и вегетативная нервная система. Блуждающий нерв и ацетилхолин стимулируют секрецию инсулина, а симпатические нервы и норадреналин через альфа-адренорецепторы подавляют секрецию инсулина и стимулируют выброс глюкагона. Специфическим ингибитором продукции инсулина является гормон дельта-клеток островков — соматостатин. Этот гормон образуется и в кишечнике, где тормозит всасывание глюкозы и тем самым уменьшает ответную реакцию бета-клеток на глюкозный стимул. Образование в поджелудочной железе и кишечнике пептидов, аналогичных мосговым, например сомато-статина, подтверждает существование в организме единой APUD-системы. Секреция глюкагона стимулируется снижением уровня глюкозы в крови, гормонами желудочно-кишечного тракта (ЖИП гастрин, секретин, холе-цистокинин-панкреозимин) и при уменьшении в крови ионов Са2+. Подавляют секрецию глюкагона инсулин, соматостатин, глюкоза крови и Са2+. В эндокринных клетках кишечника образуется глюкагоноподобный пептид-1, стимулирующий всасывание глюкозы и секрецию инсулина после приема пищи. Клетки желудочно-кишечного тракта, продуцирующие гормоны, являются своеобразными «приборами раннего оповещения» клеток панкреатических островков о поступлении пищевых веществ в организм, требующих для утилизации и распределения участия панкреатических гормонов. Эта функциональная взаимосвязь нашла отражение в термине «гастро-энтеро-панкреатическая система». – Также рекомендуем “Инсулин. Физиологические эффекты инсулина. Схема транспорта глюкозы через клеточные мембраны. Основные эффекты инсулина.” |
Источник
Комикс на конкурс «био/мол/текст»: Сахарный диабет первого типа, также известный как инсулинозависимый диабет, развивается из-за разрушения бета-клеток поджелудочной железы, продуцирующих инсулин — гормон, регулирующий уровень глюкозы в крови человека. В своей статье мы расскажем о том, как недавно открытый лимфоцит, несущий рецепторы как Т-, так и В-клеток, ошибочно подстрекает Т-клетки к атаке на инсулинпродуцирующие клетки.
Давайте познакомимся с героями нашей статьи
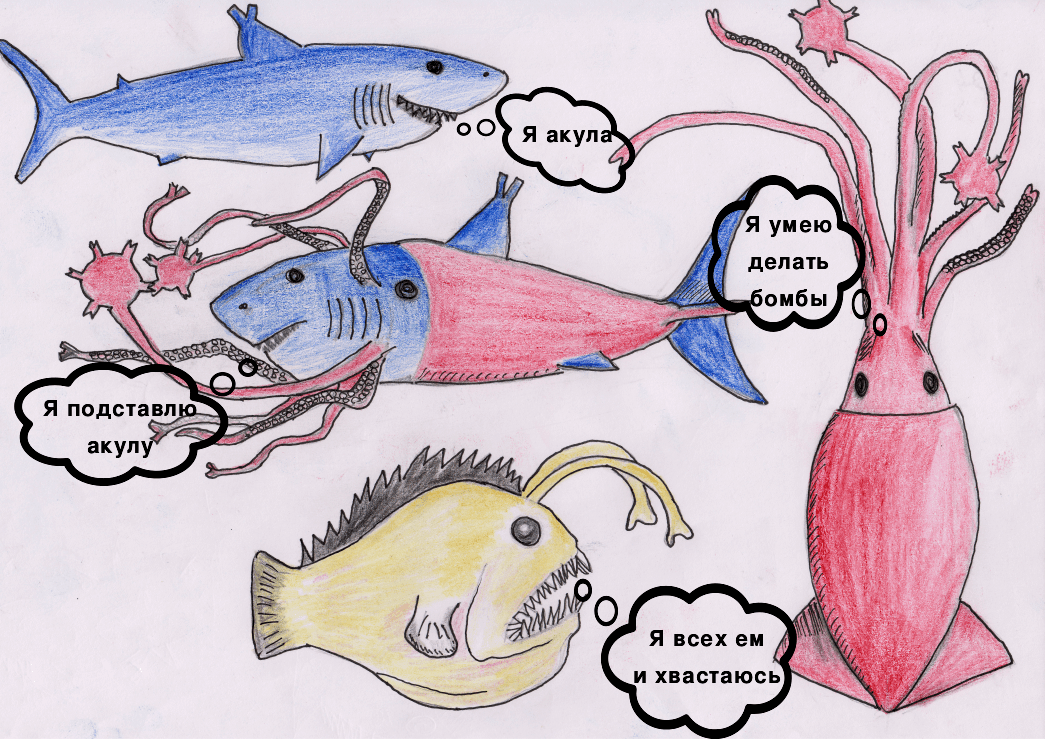
Акула — T-клетка.
Кальмар — В-клетка.
Удильщик — APC (антигенпрезентирующая клетка) с HLA I и HLA II (human leukocyte antigen).
Химера — DE-клетка (dual-receptor-expressing cell, «бирецепторная» клетка) с TCR (T-клеточным рецептором) и BCR (В-клеточным рецептором).
Для того чтобы разобраться, что же делает уникальный «бирецепторный» лимфоцит при диабете I типа (СД1), вкратце расскажем о том, как работает иммунная система.

Перед нами грозный хищник тканей организма — антигенпрезентирующая клетка (APC). Она поглощает фагоцитозом непрошенных гостей — патогенов, например, бактерии.

После переваривания она презентирует на специальном белке HLA II (human leucocyte antigen class II) часть белка патогена — антиген. Помимо HLA II существует HLA I. Об их значении и функциях подробнее рассказано в статье «Иммунитет: борьба с чужими и… своими» [1]. APC заплывает в лимфатический фолликул и привлекает туда наивные T-клетки, которые свободно циркулируют по организму.
В норме главная задача Т-лимфоцита — связывание антигена, который не встречается в организме, но попадает в него в течение патологических процессов. Разнообразие T-лимфоцитов очень велико. Оно обусловлено разнообразием Т-клеточных рецепторов, которое получается за счет рекомбинаций нескольких геномных участков и вставки случайных нуклеотидов в ген TCR [2]. Каждая из клеток немного отличается от остальных за счет гипермутабельности короткого фрагмента N-концевого домена рецептора и способна к узнаванию своего потенциального антигена. А значит, есть вероятность того, что APC встретит ту T-клетку, TCR которой будет связываться с антигеном, презентированным на HLA. Однако это также означает, что TCR может подойти и к пептиду, который есть у своих, нормальных клеток организма. Но нет. Такие Т-клетки обычно погибают в тимусе во время процесса, называемого негативной селекцией.
После связывания HLA II с TCR происходит пролиферация нужных T-клеток и выделение цитокинов, которые помогают им дифференцироваться. Для того чтобы эти T-клетки смогли связаться с HLA II, у них есть белок CD4, который «подтверждает» и стабилизирует связывание.

После дифференцировки CD4+ T-клетки выходят из фолликула и исполняют свою роль командира. Они выделяют цитокины, которые привлекают к месту инфекции другие клетки (базофилы, эозинофилы, тучные клетки и т.д.), и активируют макрофаги.
Тем временем наивные В-клетки (В-лимфоциты) ждут в фолликуле, когда приплывет антиген и они получат возможность принять участие в борьбе с патогеном.

Они действуют посредством поверхностных рецепторных молекул — В-клеточных рецепторов. В-клеточные рецепторы создаются с помощью высоко вариабельных генных перестроек. Наивная В-клетка ждет связывания своего BCR с антигеном. Она поглощает и представляет антиген на своем HLA II, и ждет встречи с CD4+ Т-клеткой, которая уже активировалась на тот же антиген. Прелесть рецепторов B-клеток (BCR) заключается в том, что благодаря случайной перестройке генов производится такое большое разнообразие рецепторов поверхности B-клеток, что практически любой чужеродный антиген, попадающий в организм, распознается ими.
T-лимфоцит помогает В-лимфоциту пролиферировать и начать продуцировать антитела, которые будут способны так же, как и В-клеточные рецепторы связывать антигены. Антитела связываются с антигенами на поверхности бактерий, а другим концом (Fc-концом) связываются с рецепторами на макрофагах (морская звезда на рисунке выше), после чего они фагоцитируют бактерию. Помимо этого, антитела на поверхности бактерий активируют систему комплемента, а также мешают бактерии прикрепляться к клеткам организма.
У 90% больных сахарным диабетом первого типа существует особый вариант HLA II (HLA-DQ8): он лучше связывается с антигеном, который несет относительный отрицательный заряд в определенных положениях (позициях 1 и 9). Инсулин считается аутоантигеном при СД1, то есть именно его распознают в качестве чужеродного агента иммунные клетки пациентов.

Обычно любой белок презентируется не целиком: клетки показывают только его наиболее иммуногенную часть. У инсулина такой частью являются аминокислоты 9–23 на В-цепи (B:9–23). Тем не менее презентация B:9–23 с помощью как нормального, так и мутантного (HLA-DQ8) HLA II для CD4+ T-клеток больных СД1 не приводит к их активации.
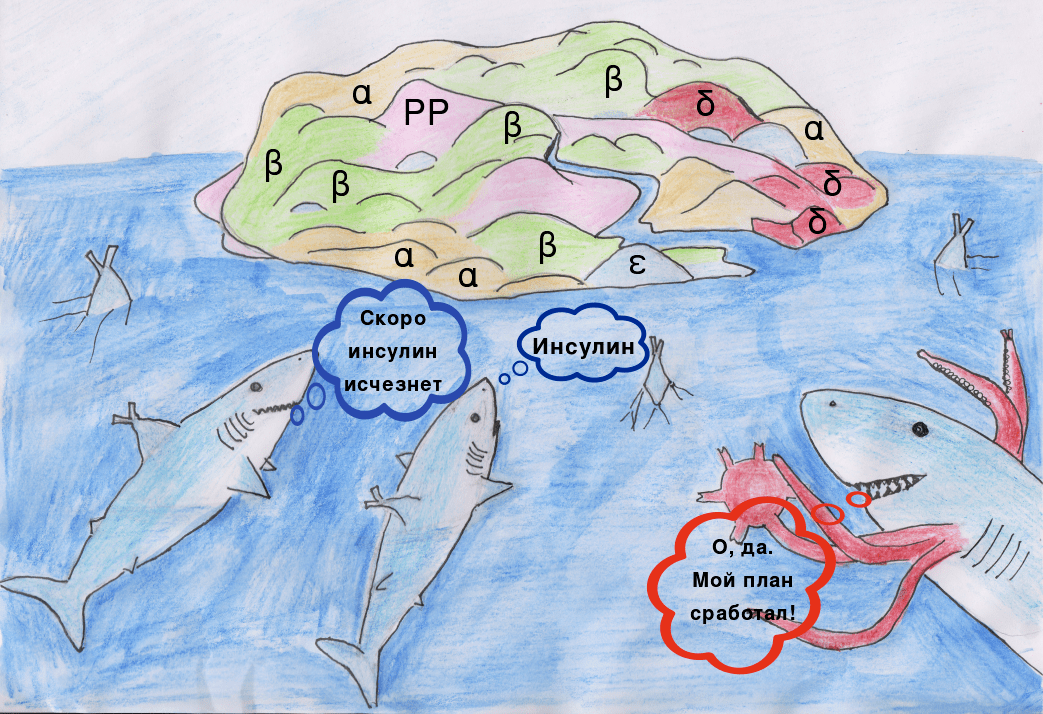
Недавно было открыто, что кровь людей, больных СД1, в сравнении со здоровой выборкой, оказывается обогащенной химерами Т- и В-клеток (Х-клетками) [3]. Антитела этих клеток имеют схожий с инсулином порядок зарядов аминокислотных остатков. Участки антител имеют лучшее сродство с инсулинспецифичными Т-клетками и активируют их, подстрекая развитие аутоиммунного ответа на инсулинпродуцирующие бета-клетки островков Лангерганса.

К сожалению, на данный момент неизвестно, какова природа возникновения химер Т- и В-клеток. Участие Х-клеток в развитии других заболеваний также остается загадкой.
Авторы предлагают проводить скрининг большего числа субъектов из группы риска и использовать данные об обогащении клонов Х-клеток в качестве прогностического признака. Также необходимо провести более качественный анализ RNA-seq, чтобы определить, являются ли Х-клетки отдельным новым типом клеток или присутствуют в организме в качестве субпопуляции одного из уже известных типов клеток.
Число людей, на которых было сделано это открытие, мало, но если результаты подтвердятся, то это станет захватывающим шагом к лучшему пониманию аутоиммунной природы сахарного диабета первого типа. Будет интересно увидеть будущие результаты этих исследователей.
- Иммунитет: борьба с чужими и… своими;
- Антитело: лучший способ распознать чужого;
- Rizwan Ahmed, Zahra Omidian, Adebola Giwa, Benjamin Cornwell, Neha Majety, et. al.. (2019). A Public BCR Present in a Unique Dual-Receptor-Expressing Lymphocyte from Type 1 Diabetes Patients Encodes a Potent T Cell Autoantigen. Cell. 177, 1583-1599.e16;
- Jan Černý, Ilja Stříž. (2019). Adaptive innate immunity or innate adaptive immunity?. Clin. Sci.. 133, 1549-1565;
- Immunopaedia.org;
- Murphy K. and Weaver C. Janeway’s immunobiology (9th Edition). Garland Science, 2016. — 924 p..
Источник