Оксид азота в поджелудочной железе

Окислительный стресс является одним из основных механизмов развития воспаления поджелудочной железы (ПЖ) при хроническом панкреатите (ХП) вне зависимости от этиологии [3, 10]. Окислительный стресс — это состояние, при котором происходит активация свободнорадикальных процессов на фоне депрессии или недостаточности естественных антиоксидантных систем. Поддерживать перекисное окисление липидов (ПОЛ) на определенном физиологическом уровне помогает система антиоксидантной защиты. В физиологических условиях существует определенное равновесие между этими системами. Снижение активности антиоксидантной защиты или ее несостоятельность способствует повышению активности ПОЛ, что в конечном итоге приводит к мембранопатологическим процессам [12, 19]. Целый ряд экспериментальных исследований свидетельствует о связи окислительного стресса с развитием фиброза в ПЖ [1, 6, 7]. Кроме того, при клиническом исследовании у больных ХП выявлен дефицит антиоксидантов и повышение уровня продуктов ПОЛ в ткани ПЖ [4, 9].
При ХП ключевыми медиаторами запуска воспалительной реакции являются цитокины: IL-1 бета, TNF-альфа, IL-8 и др. Интрапанкреатическое повышение концентрации провоспалительных цитокинов и ростовых факторов способствует активизации окислительного стресса [8]. В том числе TNF-альфа повышает фагоцитарную активность моноцитов, нейтрофилов, их дегрануляцию, увеличивает активность циклооксигеназы с последующим внутриклеточным образованием свободных радикалов и оксида азота [16]. В физиологических условиях оксид азота на клеточном уровне принимает участие в стимуляции секреции ациноцитов ПЖ, выступает в роли физиологического регулятора [18, 11]. При воспалении оксид азота стимулирует вазодилятацию, локальное поражение паренхимы этого органа [21]. При остром панкреатите непосредственная деструкция ткани ПЖ осуществляется активными формами кислорода и оксида азота. Однако данные медиаторы можно рассматривать как третичные, так как их продукция находится под контролем провоспалительных цитокинов [15].
В настоящее время роль оксида азота, его взаимосвязь с показателями окислительного стресса при обострении ХП не совсем ясна и требует изучения.
Стандартная терапия ХП направлена на купирование боли, подавление воспаления ткани ПЖ, снижение интрапанкреатического давления, уменьшение и снятие интоксикации, купирование прогрессирования отечно-интерстициальной стадии панкреатита и создание функционального покоя ПЖ [14, 17, 23, 24].
В стандартную терапию ХП не всегда включаются лекарственные средства, восстанавливающие антиоксидантную активность и устраняющие гипоксию в ПЖ.
Целью исследования явилось сопоставление уровня оксида азота с клинико-лабораторными критериями обострения ХП и показателями окислительного стресса при ХП.
Материалы и методы исследования
Обследовано 129 больных (96 (74,4 ± 3,8%) мужчин и 33 (25,58 ± 3,8%) женщин)) в возрасте от 25 до 65 лет (средний возраст 46,99 ± 9,17 года), страдающих ХП. Больные были распределены на группы с неосложненным течением — 36 (27,9 ± 3,9%), с осложненным течением ХП — 93 (72,1 ± 3,9%) больных. Группа с осложненным течением ХП была разделена на подгруппы с различными осложнениями ХП, а также была выделена группа больных, получивших хирургическое лечение по поводу осложнений ХП.
В исследовании достоверно больше (χ2 = 63,5, р < 0,001) больных с длительностью заболевания до 10 лет. При распределении больных по полу отмечено преобладание больных мужского пола (χ2 = 59,6, р = 0,001). Ведущей этиологической причиной заболевания было злоупотребление алкоголем (χ2 = 99,23, р < 0,001). У 72,1% больных ХП протекал с осложнениями.
Для оценки интенсивности болевого синдрома использовалась десятибалльная аналоговая шкала, предложенная Bonica J. J., 1990 г. [2].
Всем больным ХП в крови определялись метаболиты оксида азота по методу Метельской В. А. (2005). Содержание метаболитов оксида азота в крови здоровых людей составляло 32,5 ± 0,51 мкмоль/л [22].
У 60 больных ХП (16 женщин и 44 пациента мужского пола), средний возраст 47,2 ± 8,56 года, проведено исследование общей антиоксидантной активности (ААО), а также уровня малонового диальдегида (МДА), как показателя выраженности ПОЛ.
Определение общей антиоксидантной активности крови проводилось при помощи стандартного набора реактивов «Антиоксидантный статус» фирмы Randox. Среднее значение ААО в крови здоровых людей составляло 1,55 ± 0,13 ммоль/л. Определение МДА исследовалось по методу Андреевой Л. И. (1988). [13]. Среднее значение МДА в крови здоровых людей составляло 10,7 ± 0,8 нмоль/мл.
Результаты исследования и их обсуждение
Болевой синдром является одним из ведущих клинических симптомов обострения ХП. Из 129 обследованных больных обострение ХП у 89 (68,99%) характеризовалось усилением болевого синдрома, у оставшихся 40 (31%), ведущими жалобами были диспепсические расстройства: тошнота, метеоризм, кашицеобразный стул (от 3 до 5 раз в сутки). Интенсивность болевого синдрома, по 10?балльной аналоговой шкале, колебалась от 4,2 ± 0,3 балла у больных с неосложненным панкреатитом, до 7,9 ± 0,2 балла у больных с панкреатической гипертензией, у больных с кальцинозом ПЖ — 8,1 ± 0,3 балла.
Уровни общепринятых лабораторных показателей обострения панкреатита: лейкоцитов, СОЭ, амилазы (соответственно: 7,67 ± 2,28 × 103/мм3, 16,81 ± 5,12 мм/ч, 76,69 ± 14,8 Ед/л) достоверно (р > 0,05) не отличались от нормы. Не выявлено зависимостей между интенсивностью болевого синдрома и уровнями выше отмеченных лабораторных показателей.
В связи с низкой чувствительностью лабораторных, функциональных тестов и инструментальных методов визуализации ПЖ, остается актуальным поиск новых критериев диагностики обострения ХП. Поэтому было проведено исследование оксида азота в крови, как дополнительного критерия обострения ХП.
При сравнении уровня оксида азота у больных ХП со значениями контроля, выявлено его достоверное повышение (t = 9,34, p = 0,001). При анализе уровня оксида азота в зависимости от возраста больных и длительности заболевания достоверных различий не получено. Средние значения оксида азота у мужчин составили 188,57 ± 10,17 мкмоль/л, что достоверно выше (t = 2,2, p = 0,03) средних значений оксида азота среди женщин — 147,45 ± 11,38 мкмоль/л.
Проведено исследование оксида азота в группах с осложненным и неосложненным течением ХП (табл. 1).
.jpg)
Содержание оксида азота в крови при неосложненном ХП было выше значений контроля (р = 0,003) и составило 149,07 ± 15,4 мкмоль/л. При наличии осложнений заболевания содержание метаболитов оксида азота увеличивалось до 211,5 ± 17,7 мкмоль/л, что достоверно выше как показателей контроля (р = 0,004), так и ХП с неосложненным течением (р = 0,042).
Больные осложненным ХП были разделены на группы с различными осложнениями. Была выделена группа больных, перенесших хирургическое лечение по поводу осложнений ХП. В указанных подгруппах при сравнении уровня оксида азота с группой контроля выявлялось достоверное его повышение (р < 0,05). Однако достоверных отличий в содержании оксида азота при различных вариантах осложненного течения ХП не отмечено.
Повышение уровня оксида азота не сопровождалось повышением уровней лейкоцитов и амилазы в крови. Поэтому проведена оценка взаимосвязи уровня оксида азота с клинико-инструментальными критериями обострения: болевым синдромом, увеличением головки ПЖ, расширением главного панкреатического протока (по данным УЗИ), диспепсическими расстройствами.
Выявлено повышение уровня оксида азота до 229,2 ± 16,3 мкмоль/л (р < 0,05) при усилении интенсивности боли до 8 баллов и получена прямая корреляционная зависимость между этими критериями (r = 0,69, р = 0,01) (рис. 1 а, б).
Отмечено повышение уровня оксида азота до 211,3 ± 29,2 мкмоль/л (р < 0,05) при увеличении размеров головки ПЖ более 35 мм, связанном с воспалением (размеры головки ПЖ уменьшались на фоне проведения терапии), и получена прямая корреляционная зависимость между уровнями оксида азота и размерами головки ПЖ (r = 0,59, р = 0,04) (рис. 2 а, б).
Не выявлено зависимостей между значениями оксида азота и шириной ГПП, а также с диспепсическими расстройствами у больных с ХП.
Таким образом, полученные взаимосвязи позволили предложить исследование оксида азота как критерия обострения ХП. За диагностический уровень оксида азота было принято его повышение выше 120 мкмоль/л. Ориентируясь на данные значения оксида азота, была рассчитана его диагностическая значимость. За контрольные критерии диагностики обострения ХП были приняты: усиление болевого синдрома более 5 баллов или увеличение размеров головки ПЖ более 31 мм. Для этого были составлены таблицы сопряженности 2×2 (табл. 2 и 3).
.jpg)
Чувствительность и специфичность повышения оксида азота выше 120 мкмоль/л составили 97% и 57% соответственно, при сравнении с болевым синдромом, и 42% и 62% соответственно, при сравнении с размерами головки ПЖ.
.jpg)
Одним из ведущих патогенетических механизмов, приводящих к воспалению ПЖ, независимо от этиологии, является окислительный стресс. Поэтому изучены показатели ААО и МДА (как конечного продукта ПОЛ) в крови. Средний уровень ААО при обострении ХП составил 1,61 ± 0,13 ммоль/л, что достоверно не отличалось от показателей контроля (1,55 ± 0,13 ммоль/л), при этом среднее значение МДА соответствовало 18,88 ± 1,25 нмоль/мл, что достоверно выше значений контроля (t = 2,58, р = 0,012) и свидетельствует об активизации ПОЛ и накапливании МДА. Получена обратная корреляционная взаимосвязь между показателями ААО и МДА (r = –0,54, p = 0,001). Достоверных различий, при анализе значений МДА у мужчин и женщин, не выявлено (t = 1,2, p = 0,23), но отмечено, что у больных в возрасте от 35 до 44 лет показатели МДА достоверно выше, чем у больных старше 45 лет (t = 2,86, р = 0,01). Также установлено, что значения МДА при длительности заболевания до 5 лет достоверно выше, чем при длительности заболевания более 11 лет (t = 2,44, p = 0,02), что можно объяснить тем, что в первые 5 лет преобладают процессы воспаления над процессами фиброза в ткани ПЖ.
Выявлено повышение МДА до 22,4 ± 2,5 нмоль/мл (р < 0,05) при усилении интенсивности болевого синдрома выше 8 баллов, а также получена прямая корреляционная зависимость между этими критериями (r = 0,30, р = 0,03). Однако зависимостей МДА с диспепсическими расстройствами и инструментальными критериями обострения ХП (увеличением головки ПЖ, шириной главного панкреатического протока) не отмечено.
Исследование зависимости МДА с общепринятыми лабораторными критериями обострения и оксидом азота выявило прямую корреляционную зависимость между уровнем МДА и количеством лейкоцитов (r = 0,55, p = 0,04) и прямую корреляционную зависимость между уровнями МДА и оксида азота (r = 0,63, p = 0,01) (рис. 3 а, б).
У больных ХП с внешнесекреторной недостаточностью ПЖ достаточно редко выявляется лейкоцитоз (даже в период усиления болевого синдрома), а активность амилазы в крови и моче может оставаться в пределах нормальных значений, так как у этих больных подъем активности фермента происходит на фоне исходно низкого уровня, связанного с фиброзом паренхимы ПЖ [20].
Достоверное повышение показателей оксида азота при сравнении с группой контроля, прямые корреляционные зависимости оксида азота с болевым синдромом, увеличением головки ПЖ и МДА (как конечного продукта ПОЛ) указывают на его участие в воспалительной реакции при ХП, и поэтому он может расцениваться как маркер обострения этого заболевания.
Литературные данные свидетельствуют, что важным фактором патогенеза ХП является активизация процессов свободнорадикального окисления липидов, что может быть связано со снижением активности фермента цитохром-С-оксидазы. Образующиеся свободные радикалы кислорода ответственны за развитие воспалительного процесса, с последующим жировым перерождением и замещением фиброзной тканью. Свободные радикалы способны повреждать ДНК клеток ПЖ, вызывая прогрессирование деструктивного процесса [5, 25, 26]. Косвенным маркером ПОЛ является МДА, поэтому его повышение может свидетельствовать об обострении ХП.
Таким образом, определение уровня оксида азота может быть использовано как дополнительный критерий обострения ХП. Повышение оксида азота в крови больных ХП сопряжено с усилением процессов ПОЛ, о чем свидетельствует повышение МДА у больных с высоким уровнем оксида азота в крови. Усиление ПОЛ может являться дополнительным патофизиологическим фактором, приводящим к повреждению ПЖ. МДА и оксид азота также могут быть использованы как показатели эффективности антиоксидантной терапии у больных с ХП.
Литература
- Apte, M. V., Phillips, P. A., Fahmy R. G. et al. Does alcohol directly stimulate pancreatic fibrogenesis? Studies with rat pancreatic stellate cells // Gastroenterology. 2000. Vol. 118, № 4. P. 780–794.
- Bonica J. J. (ed). The management of pain. — Philadelphia: Lea and Febiger, 1990
- Braganza J. M. The pathogenesis of chronic pancreatitis // Q J Med. 1996; 89: 243–250.
- Byung-Moo Yoo, Tae-Young Oh, Young-Bae Kim et al. Novel Antioxidant Ameliorates the Fibrosis and Inflammation of Cerulein-Induced Chronic Pancreatitis in a Mouse Model // Pancreatology. 2005. Vol. 5, № 2–3. P. 165–176.
- De las Heras-CastacoG., Garcha-Unzueta M. T., Domhnguez-Diez A. et al. Pancreatic Fibrosis in Rats and Its Response to Antioxidant Treatment // J. Pancreas. 2005. Vol. 6, № 4. P. 316–324.
- Galli A., Pignalosa P., Grappone C. et al. Enhanced lipid peroxidation-derived aldehydes in chronic pancreatitis suggest a role in the pathogenesis // Ital. J. Gastroenterol. Hepatol. 1998. Vol. 30. Suppl. 2. P. 147.
- Matsumura N., Ochi K., Ichimura M. et al. Study on free radicals and pancreatic fibrosis induced by repeated injections of superoxide dismutase inhibitor // Pancreas. 2001. Vol. 22, № 1. P. 53–57.
- Mews P., Phillips P., Fahmy R. et al. Pancreatic stellate cells respond to inflammatory cytokines: potential role in chronic pancreatitis // Gut. 2002. Vol. 50., № 4. Р. 535–541.
- Morris-Stiff G. J., Bowrey D. J., Oleesky D. et al. The antioxidant profiles of patients with recurrent acute and chronic pancreatitis // Am. J. Gastroenterol. 1999. Vol. 94. P. 2135–2140.
- Rose P., Fraine E., Hunt L. P. et al. Dietary antioxidants and chronic pancreatitis // Hun. Nutr. Clin. Nutr. 1986. Vol. 40. P. 151–164.
- Werner J., Fernandez-del-Castillo C., Rivera J. A. et al. On the protective mechanisms of nitric oxide in acute pancreatitis // Gut. 1998. Vol. 4–3 (3). P. 401–407.
- Алексеева Н. В., Юрьева Э. А., Махачев Б. М. и др. Современные способы оценки процессов пероксидации в организме при заболеваниях у детей: пособие для врачей. М., 2000. С. 3–46.
- Андреева Л. И., Кожемякин Л. А., Кишкун А. А. Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой // Лабораторное дело. 1988. № 11, с. 41–43.
- Боженков Ю. Г., Щербюк А. Н., Шалин С. А. Практическая панкреатология. М.: Медицинская книга. 2003. С. 94–95.
- Буеверов А. О. Медиаторы воспаления и поражения поджелудочной железы // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 1999, № 4, с 15–18.
- Живаева Н. С., Царегородцева Т. М., Винокурова Л. В., Нилова Т. В. Изменение цитокинов и острофазных белков при хроническом панкреатите алкогольной этиологии // Эксперимент. и клин. гастроэнтерология. 2003, № 6 c. 54–57.
- Ивашкин В. Т., Минасян Г. А. Лечение хронического панкреатита // Рос. жур. гастроэнтерол., гепатол., колопроктол. 1996. № 4. С. 0–17.
- Коротько Г. Ф. Секреция поджелудочной железы. М.: «Триада-Х», 2002. 224 с.
- Ланкин В. З. Свободнорадикальное окисление в норме и патологии. М., 1976. С. 108–110.
- Маев И. В., Кучерявый Ю. А. Болезни поджелудочной железы. М.: Издательская группа «ГЭОТАР-Медиа», 2009, с. 105, 136.
- Маев И. И., Казюлин А. Н., Кучерявый Ю. А. Хронический панкреатит. М.: ОАО «Издательство «Медицина», 2005. 504 с.
- Метельская В. А., Гуманова Н. Г. Оксид азота: роль в регуляции биологических функций, методы определения в крови человека // Лаб. Медицина. 2005, № 7, 19–24.
- Минушкин О. Н. Хронический панкреатит: некоторые аспекты патогенеза, диагностики и лечения // Consilium medicum. Приложение. 2002. Выпуск № 1. С. 23–26.
- Охлобыстин А. В. Заболевания поджелудочной железы // Consilium medicum. Диспепсия. Приложение. 2002. С. 26–31.
- Циммерман Я. С. Хронический панкреатит // Вестник клуба панкреатологов. 2009, февраль, № 1 (2), с. 38–47.
- Яковенко Э. П., Яковенко А. В. Хронический панкреатит: клиника и диагностика // Практикующий врач. 1998. № 13, (2). С. 36–37.
Л. В. Винокурова, доктор медицинских наук
О. И. Березина
В. Н. Дроздов, доктор медицинских наук
А. В. Петраков
Т. В. Нилова
ЦНИИ гастроэнтерологии, Москва
Контактная информация об авторах для переписки: vinokurova52@mail.ru
Купить номер с этой статьей в pdf
Источник
Передовые ученые всего мира все чаще и громче заявляют, что эффективность лекарств в борьбе с болезнями падает, они попросту перестают работать. Болезнь, уничтоженная лекарствами, просто так не уходит. Она либо возвращается, либо проявляется в другом месте, поражая здоровый орган.
Лечить болезни лекарствами, бороться с инфекцией антибиотиками – устаревшая малоэффективная философия прошлого века. Мысль должна быть направлена не на то, чтобы найти и уничтожить причину в виде вредных микроорганизмов, вирусов и т.д.
Современная философия здоровья другая. Не надо дожидаться того дня, когда уже проявятся симптомы болезни. Как правило, серьезная патология развивается в организме в течение нескольких лет. Но любой недуг можно остановить и даже повернуть назад. Мысль должна быть направлена на то, чтобы укрепить свой организм, восстановить естественную микрофлору кишечника, улучшить иммунитет, дать организму ресурсы. И тогда организм сам справится с любой болезнью.
Очень важно, что во всех процессах саморегулирования и самовосстановления организма человека присутствует газ, – оксид азота – роль которого в физиологии человека была изучена только в конце прошлого века.
История открытия влияния оксида азота на организм человека.
Открытие влияния окиси азота на организм человека произвело настоящую революцию в медицине. Большинство исследователей считают сейчас, что оксид азота – это новая «путеводная звезда» в фармакологии, указывающая направление поиска лекарственных средств против множества болезней.
Давайте начнем с небольшого экскурса в историю.10 декабря 1998 года трое американскихученых – Роберт Фарчготт, Луис Ингарро и ФеридМюрад (RobertF.Furchgott, LouisJ. Ingarro, FeridMurad) получили Нобелевскую премию в области физиологии и медицины за открытия, касающиеся исследования роли оксида азота как сигнальной молекулы в кардио-васкулярной (сердечно-сосудистой) системе.
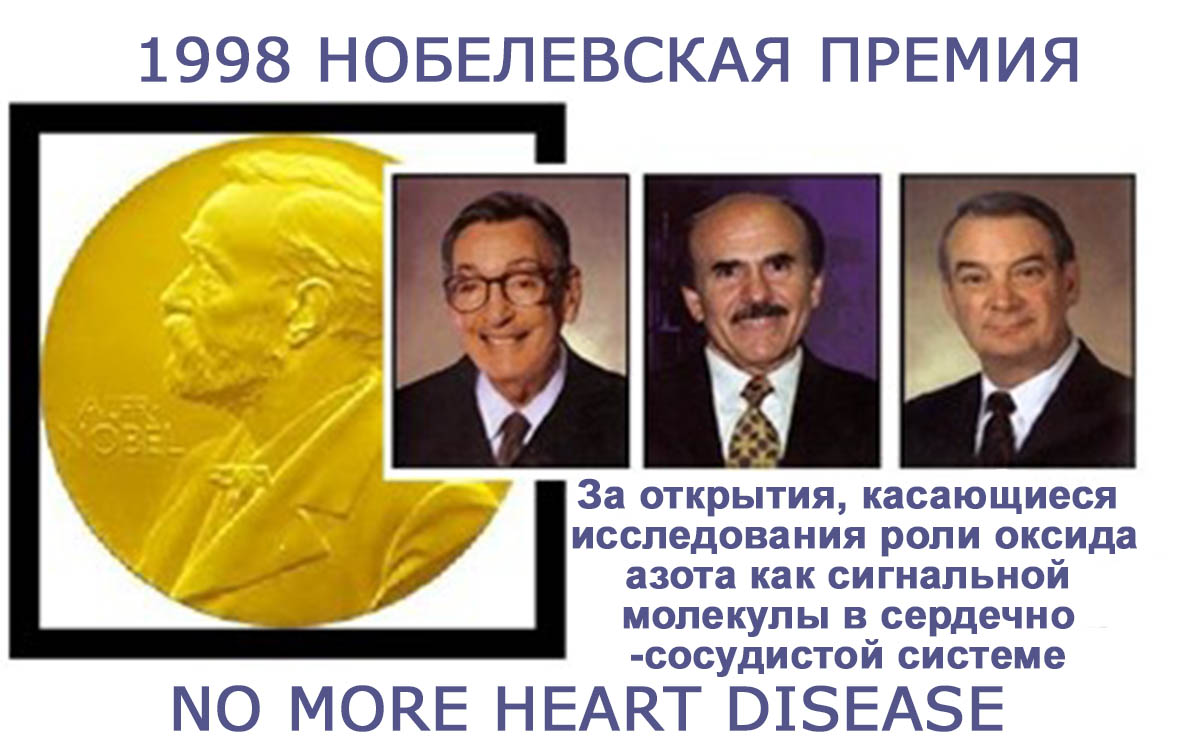
«No more heart disease!» — «Больше никаких сердечных заболеваний» – под этим девизом была вручена Нобелевская премия американским ученым. Эти ученые впервые доказали, что газ оксид азота может действовать как сигнал молекулы в организме человека.
Бесцветный газ — окись азота –до середины прошлого века считался вредным для здоровья человека. Оксид азота всегда рассматривали исключительно с точки зрения вредности для всего живого, поскольку он является сильнейшим промышленным загрязнителем. Инженеры, разрабатывая двигатели внутреннего сгорания, всегда старались понизить загрязнение атмосферы окисью азота. Для этого всегда приходилось конструировать системы регенерации окиси азота в другие вещества.
Но в конце ушедшего века ученые-фармакологи неожиданно выяснили, что окись азота существует в любом живом организме в довольно большом количестве. И не просто существует, а регулирует важнейшие физиологические процессы. Был найден метод, который способен укрепить как всю сердечно-сосудистую систему, так и весь организм в целом.
Роль окиси азота в управлении процессами в теле.
Было обнаружено, что окись азота является сигнальной молекулой, в первую очередь для сердечно-сосудистой системы, а также для ряда других функций, например, как сигнальная молекула в нервной системе. То есть окись азота управляет как внутриклеточными, так и межклеточными процессами в живой клетке.
Оксид азота регулирует работу сердца, мозга, желудка, печени, половых органов, почек и многих других внутренних органов и функциональных систем организма. Молекулы окиси азота расширяют кровеносные сосуды во всех органах, уменьшая в них давление и улучшая кровоток. Каждый орган способен самоисцелиться через улучшение кровотока практически от любой патологии. Потому что именно кровоток доставляет питательные вещества к органам.
Без достаточного количества оксида азота в организме невозможна адаптация человека к различным факторам окружающей среды, невозможно обеспечить нормальное состояние здоровья человека.
Как действует окись азота на сердечно-сосудистую систему.
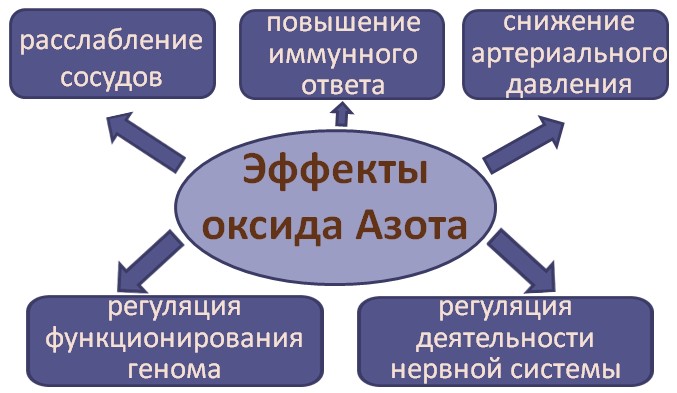
Оксид азота (химическая формула NO) образуется из нитратов, т.е. из веществ, содержащих атом азота. Открытие NO привело к пониманию благотворного и быстрого действия нитроглицерина, который в своей химической формуле также содержит азот. При расщеплении препарата образуется NO, приводящий к расширению сосудов сердца и снимающий в результате этого чувство боли.
Внутренний слой кровеносных сосудов покрыт эндотелием. Эндотелий – это железа внутренней секреции — вырабатывает фактор, который вызывает расширение и расслабление сосудов. Это называется «эндотелий релаксирующий фактор», он и есть окись азота NO.
Под действием потока крови, под действием гормонов в эндотелии вырабатываются оксид азота, который дает расслабление гладкой мускулатуры сосудов. Одновременно вырабатывается другое вещество — эндотелин, который вызывает сокращение сосудов. То есть возникают два противоположных процесса, которые оба нужны организму.
В здоровом организме доминирует оксид азота. Это вызывает расслабление, и мышцы сосудов находятся в спокойном, расслабленном состоянии.
При какой-либо патологии сосудов, например, при заболевании атеросклерозом или диабетом, при ожирении, гипертонии, при нарушении эндотелия от курения, воздействия вредных веществ и т.д. возникает дефицит оксида азота. Начинает доминировать эндотелин, что вызывает сокращение сосудов. Как результат, повышается давление, и возникает так называемый порочный круг гипертонии.
Под действием повреждающих факторов разрушается внутренний слой сосудов эндотелий. Как следствие, сосуды не могут выработать оксид азота и поэтому сужаются, повышается давление. Когда кровь движется по сосудам под повышенным давлением, она еще больше повреждает эндотелий. Сосуды еще больше сужаются.
Гипертония со временем не вылечивается, и врачам приходится все время назначать лекарства для снижения давления. Почему? До потому что никто не заботится о том, чтобы давать организму ресурс, чтобы защищать внутренний слой сосудов от разрушений, чтобы восстанавливать поврежденный эндотелий.
Как в организме образуется оксид азота?
NO образуется в нашем теле из аминокислоты аргинин под действием энзима NOS (этот фермент называется эндотелиальная синтаза окиси азота). Из аргинина появляется цитруллин, а из цитруллина через два цикла снова появляется аргинин. Поэтому важно, чтобы этот цикл не прерывался. Для этого надо снабжать организм аргинином, цитруллином и полифенолами.
Новый препарат «Муноген», стимулирующий организм к выработке окиси азота.

Исходя из этих знаний, немецкая компания PM-international совместно с Люксембургским институтом науки и технологии создали замечательный препарат «Муноген», который нужно использовать практически каждому человеку. Это очень эффективный препарат, который хоть и не является лекарством, но по механизму действия сопоставим с самыми сильными фармакологическими средствами от сердечных и сосудистых болезней.
В его состав входят активные ингредиенты: экстракты винограда и яблока, L-аргинин, L-цитруллин, амарант печальный Amaranthus hypochondriacus (хлеб инков), витамины B12, B6, фолиевая кислота. Экстракты яблок и винограда необходимы потому, что их полифенолы обеспечивают выработку и последующую работу фермента эндотелиальной синтазы NOS. Амарант печальный улучшает снабжение организма кислородом, является мощным антиоксидантом, участвует в защите эндотелия. Витамины группы B – это защита сосудов от внутренних повреждений.
Самое важное, что препарат «Муноген» содержит все необходимые ингредиенты для того, чтобы эндотелий сосудов вырабатывал достаточное количество оксида азота. Другими словами, «Муноген» состоит из пищи для здоровых сосудов.
Организму не нужно давать то, что он сам вырабатывает. Например, когда человек активно употребляет инсулин, поджелудочная железа начинает «лениться». Со временем перестает вырабатываться свой инсулин, и поджелудочная железа вообще перестает функционировать. Поэтому сосудам не надо давать оксид азота NO, сосудам надо давать продукты-предшественники, из которых организм самостоятельно получит NO.
Люди старше 40 лет, а также спортсмены должны уделять самое пристальное внимание оптимальному снабжению организма питательными веществами, которые влияют на выработку организмом окиси азота NO.
Люди, принимающие «Муноген» в течение 3-х и более месяцев, отмечают стабилизацию артериального давления на уровне 120/70 – 120/80, полное исчезновение тромбов на венах, укрепление иммунитета, повышение мужской половой функции, повышение физической выносливости.
P.S. Печальная статистика такова: большинство людей умирают от сердечно-сосудистых проблем. Вы можете навсегда обезопасить себя и своих близких от всех сердечных и сосудистых недугов, просто добавив «Муноген» к своему рациону питания.
Купить Муноген на сайте производителя
Хотите узнать, как купить со скидкой, свяжитесь с нами : КОНТАКТЫ
Желаем Вам, чтобы у Вас всегда было здоровое сердце!
Источник
