Метаболический синдром и поджелудочная железа
Нарушения углеводного обмена, дислипидемия — частые спутники хронического панкреатита, они же почти всегда в той или иной мере сопровождают неалкогольный стеатоз печени, а вместе перечисленные нарушения характеризуют метаболический синдром. Проблемы, касающиеся изучения патогенеза метаболического синдрома, его компонентов, в последнее десятилетие активно дискутируются в литературе, однако, аспекты его влияния на заболевания желудочно-кишечного тракта почти не обсуждались. В работе представлены данные, отражающие сочетанное течение хронического панкреатита и метаболического синдрома, а также патологии печени, возникающей в таком случае.
В последние годы наблюдается неуклонный рост хронического панкреатита (ХП). Это заболевание представляет собой серьезную медико-социальную проблему, являясь предраковым состоянием и ложем сахарного диабета (СД). Несмотря на большое количество исследований, до сих пор вопросы диагностики, патогенеза и лечения этого страдания до конца не решены. При ХП поражается внешнесекреторная часть поджелудочной железы, что неизменно связано с вовлечением внутрисекреторной отдела, возникновением инсулинорезистентности (ИР) и сахарного диабета, которые являются неизменными спутниками метаболического синдрома (МС).
В настоящее время большое внимание уделяется адипокинам – гормонам (в частности, лептину), которые непосредственно участвуют в патогенезе ожирения и метаболическом синдроме. Адипокины затрагивают самые разные аспекты метоболизма, инициируют апоптические процессы гибели жировых клеток, центрально активируя симпатическое звено вегетативной нервной системы. Являясь адипокином, лептин участвует в поддержании равновесия между липолизом и липогенезом, косвенно влияет на инсулинорезистентность. Все эти процессы участвуют в патогенезе ХП. Нарушение углеводного обмена, инсулинорезистентность, а также тучность составляют основу так называемого «смертельного квартета» и образуют при кооперации с гипертензией и дислипидемией, упомянутый выше, метаболический синдром. Таким образом, прослеживается четкая патогенетическая связь хронического панкреатита с метаболическим синдромом. При ожирении 2-3 степени в 95% выявляются НАЖБП, а стеатогепатит в 20-47% (Jounossi Z., 1999), в формировании которого обуславливает инсулинорезистентность. Метаболический синдром вообще является основой полиморбидности в гастроэнтерологии (Егорова Е.Г., Звенигородская Л.А., Лазебник Л.Б., 2005).
ХП при длительном течении часто осложняется нарушением углеводного обмена, а в дальнейшем и сахарным диабетом и может сочетаться с метаболическим синдромом. Тем не менее, такое сочетание встречается довольно часто и создаёт большие трудности для врачей, при этом возникает новый симптомокомплекс, который изменяет клиническую картину заболевания и представляет большие трудности в диагностике, комплексном лечении этой сочетанной патологии.
Различные биохимические показатели крови, отражающие деятельность органов ЖКТ, изучались во многих работах, однако исследований, касающихся сочетания ХП с метаболическим синдромом и состояния печени при этой патологии, что может считаться патогенетически обоснованным и весьма вероятным, и как данное сочетание будет проявлять себя при ХП, т. е. сочетание ХП, метаболическиого синдрома и стеатоза печени не проводилось.
В доступной литературе мы не встретили работ по вопросу- насколько ХП, который течет совместно с MС, влияет на состояние печени, а также участие в этом процессе лептина, хотя это важно в аспекте ранней диагностики и требует дифференциального подхода к лечению в зависимости от степени ее поражения.
Цель работы: исследовать клинико-функциональное состояние печени при ХП, ассоциированном с метаболическим синдромом, что даст возможность расставить акценты по патогенезу и по новому подойти к лечению этого сложного страдания.
Под нашим наблюдением находились 96 больных:
1 группа — больные с хроническим панкреатитом — 48 человек,
2 группа — пациенты с ХП, ассоциированном с метаболическим синдромом — 48 человек. Группы не отличались по полу и возрасту.
Для диагностики метаболического синдрома использовались критерии, предложеные International Diabetes Federation (IDF) в апреле 2005 г. Согласно этим критериям, обязательным для метаболического синдрома является центральное (абдоминальное) ожирение (окружность талии более 94 см для мужчин и более 80 см для женщин – у европеоидной расы) в сочетании как минимум с двумя из следующих 4 факторов:
- повышение триглицеридов (ТГ) более 1,7 ммоль/л или специфическое лечение дислипидемии;
- снижение липопротеидов высокой плотности менее 1,03 ммоль/л у мужчин и менее 1,29 ммоль/л у женщин или специфическое лечение;
- повышение АД: систолического более 130 мм рт. ст. или диастолического более 85 мм рт. ст. или антигипертензивная терапия;
- повышение глюкозы венозной плазмы натощак более 5,6 ммоль/л или ранее выявленный сахарный диабет 2 типа (СД2) (при гликемии натощак более 5,6 ммоль/л настоятельно рекомендуется проведение орального глюкозотолерантного теста, но это не является непременным).
При проведении статистической обработки рассчитывали Медиану (М), интерквартильный размах (25-й и 75-й процентили), для выявления статистических различий между группами по выраженности количественных признаков применялись непараметрические методы – критерий Манна-Уитни, двусторонний вариант, при анализе распределения качественных признаков использовали точный критерий Фишера, различия признавали статистически значимыми при р<0,05 соответствии с рекомендациями Ребровой О.Ю. (2002), также применялся коэффициент ранговой корреляции Спирмена.
Жировой гепатоз и стеатогепатит являются диагнозами исключения. Поэтому в нашем исследовании всем больным стандартно определялся HBs Ag, антитела к HCV, при необходимости ПЦР, которые были отрицательны. Кроме того, мы не включали в исследование больных, у которых можно заподозрить злоупотребление алкоголем при тщательном сборе анамнеза. Количество алкоголя, способное вызывать развитие патологии печени до сих пор является предметом дискуссии, большинство авторов сходится на цифре в 40 г этанола в неделю, однако большое исследование «Дионис», проведенное в Италии (1997) показало, что риск развития алкогольной болезни печени возрастает при употреблении более 30 г этанола в день.
При анализе показателей функциональных печеночных тестов выявлены статистически значимые различия между 1 и 2 группами по уровню АЛТ (р=0,021), АЛТ был выше у больных с метаболическим синдромом, различия по другим маркерам функции печени не достигали статистической значимости.
Повышение уровня щелочной фосфатазы и гамма-глютамилтрансферазы (ГГТ) – традиционно считается маркером холестаза, однако последний не характерен для НАСГ и ХП, что и подтверждает наше исследование, различий по данным параметрам в группах не обнаружено, хотя при ХП щелочная фосфатаза была все же выше. Для ГГТ в таблице специально приведены как значения медианы (19 Ед/л) так и среднего арифметического (50,07 Ед/л), дабы показать неоднозначность статистической обработки данных в зависимости от выбранного статистического критерия.
По данным канадских ученых (доктор Douglas Lee Университет Торонто, Онтарио) высокий сывороточный уровень ГГТ может предсказывает развитие метаболического синдрома. Данный вывод сделан по результатам анализа факторов сердечно-сосудистого риска у 3451 участника Фрамингемского исследования. У больных с максимальными значениями ГГТ был максимален риск развития метаболического синдрома (увеличение риска на 134-76%, при сравнении четвертой и первой квартилей). Потенциально, ГГТ может влиять на редокс-статус протеинтиолов на поверхности клеток, что приводит к росту продукции активных форм кислорода, как предполагают канадские исследователи. Однако в нашем исследовании уровень ГГТ не зависел от наличия метаболического синдрома, и в группах статистически значимо не отличался.
Таблица 1. Исследование уровня АЛТ, АСТ, общего билирубина и щелочной фосфатазы в крови
| Изучаемый признак | 1 группа ХП, n =48 | 2 группа ХП+МС, n=48 | р= |
| АЛТ Ед/л | 0,021 | ||
| Mean | 27,50 | 36,36 | |
| медиана | 18,0 | 26,0 | |
| 25 процентиль | 13,0 | 19,0 | |
| 75 процентиль | 29,0 | 52,0 | |
| АСТ Ед/л | 0,068 | ||
| Mean | 23,38 | 27,73 | |
| медиана | 19,0 | 24,0 | |
| 25 процентиль | 17,0 | 16,0 | |
| 75 процентиль | 43,0 | ||
| Щелочная фосфатаза (45-132) ед/л | 0,405 | ||
| Mean | 120,7 | 102,86 | |
| медиана | 114,5 | 100 | |
| 25 процентиль | 80,00 | 83,00 | |
| 75 процентиль | 150,0 | 118,0 | |
| Гамма-глютамилтрансфераза Ед/л (до 50) | 0,147 | ||
| Mean | 50,07 | 48,11 | |
| медиана | 19,0 | 40 | |
| 25 процентиль | 11,8 | 19 | |
| 75 процентиль | 59,0 | 65 | |
| Общий билирубин мкмоль/л (5-21) | 0,41 | ||
| Mean | 19,13 | 15,5 | |
| медиана | 13 | 13,0 | |
| 25 процентиль | 9,5 | 12 | |
| 75 процентиль | 16,5 | 15,0 |
Даже при отсутствии у пациента клинической симптоматики и отклонений функциональных печеночных тестов и наличие факторов риска развития НАСГ (ожирение, сахарный диабет, гиперлипидемия и метаболический синдром), УЗИ может служить ведущим методом, необходимым для распознавания стеатоза печени без гистологического исследования. Некоторое сходство сонографической картины цирроза и жирового гепатоза — так называемая «белая» печень — послужило целому ряду исследований в данной области.
Критериями жирового гепатоза при УЗИ могут считаться увеличение размеров органа, повышение эхогенности, а также зернистая структура и обедненный сосудистый рисунок.
Группы сильно отличались по сонографической картине печени, так при сочетании «хронический панкреатит»+ «метаболический синдром» преобладали повышенная эхогенность у 39 (81,25%) больных и зернистая и мелкозернистая эхоструктура – 20 (41,67%) и обедненный сосудистый рисунок — 29 (60,42%), в общем здоровой печенью они похвастаться не могли, в отличие от 1 группы, в которой преобладали нормальная эхогенность – 27 (56,25%) пациентов и сохраненный сосудистый рисунок у 39 (81,25%) пациентов. В данном случае важно отметить тенденцию к своеобразной патологии печени, если метаболический синдром ассоциирован с ХП.
В целом врачи, проводившие УЗ исследование, в группе ХП с метаболическим синдромом дали заключение о наличие признаков жирового гепатоза 20 (41,67%) пациентам, а в группе изолированного ХП только 9 (18,75%) больным, отличие статистически значимое р=0,03. Размеры печени косвенно указывающие на жировую инфильтрацию, также статистически значимо разнились в группах. Размеры левой доли печени в присутствие метаболического синдрома были больше — 68 мм (от 57 до 74 мм) против 58,5 мм (от 47 до 66,5 мм) в 1 группе, р=0,012.
Таблица 2. Состояние печени по данным ультразвукового сканирования.
| Изучаемый признак | 1 группа ХП, n =42 | 2 группа ХП+МС, n =40 | р= | ||
| n | % | n | % | ||
| Эхогенность | |||||
| Снижение эхогенности | 2 | 4,17 | 0,39 | ||
| Повышение эхогенности | 15 | 31,25 | 39 | 81,25 | 0,0001 |
| Смешанная эхогенность | 4 | 8,33 | 0,13 | ||
| Нормальная эхогенность | 27 | 56,25 | 9 | 18,75 | 0,009 |
| Эхоструктура | |||||
| Обычная эхоструктура | 18 | 37,50 | 8 | 16,67 | 0,036 |
| Диффузно-неоднородная эхоструктура | 21 | 43,75 | 20 | 41,67 | 0,85 |
| Зернистая и мелкозернистая эхоструктура | 9 | 18,75 | 20 | 41,67 | 0,03 |
| Сосудистый рисунок | |||||
| Сохранен | 39 | 81,25 | 19 | 39,85 | 0,0003 |
| Обеднен | 9 | 18,75 | 29 | 60,42 | 0,0003 |
| УЗ признаки жирового гепатоза | 9 | 18,75 | 20 | 41,67 | 0,03 |
Таблица 3. Размеры печени по данным ультразвукового сканирования
| Изучаемый признак Размеры печени | 1 группа ХП, n = | 2 группа ХП+МС, n= | р= |
| Правая доля, мм, медиана | 142,5 | 152 | 0,45 |
| 25 процентиль | 129 | 143 | |
| 75 процентиль | 163,5 | 156 |
| Левая доля, мм, медиана | 58,5 | 68 | 0,012 |
| 25 процентиль | 47,0 | 57 | |
| 75 процентиль | 66,5 | 74 |
При выполнении корреляционного анализа размеров печени и других маркеров в обеих группах выявилось, что на величину (именно на размеры, а не функциональную способность) этого весьма важного органа потенциально могли влиять в 1 группе на размер правой доли положительно: глюкоза крови, ГГТ (r=0,616 р=0,006), СОЭ (r=0,65, р= 0,0037), ИМТ (r=-0,64 р=0,0007) и отрицательно общий холестерин (r=-0,61, р=0,012), ОТ (r=-0,58, р=0,003) .
При ХП с МС профиль был несколько другой, для правой доли увеличению размеров по УЗИ потенциально способствовал общий холестерин сыворотки крови r=0,56, p=0,038, билирубин r=0,64, p=0,026, а вот процентное содержание жира в организме повлекло снижение размера левой доли печени r=-0,8, p=0,005. Все эти показатели мы можем рассматривать как потенциальные факторы поражения печени при ХП, при котором имеет место быть метаболический синдром.
Анализируя УЗИ картину, печени нам захотелось оценить, влияет ли присутствие повышенной массы тела на наличие характерной патологии печени. Для выявления такой зависимости в обеих группах были отобраны пациенты с ИМТ больше 31 кг/м2. Возможно, ожирение явилось главным патогенетическим фактором, обеспечивающим жировой гепатоз при метаболическом синдроме?
Таблица 4. Состояние печени по данным ультразвукового сканирования у больных с ИМТ 31,0 кг/м2 и больше
| Изучаемый признак | 1 группа ХП, n =9 | 2 группа ХП+МС, n =32 | р= | ||
| ИМТ 31 и больше | 9 | % | 32 | % | |
| Эхогенность | |||||
| Снижение эхогенности | |||||
| Повышение эхогенности | 6 | 66,67 | 32 | 100 | 0,003 |
| Смешанная эхогенность | 3 | 33,33 | 0,003 | ||
| Нормальная эхогенность | |||||
| Эхоструктура | |||||
| Обычная эхоструктура | |||||
| Диффузно-неоднородная эхоструктура | 3 | 33,33 | 24 | 75 | 0,024 |
| Зернистая и мелкозернистая эхоструктура | 6 | 66,67 | 8 | 25 | 0,024 |
| Сосудистый рисунок | |||||
| Сохранен | 6 | 66,67 | 16 | 50 | 0,37 |
| Обеднен | 3 | 33,33 | 16 | 50 | 0,37 |
Среди больных с различной степенью ожирения во второй группе метаболический синдром с более высокой периодичностью показывал повышение эхогенности паренхимы печени – у 32 (100%) больных, в 1 группе только у 6 (66,67%), р=0,003, также как её диффузно-неоднородная эхоструктуру у 24 (75%) во второй, против 3 (33,33%) пациентов в первой, р=0,024. Выявление обедненного сосудистого рисунка имело такую же тенденцию – у 16 (50%) больных при МС, против 3 (33,33%), р=0,37, это позволяет сделать осторожный вывод, что именно метаболический синдром как целый комплекс патологических изменений, а не только тучность, обуславливают более частую патологию печени во второй группе.
Впервые у больных ХП с метаболическим синдромом по данным сонографии печени статистически значимо чаще выявлена повышенная эхогенность у 39 (81,25%) больных и зернистая и мелкозернистая эхоструктура – 20 (41,67%) и обедненный сосудистый рисунок — 29 (60,42%), что позволило сделать заключение о наличие признаков жирового гепатоза в группе ХП с МС по данным УЗ диагностики статистически значимо чаще, то есть у 20 (41,67%) больных, чем в группе ХП — 9 (18,75%) больным. У больных ХП с МС (2 группы) также зафиксирован более высокий уровень АЛТ (р=0,021), различия по другим маркерам функции печени не достигали статистической значимости. Учитывая все выше перечисленное, можно заключить, что для больных ХП с метаболическим синдромом, в сравнении с изолированным ХП, более характерно поражение печени по типу жирового гепатоза или НАЖБП, что приводит к развитию качественно нового симптомакомплекса, который требует новых подходов к ранней диагностике и лечению панкреатобилиарного комплекса с учетом уровня лептина.
*Термин «неалкогольный стеатогепатит» (НАСГ) впервые применили Ludwig и соавт. в 1980 г., описывая клинические особенности заболевания печени неалкогольной этиологии, при котором были выявлены ключевые патоморфологические признаки, присущие алкогольной болезни печени. Первоначальное описание этого состояния и сегодня остается весьма уместным. Неалкогольное, но сходное с алкогольным поражение печени проходит ряд стадий — от простого стеатоза до стеатогепатита, фиброза и исхода в цирроз. Учитывая возможность прогрессирования НАСГ до стадии декомпенсированного цирроза печени, стеатогепатит можно рассматривать в качестве вероятной причины нарушения функции печени неясной этиологии.
**Список факторов, способных участвовать в развитии метаболического синдрома и состояний, ассоциированных с ним, до конца не уточнен и постоянно пополняется. В исследовании NHANES на риск возникновения метаболического синдрома, оказывал влияние социально экономический статус. У женщин 25-45 лет и 46-65 лет с доходом ниже прожиточного уровня риск был выше в 4.90 и 2.54 раза, соответственно, чем у более состоятельных. У женщин с образованием продолжительностью до 12 лет риск МС повышался в 2.77 и 2.50 раза, по сравнению с более образованными женщинами соответствующих возрастных групп (Loucks E., 2007).
Статья написана в соавторстве с Новоселей Н.В., Кокуевой О.В., Карчиным О.В., Средой С.А.
Использована работа Егоровой Е.Г., Звенигородской Л.А., Лазебника Л.Б. «Метаболический синдром с позиции гастроэнтеролога» // РМЖ. – 2005. – Том 13, № 26. – С. 1706-1712.
Источник
Пусковым механизмом прогрессирования заболеваний поджелудочной железы (ПЖ) при метаболическом синдроме служит воспаление, тесно сопряженное с жировой инфильтрацией ПЖ на фоне ее ожирения.

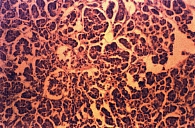
Рис. 1. Роль поджелудочной железы в патогенезе метаболического синдрома
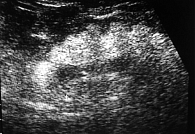
Рис. 2. Ультразвуковая диагностика стеатоза поджелудочной железы
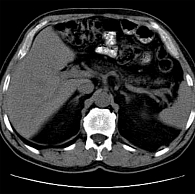
Рис. 3. Компьютерная томография: изменения поджелудочной железы во всех ее отделах
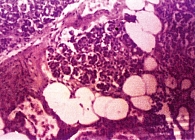
Рис. 4. Жировая инфильтрация. Дистрофия и некроз ацинусов (окраска гематоксилином и эозином, 20-кратное увеличение)

Рис. 5. Отек стромы на фоне жировой инфильтрации (окраска гематоксилином и эозином, 20-кратное увеличение)
Изменения ПЖ, характерные для метаболического синдрома, не только вторичны на его фоне, но и способствуют прогрессированию данного синдрома и развитию осложнений, замыкая патогенетический круг.
История изучения изменений ПЖ при ожирении насчитывает около 100 лет. В 1930-х гг. J.H. Schaefer и R.F. Ogilvie показали, что у тучных людей масса ПЖ больше, чем у людей с нормальной массой тела [1, 2]. С появлением лучевых методов исследования была установлена высокая корреляция между стеатозом ПЖ, избыточным весом и сахарным диабетом (СД) 2-го типа [3].
В ходе современных экспериментов на мышах и крысах, получавших специальную диету, богатую жирами, продемонстрирована достоверная связь между режимом питания и стеатозом ПЖ с последующим развитием дисфункции бета-клеток и формированием СД 2-го типа [4, 5]. В отличие от мышей с неизмененной массой тела у особей с ожирением ПЖ содержала больше общего панкреатического жира, триглицеридов, свободных жирных кислот (СЖК), но меньше фосфолипидов и холестерина.
СЖК служат субстратом для перекисного окисления липидов, способствуют нарушению целостности клеточных мембран клеток ПЖ и одновременно повышают выработку провоспалительных цитокинов (фактора некроза опухоли альфа, интерлейкинов 6 и 8). На основании этого исследователи предположили, что выявленные отличия могут быть связаны с провоспалительной активностью жировой ткани. Так впервые был предложен термин «неалкогольный стеатопанкреатит».
Экспериментальные данные подтверждают влияние эндотоксинемии на развитие стеатоза ПЖ с формированием СД 2-го типа [6].
Ожирение и инсулинорезистентность являются причиной жировой инфильтрации многих органов, в том числе ПЖ. В исследовании E.J. van Geenen и соавт. [7] выявлена прямая связь между неалкогольной жировой болезнью печени и жировой болезнью ПЖ. Показано, что внутрилобулярное и тотальное ожирение ПЖ (стеатоз) достоверно зависит от активности стеатогепатита (р = 0,02 и р = 0,03).
Нарушение липидного обмена проявляется атерогенной дислипидемией, при которой значительно повышается концентрация СЖК в паренхиме ПЖ, что в свою очередь приводит не только к снижению активности инсулина, но и к дисфункции бета-клеток, главным образом к их апоптозу [8, 9].
Исследователи до сих пор изучают другие причины развития инсулинорезистентности, которая, как известно, играет определенную роль в патогенезе метаболического синдрома и стеатоза ПЖ. Речь, в частности, идет об агентах, усиливающих воспалительную реакцию, таких как фактор транскрипции NF-kappaB и его активатор IKK-бета [10, 11], селенопротеин P [12], адипокины (лептин, апелин, оментин и т.д.) [13].
Кроме того, развитию стеатоза ПЖ способствуют такие панкреатогенные факторы, как злоупотребление алкоголем и желчнокаменная болезнь [14].
Таким образом, различные пути развития жирового перерождения (стеатоза) ПЖ доказывают его полиэтиологичность (от банального избыточного питания, связанного с пищевым поведением, до нарушений на генном уровне) (рис. 1).
Большинство исследователей сходятся во мнении, что клинико-функциональное состояние ПЖ при метаболическом синдроме представляет собой дисметаболическую панкреатопатию (стеатоз, липогенный панкреатит, неалкогольную жировую болезнь ПЖ), которая заключается в диффузном развитии жировой ткани во всех отделах органа и сочетается с вялотекущим воспалением на фоне ожирения/метаболического синдрома [2, 4, 14].
Рост числа онкологических заболеваний на фоне ожирения также затрагивает проблему стеатоза ПЖ. Высока вероятность развития злокачественных образований ПЖ на фоне стеатоза [15]. Помимо этого хронический панкреатит на фоне стеатоза ПЖ характеризуется более тяжелым течением и менее благоприятным прогнозом для жизни [14, 16].
Между тем клинико-функциональное состояние ПЖ при метаболическом синдроме, равно как и диагностические особенности стеатоза ПЖ, недостаточно изучены [17, 18]. На сегодняшний день представлено незначительное количество работ. Как правило, это обзорные статьи или экспериментальные работы, в которых клинико-функциональному состоянию ПЖ при метаболическом синдроме уделено мало внимания [4, 16, 19]. К тому же приведенные в этих работах результаты исследований носят противоречивый характер.
Безусловно, все сказанное определяет актуальность проблемы стеатоза ПЖ, в частности его клинических особенностей и диагностики.
Клинические особенности
Специфических клинических проявлений стеатоза ПЖ не существует. Его основной признак – болевой синдром, который отличается от такового при хроническом панкреатите меньшей выраженностью. Схожими остаются локализация и иррадиация. Абдоминальная боль у 45–56% пациентов сопровождается диспепсическими явлениями – рвотой, тошнотой, вздутием живота [14]. Наиболее часто сочетание именно этих двух симптомов разной степени выраженности имеет место у больных с СД 2-го типа и/или нарушением толерантности к глюкозе [5, 6, 11].
Обращает на себя внимание и тот факт, что стеатоз ПЖ нередко сочетается, в частности, с неалкогольной жировой болезнью печени, холестерозом желчного пузыря, хронической ишемической болезнью органов пищеварения, которые относятся к холестерин-ассоциированным заболеваниям.
Кроме того, замечено, что больные стеатозом ПЖ страдают избыточным весом. Индекс массы тела у них нормальный или превышает норму (более 30 кг/м2). Это отличает больных стеатозом ПЖ от больных хроническим панкреатитом. Для последних характерно снижение ИМТ (менее 25 кг/м2) [14].
Диагностические особенности
При обследовании пациентов со стеатозом ПЖ применяются как общеклинические, лабораторные, так и инструментальные методы.
В биохимическом анализе крови часто выявляются гиперхолестеринемия, преимущественно за счет повышения уровня триглицеридов, и невысокий уровень амилазы. Кроме того, отмечается тенденция к гипергликемии и более высоким показателям в сыворотке крови гамма-глутамилтранспептидазы. Для хронического панкреатита характерны более высокие значения показателей воспаления, таких как лейкоцитоз, скорость оседания эритроцитов, и повышенная активность амилазы.
Из наиболее доступных инструментальных методов исследования в диагностике стеатоза ПЖ чаще применяется ультразвуковое исследование (УЗИ) [20], чувствительность которого варьирует от 37 до 94%, а специфичность – от 48 до 100% [21]. При УЗИ стеатоз ПЖ отображается в виде неравномерного повышения эхогенности железы, сочетающегося с некоторой неотчетливостью внутренней структуры органа (уменьшение внутренней зернистости) и смазанностью контуров (рис. 2). Сочетание УЗ-признаков неалкогольной жировой болезни печени и стеатоза ПЖ отмечается в 68%, стеатоза ПЖ и нормальной УЗ-картины печени – в 30% случаев. Только в 2% случаев признаки стеатоза печени не ассоциируются со стеатозом ПЖ [22].
Следует отметить, что в отличие от методики расчета денситометрических параметров на основании компьютерной томографии (КТ) интерпретация ультразвуковых критериев стеатоза не исключает субъективной оценки врача. Именно поэтому наряду с ультразвуковым методом диагностики стеатоза ПЖ необходимо использовать КТ. Данный метод рассматривается как неинвазивный метод исследования, позволяющий достоверно диагностировать стеатоз ПЖ.
Прямыми признаками стеатоза ПЖ при КТ служат снижение денситометрических показателей (менее 30 единиц Хаусмана (Hausmann) – ед. Н), дольчатое строение железы с выраженными жировыми прослойками. На рисунке 3 представлена КТ-картина нескольких последовательно выполненных срезов, на основании которых можно четко определить изменения ПЖ во всех ее отделах. В то же время плотность нормальной ткани ПЖ существенно выше – 35–50 ед. Н.
Чаще встречается распространенный характер стеатоза ПЖ. На сканограммах он выглядит в виде ослабления сигнала. Реже отмечаются так называемые локальные формы, требующие дифференциальной диагностики от очагового поражения ПЖ. Обычно они встречаются в теле и хвосте ПЖ, реже в области головки.
Трудности дифференциальной диагностики стеатоза ПЖ от очаговых поражений ПЖ отмечаются при невыраженном стеатозе. В связи с этим КТ не рассматривается как единственно достоверный метод исследования. В таких случаях для уточнения диагноза стеатоза ПЖ используется магнитно-резонансная томография (МРТ).
Таким образом, лучевые методы диагностики (КТ, МРТ) позволяют объективизировать диагностику стеатоза ПЖ. В настоящее время с диагостической целью используется тонкоигольная пункционная биопсия ПЖ (рис. 4 и 5).
Подходы к терапии
Лечение стеатоза ПЖ без клинических проявлений (отсутствие болевого и диспепсического синдромов) предусматривает соблюдение общих рекомендаций для больных с метаболическим синдромом [23]: коррекцию веса, сбалансированное питание, лечение инсулинорезистентности, атерогенной дислипидемии, сопутствующих заболеваний билиарного тракта.
При симптомном течении стеатоза ПЖ показаны прежде всего ферментные препараты как средства заместительной терапии купирования болевого и диспепсического синдромов.
При выборе ферментных препаратов следует руководствоваться степенью секреторной недостаточности ПЖ и выраженностью болевого синдрома. При стеатозе ПЖ секреция липазы страдает в большей степени, чем амилолитические и протеолитические ферменты [9].
Наиболее обоснованным считается применение ферментных препаратов в микросферах – Креон® 25000 или Эрмиталь®.
При болевом синдроме рекомендуются миотропные спазмолитики, препараты, улучшающие микроциркуляцию (Дибикор®
500 мг/сут в течение четырех недель), статины при гиперхолестеринемии (Крестор® 5 мг/сут до нормализации липидного спектра), препараты фиброевой кислоты при гипертриглицеридемии (Трайкор 145 мг/сут в течение четырех недель), сорбенты, ингибиторы протонной помпы (Омез® 20 мг/сут по требованию), препараты, уменьшающие инсулинорезистентность (Метформин Лонг от 1000 мг/сут). Кроме того, проводят санацию кишечника рифаксимином 800 мг в течение семи дней с последующим приемом пробиотиков.
Заключение
Итак, изложенное выше позволяет утверждать, что метаболический синдром связан со стеатозом ПЖ. Именно поэтому при метаболическом синдроме важно уточнять особенности состояния ПЖ. Изменения ее функций имеют значительный удельный вес в развитии основных составляющих метаболического синдрома – гиперинсулинемии, инсулинорезистентности, нарушения толерантности к глюкозе. В то же время гиперинсулинемия, гипергликемия, дислипидемия и микроциркуляторные нарушения отягощают состояние ПЖ.
Источник
