Ki 67 рак поджелудочной железы

Нейроэндокринные опухоли (НЭО) — это гетерогенная группа новообразований, развивающихся из нейроэндокринных клеток. Такие клетки расположены в различных органах и секретируют биологически активные вещества, эффекты которых обуславливают многообразие клинической картины и трудности диагностики. Прежде чем попасть на прием к онкологу, пациентам зачастую бывают проведены консультации различных специалистов, обращение к которым вызвано симптоматикой новообразования. Ранняя диагностика НЭО в значительной мере зависит от онконастороженности непрофильных клиницистов и, конечно же, от морфологической верификации диагноза — «золотого правила» в онкологии, своеобразной точки отсчета онкологической истории.
Локализация НЭО крайне разнообразна, но чаще всего они обнаруживаются в органах пищеварительной системы (более 50 %): прямая (17,2 %) и тонкая кишка (13,4 %), желудок (6,0 %), поджелудочная железа (6–7 %). НЭО занимают второе место в общей структуре онкологической патологии ЖКТ, уступая лидерские позиции лишь колоректальному раку. Около 27 % случаев НЭО возникают в легких (согласно базе данных Surveillance, Epidemiology, and End Results (SEER) 1975-2016) [1].
Еще недавно обсуждались вопросы включения НЭО в список орфанных заболеваний. Но в настоящее время отмечается увеличение частоты встречаемости этой патологии, в том числе из-за улучшения диагностических возможностей (в частности, распространение гастроскопии, колоноскопии, капсульной эндоскопии).
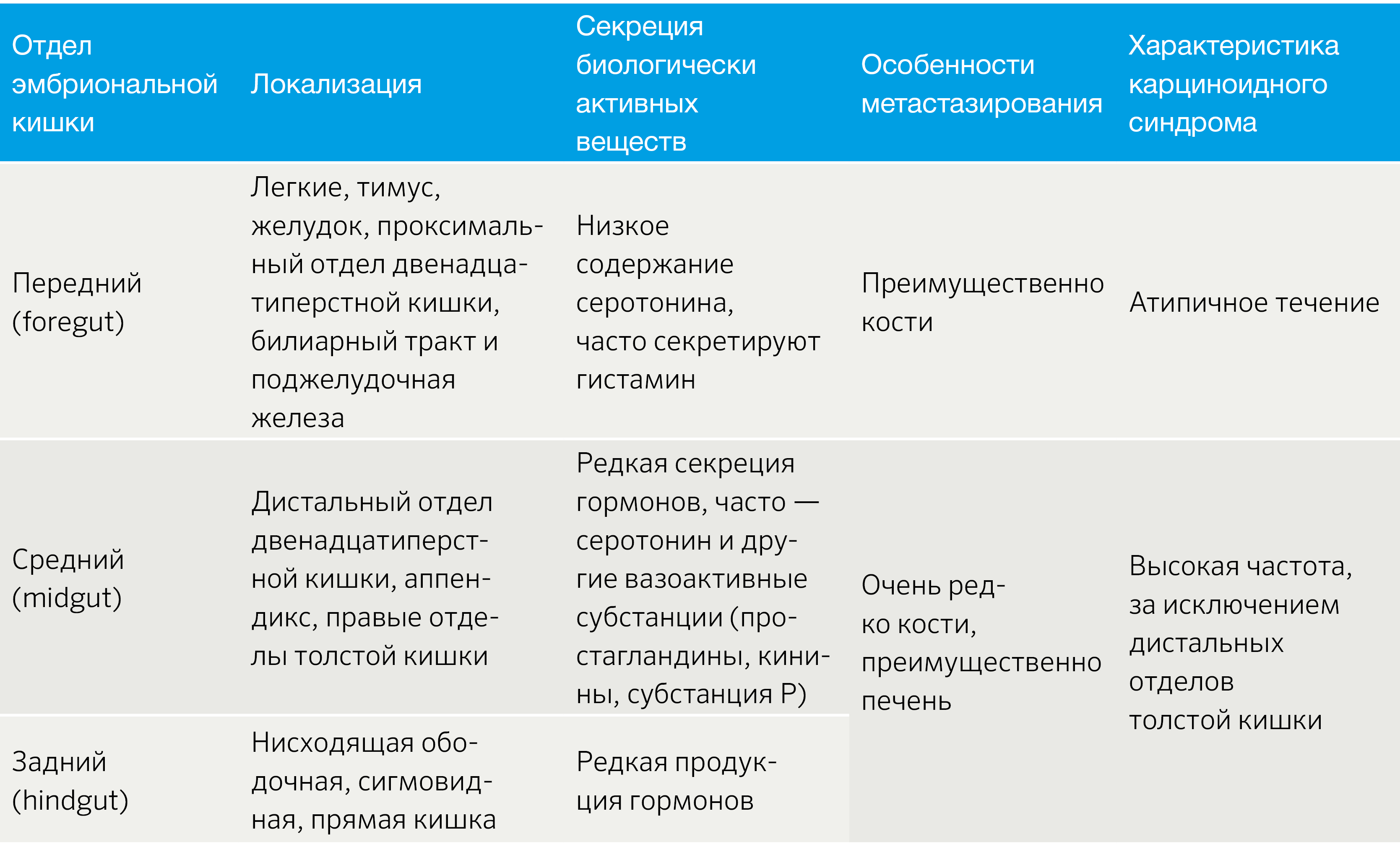
НЭО классифицируют в зависимости от отдела эмбриональной кишечной трубки: из передней, средней и задней кишки (табл. 1) [2].
Табл.1 | Классификация НЭО по эмбриогенезу [2].
Карциноидный синдром — важный клинический признак. В основном, он обусловлен эффектами серотонина, а также брадикинина, гистамина, дофамина и в меньшей степени других биологически активных веществ (БАВ).
Клинические проявления карциноидного синдрома разнообразны. Наиболее часто у пациентов отмечается гиперемия кожи лица, приливы, диарея, боль в животе. У 60 % пациентов отмечают формирование карциноидной болезни сердца, с нарушением работы преимущественно клапанного аппарата правых отделов (стеноз и/или недостаточность легочного и трехстворчатого клапанов). Серьезным осложнением является декомпенсация нарастающей сердечной недостаточности. Морфологическим субстратом служит выраженный диффузный фиброэластоз эндокарда. Возможны появления телеангиоэктазий, одышки, пеллагры, бронхоспазма. Усиливается продукция соединительнотканных компонентов, в частности, коллагена. Это ведет к фиброзированию и стенозу брыжеечных артерий, фиброзирующему стенозу уретры. Ввиду склонности к развитию спаечного процесса в брюшной полости нарастает риск формирования кишечной непроходимости.
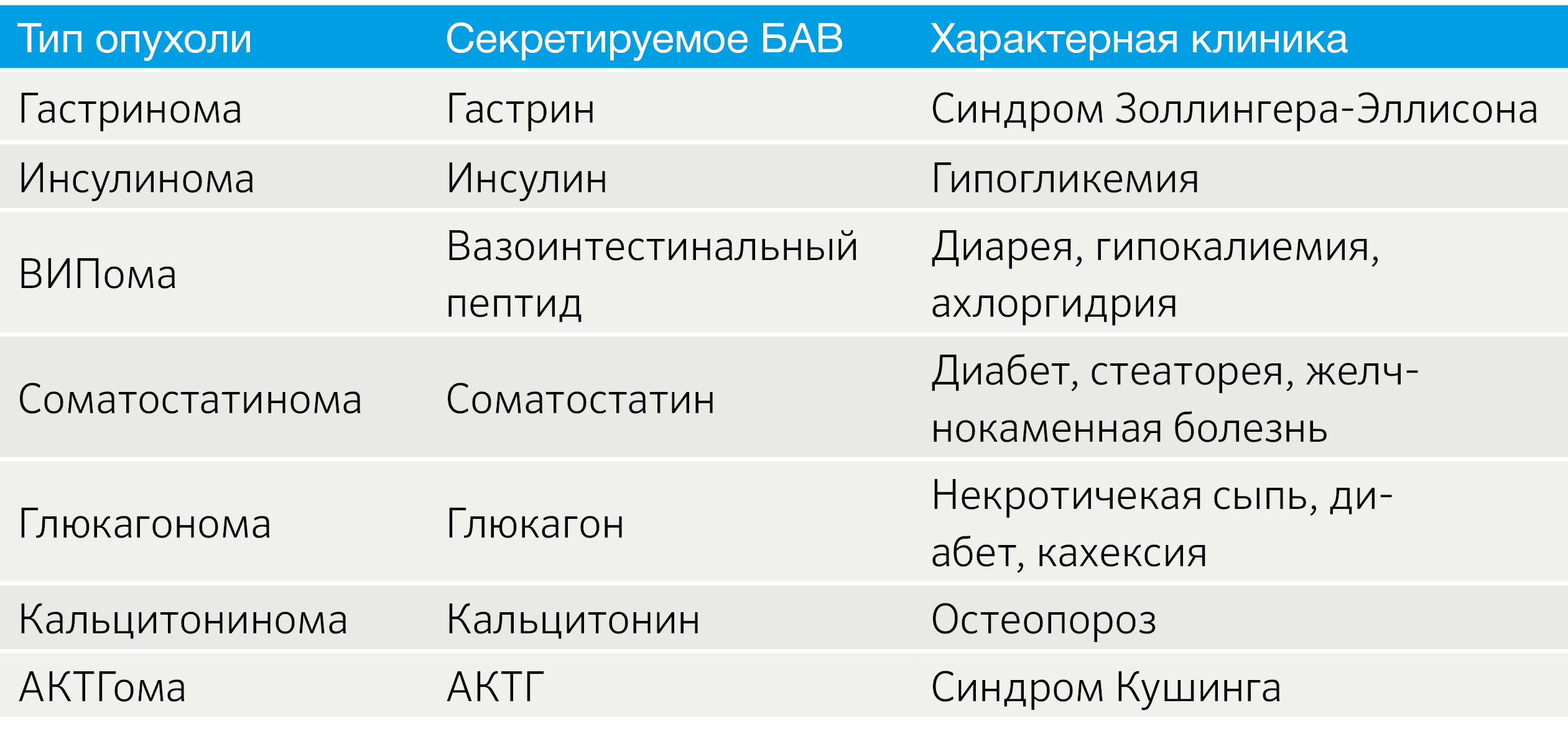
Важным аспектом является функциональный статус опухоли. В зависимости от наличия продукции БАВ выделяют функционирующие (табл. 2) и нефункционирующие новообразования [3].
Табл.2 | Функционирующие НЭО [3].
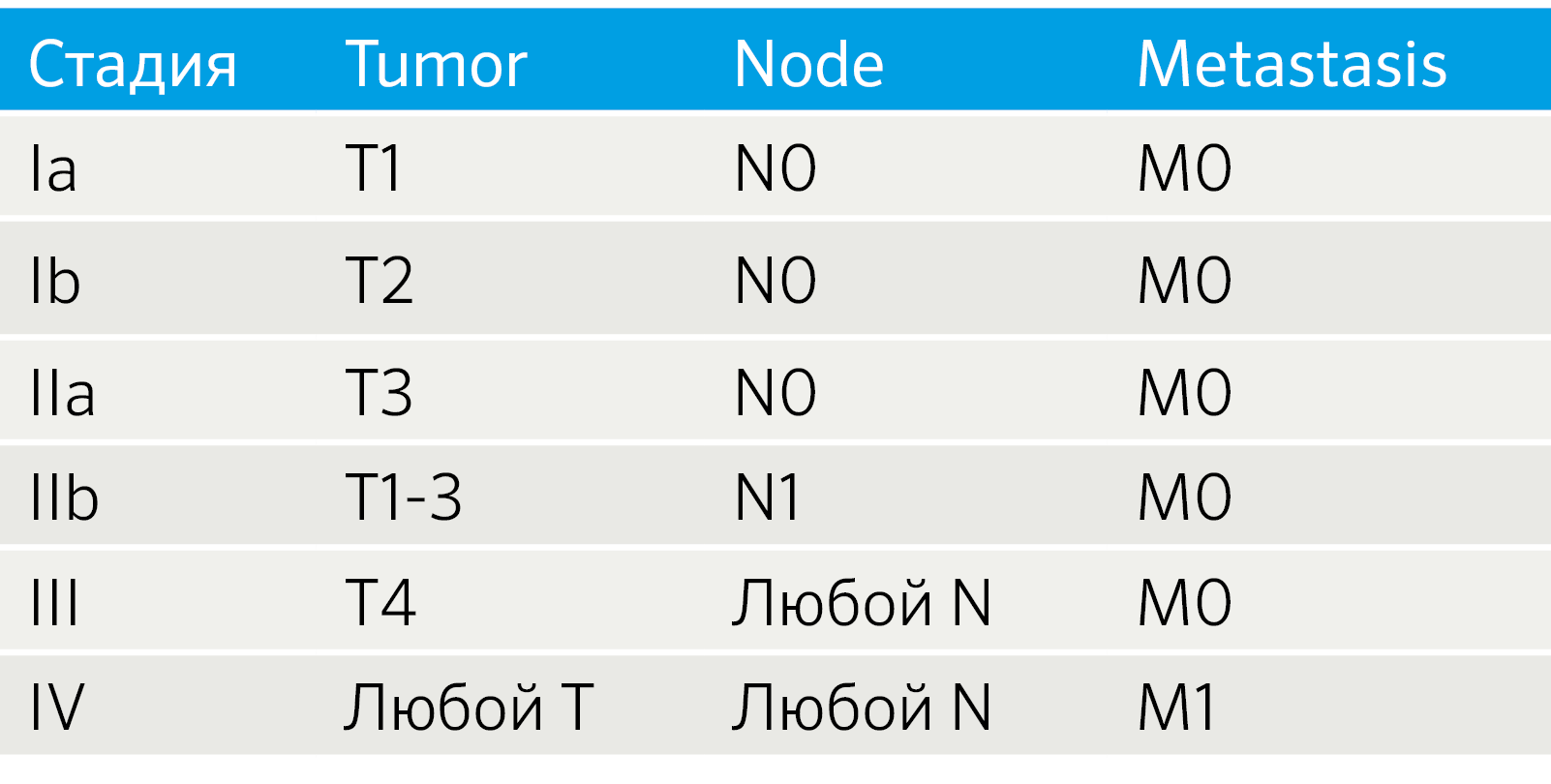
Особенности TNM-классификации определяются локализацией НЭО. НЭО легких стадируются как немелкоклеточный рак легких, для НЭО ЖКТ и поджелудочной железы разработаны рекомендации Европейского общества по изучению НЭО (ENETS) [4]. Также установление стадии TNM для всех анатомических локализаций регламентируется руководством, созданным Американским объединенным комитетом по раковым заболеваниям (the American Joint Committee on Cancer, AJCC) [5, 6]. Так как эти системы не идентичны, возникают вопросы унификации подходов к стадированию. Например, была создана модифицированная система ENETS (mENETS), для диагностики НЭО поджелудочной железы (pNET) (табл. 3) [7].
Табл.3 | Стадирование НЭО поджелудочной железы согласно модифицированной системе ENETS (mENETS) [7].
И вот мы подходим к той черепахе, на которой стоят киты онкологической диагностики. Это, несомненно, гистологическая верификация диагноза. Как и многие опухолевые заболевания, морфологические градации НЭО подвергались различным модификациям, уточнениям, дополнениям. Дискуссии в этой области в итоге привели к созданию 4-ой редакции классификации ВОЗ (2017 год) [8]. Именно она является актуальной на настоящий момент и заключение при проведении патологоанатомическом исследовании должно отвечать введенным в ней понятиям и требованиям.
Параметрами морфологической оценки нейроэндокринных новообразований являются: гистологическое строение опухоли, определение сосудистой и периневральной инвазии, митотический индекс. Несмотря на многообразия источников НЭО, морфологическая картина является сходной (рис. 1) [9].
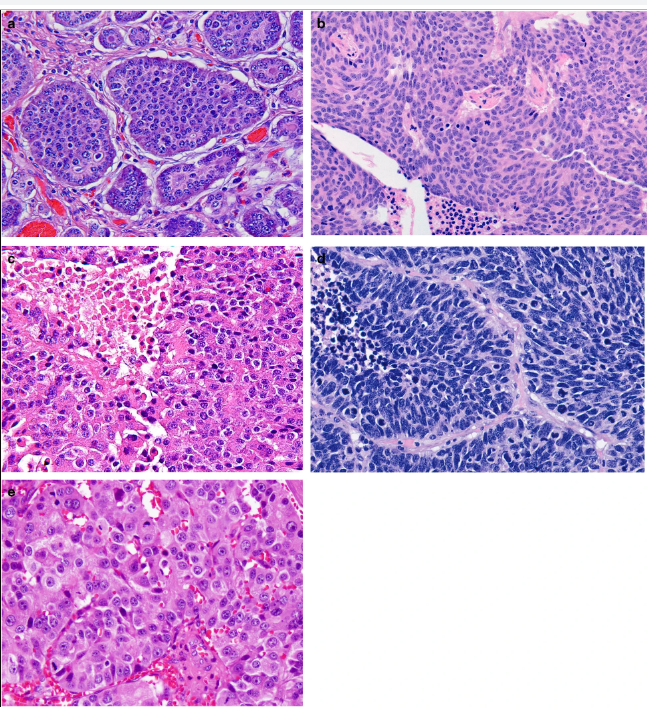
Рис.1 | Топическое многообразие нейроэндокринных опухолей (НЭО).
а — НЭО G1 (Grade) подвздошной кишки, б — НЭО G2 легкого (атипичный карциноид), с — НЭО G3 поджелудочной железы, d — мелкоклеточный НЭР легких, е — крупноклеточный НЭР поджелудочной железы. Окраска гематоксилин-эозин [9].
Нейроэндокринное происхождение атипичных клеток доказывает положительная экспрессия так называемых общих нейроэндокринных маркеров. Основные из них это хромогранин А, окрашивающий компоненты нейросекреторных гранул, и пептид синаптофизин, накапливающийся в мелких синаптических везикулах. Также применяется дополнительно установление экспрессии рецепторов соматостатина 2 и 5 типов (SSTR2 и SSTR5). В этом случае возможно определить чувствительность опухолевых клеток к аналогам соматостатина.
Степень злокачественности НЭО определяют на основании двух основных критериев: уровня дифференцированности опухолевых клеток и их пролиферативной активности. Традиционно выделяют три степени злокачественности (grade): G1, G2, G3. Для НЭО ЖКТ и поджелудочной железы введены понятия высокодифференцированных и низкодифференцированных новообразований (или нейроэндокринного рака (карциномы), НЭР). Высокодифференцированные НЭО объединяют G1 (менее 2 митозов на 10 репрезентативных полей зрения (РПЗ) при большом увеличении микроскопа (х400) и индекс Ki-67 ≤ 2%), G2 (2–20 митозов на 10 РПЗ и индекс Ki-67 3–20 %), G3 (> 20 митозов на 10 РПЗ и индекс Ki-67 > 20 %). Grade 3 опухоли разделяют на мелко- и крупноклеточный рак. Опухоли мелкоклеточного типа построены из однотипных клеток округлой, овальной или вытянутой формы, мелкого размера, со скудной цитоплазмой и нечеткими границами. Ядра имеют характерный вид за счет нежного хроматина и невизуализирующихся ядрышек. Определяются массивные некрозы. Крупноклеточные НЭР образованы, соответственно, клетками крупного или среднего размера, с низким ядерно-цитоплазматическим соотношением, выраженной атипией ядер, содержащих гранулярный хроматин и четкие ядрышки. В опухолевой ткани выявляются мультифокальные некрозы, значительное число митозов [8, 9].
Индекс Ki-67 определяют как средний процент окрашенных ядер при учете 500–2000 злокачественно трансформированных клеток (рис. 2) [9].
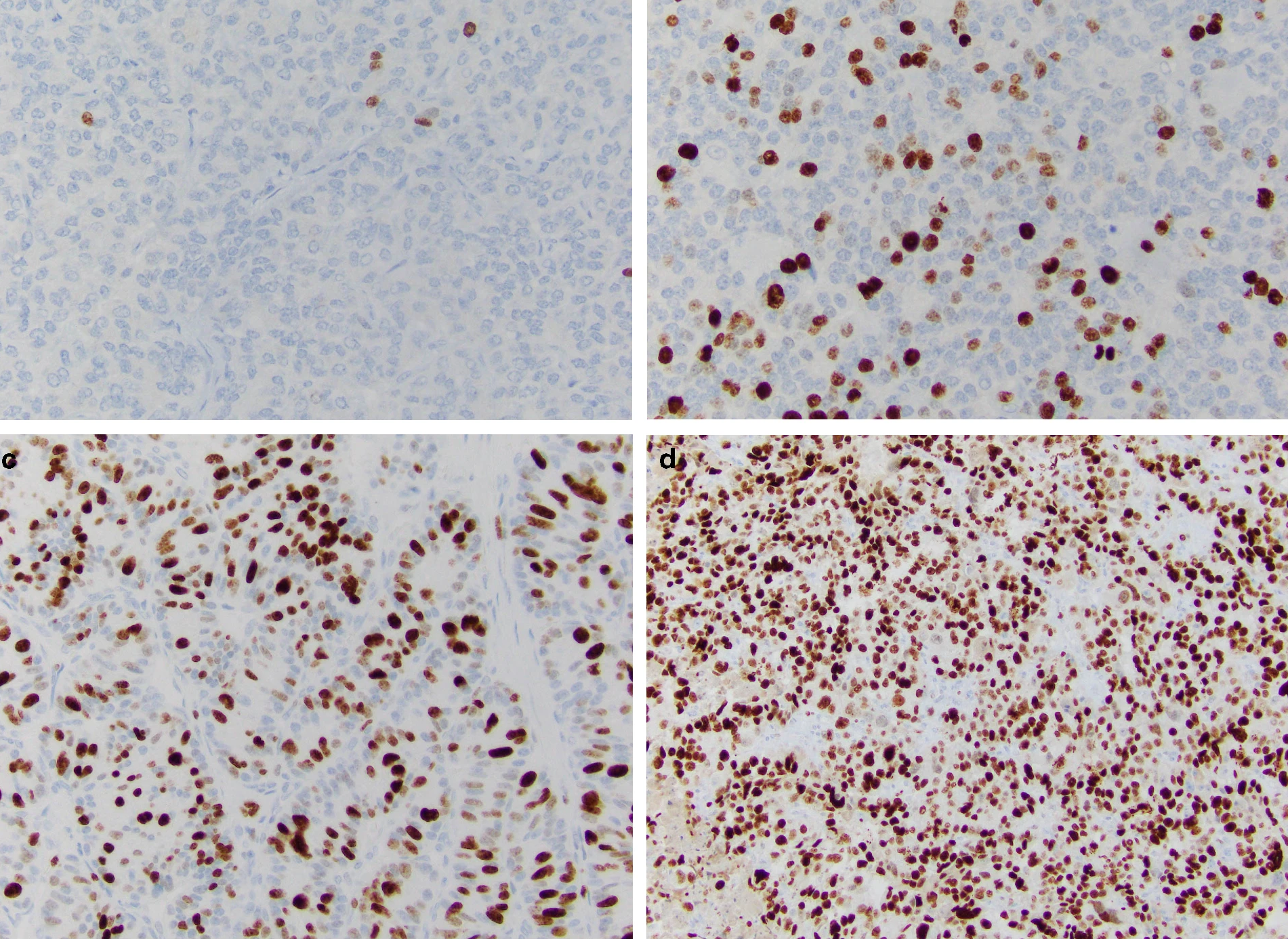
Рис.2 | Иммуногистохимическое определение индекса пролиферации (маркер Ki-67):
а — НЭО G1 (Grade) подвздошной кишки, б — НЭО G2 легкого (атипичный карциноид), с — НЭО G3 поджелудочной железы, d — мелкоклеточный НЭР легких [9].
Рассмотрим различия понятий НЭО G3 и НЭР при локализации в поджелудочной железе. Несмотря на высокую степень злокачественности НЭО G3 гистологически имеют органоидную модель строения (рис. 3), отсутствие некрозов [10]. При иммуногистохимическом исследовании опухолевая ткань сохраняет экспрессию общих маркеров нейроэндокринной дифференцировки (диффузно и интенсивно определяется экспрессия синаптофизина, зачастую хромогранина А), а также панкреатические экзокринные или эктопические гормоны. Кроме того, в них отсутствует выраженная экспрессия p53 и утрата экспрессии RB (также определяются иммуногистохимически).
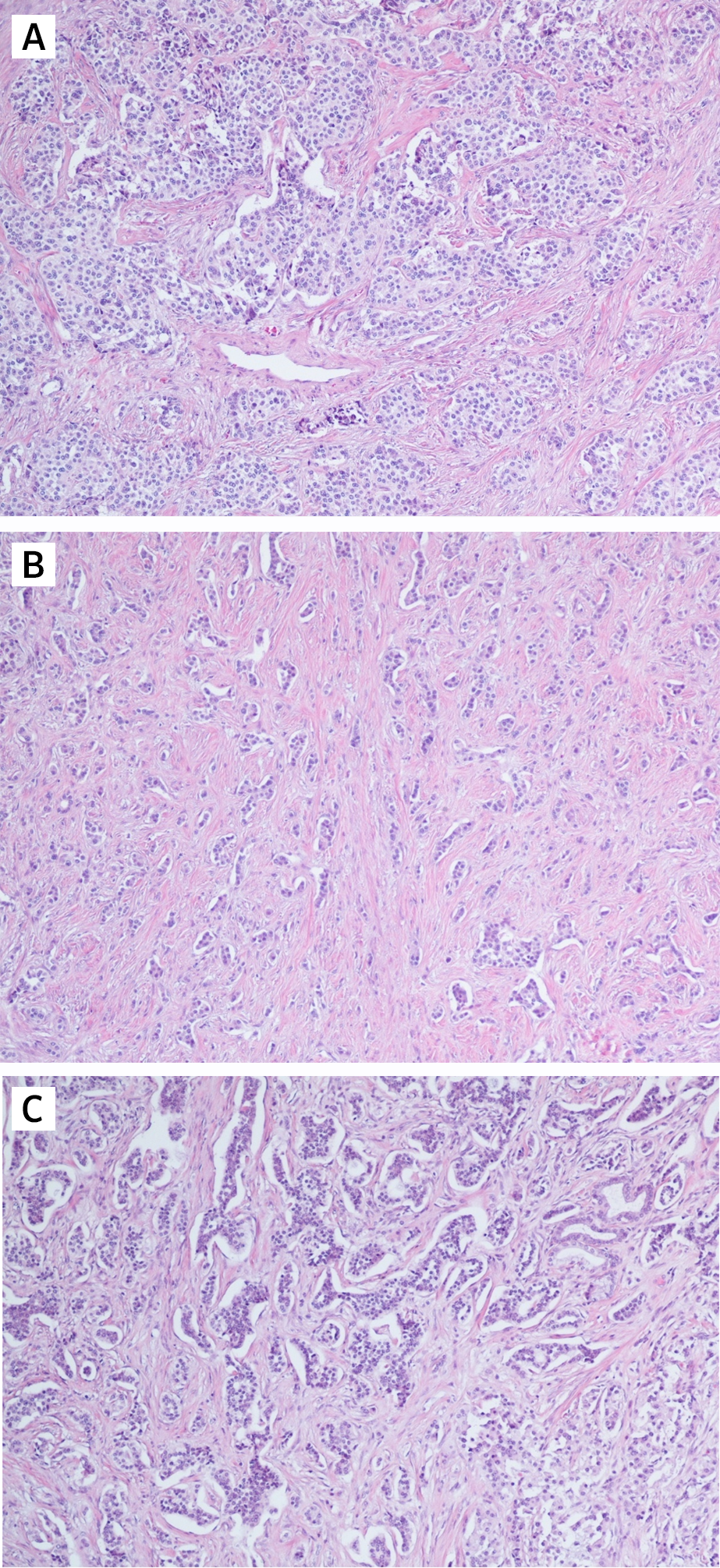
Рис.3 | Высокодифференцированная нейроэндокринная опухоль поджелудочной железы.
Отмечается наличие хорошо организованной гистоархитектуры: А — органоидный тип; В — псевдотрабекулярный тип; С — крибриформный тип. Окраска гематоксилин-эозин [10].
НЭР поджелудочной железы — это опухоли низкой степени дифференцировки и соответственно высокой степени злокачественности. Экспрессия общих маркеров нейроэндокринной дифференцировки атипичными клетками снижается: синаптофизин определяется слабо или диффузно, хромогранин А также слабо или фокально. Экзокринные гормоны отрицательны в таких опухолях [9]. Часто определяется экспрессия р53, белков ремоделирования хроматина DAXX (death-associated protein 6) и ATRX (АТФ-зависимая хеликаза), потеря экспрессии RB (белок ретинобластомы) и ISL1 (энхансер гена инсулина 1) [11].
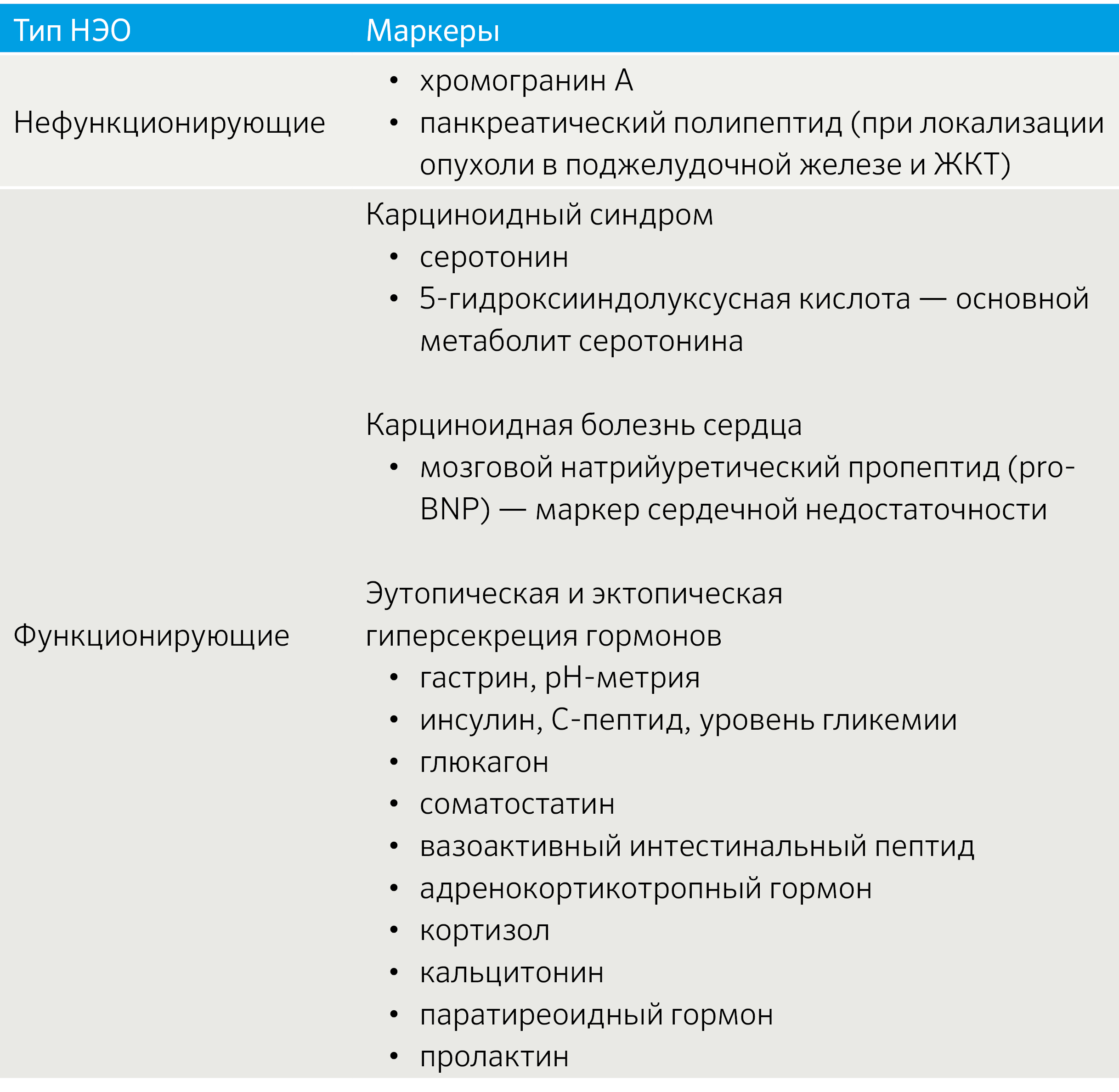
Ввиду многообразия секретирующего профиля НЭО биохимическая диагностика включает различные маркеры, комбинируемые с учетом клинической картины (табл. 4).
Табл. 4 | Спектр биохимических маркеров НЭО [2].
Методы лучевой диагностики включают «классические» КТ и МРТ с контрастированием. Для оценки метастатического поражения печени возможно проведение УЗИ органов брюшной полости.
Радионуклидная диагностика играет важную роль в топической характеристике НЭО. Она включает методы специфической метаболической визуализации (123I-MIBG), рецепторной визуализации (111In-октреотид, 68Ga-DOTA-TOС/DOTA-NOC/DOTA-TATE) и неспецифической метаболической визуализации (18F-FDG, 18F-DOPA).
123
I-метайодбензилгуанидин (MIBG) является аналогом норадреналина (норэпинефрина). Он накапливается в адренергических тканях и опухолях, происходящих из них. Сцинтиграфия с 123I-MIBG используется для диагностики нейробластомы, феохромоцитомы, параганглиомы, карциноидов бронха и тонкой кишки [12].
Для рецепторной визуализации применяют 111In (индий)-октеотид. Он выявляет высокодифференцированные нейроэндокринные опухоли, опухоли из клеток островкового аппарата поджелудочной железы (гастринома, глюкагонома, инсулинома). Также для верификации НЭО ЖКТ применяется соматостатин-рецепторная сцинтиграфия, так как большинство из них имеют рецепторы к соматостатину (SSTR) на поверхности опухолевых клеток (чаще 2 и 5 типа).
Выбор радионуклидного метода связан со степенью дифференцировки опухолевых клеток. Первичная диагностика НЭО Grade 1 и 2 проводится путем ПЭТ/КТ с радиофармпрепаратами (РФП), мечеными галлием 68 (является ПЭТ-радионуклидом). Сродство (аффинитет) РФП к конкретному подтипу трансмембранных рецепторов соматостатина определяет выбор диагностического индикатора (ПЭТ-лиганда, представленного различными модификациями DOTA). Например, для визуализации НЭО, экспрессирующих рецепторы подтипов SSTR2a и SSTR2b, применяют 68Ga-DOTA-TATE (DOTA-Tyr3-октреотад). 68Ga-DOTA-NOC (DOTA-1-Nal3-октреотид) выявляет подтипы SSTR3 и SSTR5, 68Ga-DOTA-ТOC (DOTA-Tyr3-октреотид) — рецепторы SSTR5 [13].
При отсутствии возможности проведения данного исследования следует выполнить однофотонную эмиссионную компьютерную томографию (ОФЭКТ)/КТ (гибридный метод визуализации) с соматостатин-рецепторным радиофармпрепаратом.
Для недифференцированных НЭО Grade 3 и НЭР при отрицательных результатах соматостатин-рецепторной сцинтиграфии рекомендуется ПЭТ неспецифическая метаболическая визуализация с использованием других РФП. В частности, ПЭТ/КТ c 18F-фтордезоксиглюкозой (18F-ФДГ), которая неэффективна при высокодифференцированных НЭО [14]. Также рассматривают применение 18F-L–DOPA (дигидроксифенил-аланин) — меченого предшественника допамина, который эффективен для обнаружения медуллярного рака щитовидной железы, НЭО, параганглиомы и феохромоцитомы [15].
Современные классификации НЭО в значительной мере основаны на общей морфологии, которую эти новообразования демонстрируют в различных анатомических участках. Закономерно предположить, что такая структурная схожесть является результатом общей «нейроэндокринной» мультигенной программы, стимулирующей дифференцировку нейроэндокринных клеток. Но схожесть не означает идентичность, и несомненно существующая тканеспецифичность нейроэндокринных клеток диктует характерною индивидуальную гормональную продукцию. Профиль экспрессии БАВ атипичными клетками определяет клиническую картину и прогноз заболевания. Поэтому важно иметь возможность точно определяет источник опухоли. С использованием все расширяющихся диагностических возможностей такой подход становится реальным, формируя персонализацию терапевтических стратегий в нейроэндокринной онкологии.
Список литературы:
1. Surveillance, Epidemiology, and End Results (SEER) Program (www.seer.cancer.gov) Research Data (1975-2016), National Cancer Institute, DCCPS, Surveillance Research Program, released April 2019, based on the November 2018 submission.
2. Kloppel G. Neuroendocrine Neoplasms: Dichotomy, Origin and Classifications. Visc Med. 2017;33:324–30.
3. Oronsky B., Ma P.C., Morgensztern D., Carter C.A. Nothing But NET: A Review of Neuroendocrine Tumors and Carcinomas. Neoplasia. 2017;19(12):991–1002.
4. https://www.enets.org/current_…
5. Сайт AJCC https://cancerstaging.org/Page…
6. Amin M.B. et al. (Eds.). AJCC Cancer Staging Manual (8th edition). Springer International Publishing: American Joint Commission on Cancer; 2017.
7. Luo G.et al. Modified Staging Classification for Pancreatic Neuroendocrine Tumors on the Basis of the American Joint Committee on Cancer and European Neuroendocrine Tumor Society Systems. Journal of Clinical Oncology 2017;35(3):274-280.
8. Lloyd R.V., Osamura R.Y., Klöppel G., Rosai J. WHO Classification of Tumours of Endocrine Organs. 4th ed. Lyon: International Agency for Research on Cancer; 2017. 355 p.
9. Rindi G. et al. A common classification framework for neuroendocrine neoplasms: an International Agency for Research on Cancer (IARC) and World Health Organization (WHO) expert consensus proposal. Mod Pathol. 2018;31:1770–1786.
10. Surgical pathology images of pancreatic neuroendocrine tumors of pancreas, contributed by Sabrina Sopha, M.D. https://www.pathologyoutlines.c…
11. Scarpa A. et al. Whole-genome landscape of pancreatic neuroendocrine tumours. Nature. 2017;543:65–71.
12. Maxwell J.E., O’Dorisio T.M., Howe J.R. Biochemical Diagnosis and Preoperative Imaging of Gastroenteropancreatic Neuroendocrine Tumors. Surg Oncol Clin N Am.2016;25(1):171-94.
13. Wild D.et al. Comparison of 68Ga-DOTANOC and 68Ga-DOTATATE PET/CT within patients with gastroenteropancreatic neuroendocrine tumors. J Nucl Med. 2013;54(3):364-72.
14. Navalkissoor S, Flux G, Bomanji J. Molecular radiotheranostics for neuroendocrine tumours. Clin Med (Lond). 2017;17(5):462–468.
15. Pretze M., Wängler C., Wängler B. 6-[18F]fluoro-L-DOPA: a well-established neurotracer with expanding application spectrum and strongly improved radiosyntheses. Biomed Res Int. 2014;2014:674063
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Белок Ki-67 — самый широко используемый маркер пролиферации как в нормальных, так и в опухолевых клетках. Впервые описан в 1983 году в Институте патологии в немецком городе Киль, где и были синтезированы первые антитела к нему в 67 лунке планшета [1].
Негистоновый белок Ki-67 кодируется геном MKI67. Он участвует в клеточном цикле, вовлекаясь в биогенез рибосом, организацию гетерохроматина и разделение митотических хромосом. Полный спектр его функций все еще неясен. Трудности исследования Ki-67 связаны с отсутствием гомологичных белков с уже известной функцией, а также с его большой молекулярной массой и высокой чувствительностью к разрушению протеазами [2].
Ki-67 обнаруживается в ядрах клеток во все активные фазы клеточного цикла: G1, S, G2, M. Ki-67 весьма «ветреный» белок: его распределение и количество вариабельно и зависит от конкретного момента жизни клетки (рис. 1) [3]. От фазы G1 к фазе М его количество увеличивается, достигая максимума во время метафазы митоза. В самом начале фазы G1 локализация Ki-67 совпадает с локализацией сателлитной ДНК в центромерах и теломерах хромосом. Далее при прогрессии фазы G1 эта колокализация исчезает. К середине фазы G1 белок Ki-67 начинает выявляться в ядрышках, затем, в фазу G2, — и в ядрышках, и в кариоплазме.
.
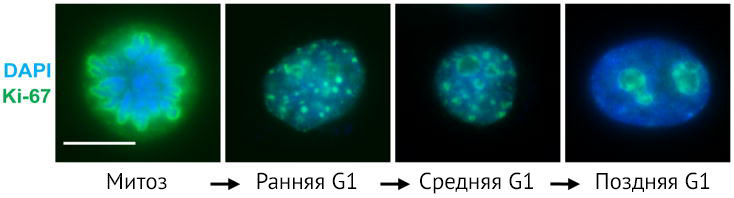
Рисунок 1. Локализация Ki-67 на протяжении всего клеточного цикла
Антитела к Ki67 (зеленый) и DAPI для визуализации ДНК (синий). В фазу митоза Ki-67 покрывает конденсированные хромосомы в качестве основы перихромосомного слоя. Когда клетки вступают в раннюю фазу G1, маленькие точечные структуры Ki-67 покидают деконденсированные хромосомы. Затем в ходе G1-фазы Ki-67 перемещается на периферию ядрышка, покрывая перинуклеолярный гетерохроматин [3].
Но все меняется, когда происходит митоз. В профазу Ki-67 в виде тонкой сети связан с конденсированным хроматином. В метафазу эта сетчатая структура окружает уже отдельные хромосомы. После разрушения ядерной мембраны часть Ki-67 распределяется диффузно в цитоплазме. В анафазу и телофазу митоза количество Ki-67 в клетках начинает быстро снижаться.
При переходе клетки после митоза в фазу G0 Ki-67 быстро подвергается катаболизму (путем опосредованной протеасомами деградации) и перестает выявляться в ядрах интерфазных клеток [4].
Ki-67 также обнаруживается при гиперэкспрессии p53 и p21, вызванной блокированием репликации или повреждением ДНК [2].
Длительное время Ki-67 определялся как иммуногистохимический маркер, отражающий лишь активность пролиферации. Это обусловило его важную роль в классификации злокачественных новообразований, таких как рак молочной железы, нейроэндокринные опухоли и лимфомы [5]. Определение индекса Ki-67 является более чувствительным методом для оценки пролиферативной активности, чем подсчет фигур митоза, поскольку позволяет выявлять клетки во всех активных фазах клеточного цикла и уменьшает вероятность неверной интерпретации микроскопической картины. Переход патоморфологов в своей рутинной практике к расчету индекса пролиферации по уровню Ki-67 стал начальным этапом движения в сторону стандартизации и объективизации гистологических исследований. От двоичной системы «есть экспрессия» (1) / «нет экспрессии» (0) фокус сместился к оценке степени выраженности маркера в исследуемых образцах.
Индекс пролиферации — это процент клеток с ядерным окрашиванием от общего числа опухолевых клеток. Интенсивность и тип экспрессии маркера не учитывается (перинуклеолярный, нуклеоплазменный, перихромосомный). Подсчет включает в себя не менее 500 опухолевых клеток (в идеале не менее 1000) не менее чем в 3 полях зрения при увеличении ×400. В случае гетерогенности опухоли выбирают участки с наибольшей митотической активностью [6].
Общие характеристики уровня пролиферации для опухолевой ткани различных локализаций:
- < 10 % — низкий уровень;
- 10–20 % — пограничные опухоли;
- > 20 % — высокий.
В лабораториях используют антитела к Ki-67 клонов MIB-1 (для работы с материалом, полученным от человека, крупного рогатого скота, собак, овец и лошадей) и MIB-5 (для работы с материалом, полученным от крыс и других грызунов). Эти структуры показали более высокое сродство к эпитопу антигена Ki-67 в условиях формалиновой фиксации доставляемого материала [2].
Особую значимость этот маркер приобрел при патоморфологическом исследовании опухолей молочной железы. Гистологический подтип гормон-позитивных люминальных опухолей определяется на основании индекса Ki-67: подтип А (Ki-67 < 20 %) и подтип В (Ki-67 ≥ 20 %) (рис. 2) [6].
.
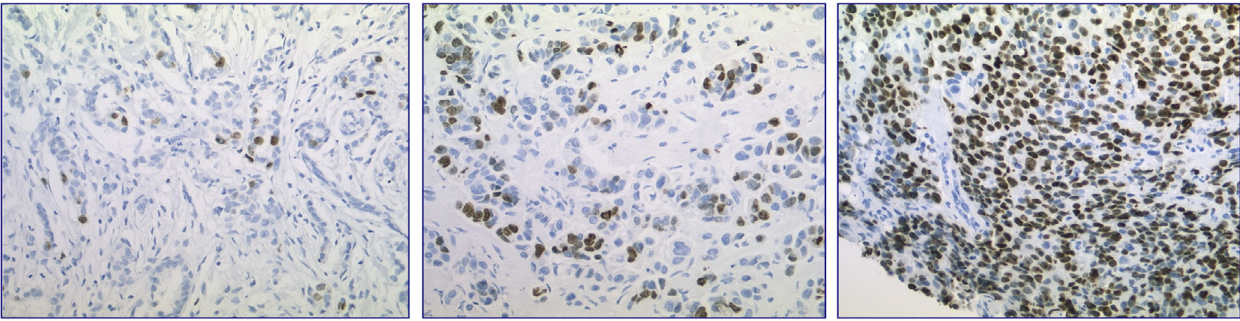
Рисунок 2. Активность пролиферации в образцах рака молочной железы
Опухоли с индексом Ki-67 < 10 %, 10–20 % и > 20 % соответственно [6].
Прогностические горизонты применения маркера Ki-67 постоянно расширяются. Уточняется и дополняется его значение в предикции результатов лекарственной терапии опухолей. Например, для рака молочной железы, который не отвечает на химиотерапию, повышение Ki-67 является плохим прогностическим маркером. Напротив, в опухолях, реагирующих на химиотерапию, этот эффект не наблюдается, и даже присутствует корреляция увеличения Ki-67 с улучшением прогноза.
Объяснение этому феномену можно логически вывести из понимания биологии каждого подтипа опухоли:
- Низко пролиферирующие опухоли хуже реагируют на химиотерапию, но в любом случае имеют хороший прогноз ввиду меньшей агрессивности (низкий Ki-67 — хороший результат).
- В тех высокопролиферирующих опухолях, которые чувствительны к терапии, высокий Ki-67 связан с большей частотой достижения полного патоморфологического ответа (pCR) и улучшением выживаемости (высокий Ki-67 — хороший результат).
- Но в высокопролиферирующих опухолях, которые при этом также являются резистентными к химиотерапии, увеличение индекса Ki-67 связано с уменьшением выживаемости: активно пролиферирующие клетки обусловливают агрессивное поведение опухоли, не контролируемое химиопрепаратами (высокий Ki-67 — плохой результат) [6].
В настоящее время методы иммуногистохимической детекции Ki-67 представляются в виде несколько упрощенной картины, как будто Ki-67 «включен» во время клеточной пролиферации (характерное коричневое окрашивание ядер) и «выключен» во время покоя и старения клетки (нет окрашенных ядер, может обнаруживаться в цитоплазме). Но важное клиническое значение может иметь также интерпретация факта неуклонного роста экспрессии Ki67 от фазы G1 к фазе М. Также выяснено, что чем дольше клетка находится в состоянии покоя, тем ниже будет уровень Ki-67 при повторном входе в клеточный цикл [5,7]. Для анализа этих данных требуются методы системной биологии с выведением формулы, позволяющей учесть все характеристики Ki-67 в доставленном материале. Это позволит более точно отразить пролиферативный статус клеток и определить клиническую стратегию. Ключевым моментом эффективности таких многофакторных алгоритмов является, несомненно, точность «сырых» данных. И здесь мы уже говорим о стандартизации патоморфологического исследования, которое в современной практике должно базироваться на цифровой обработке гистологических изображений.
Источники:
- Gerdes J., Schwab U., Lemke H., Stein H. Production of a mouse monoclonal antibody reactive with a human nuclear antigen associated with cell proliferation. Int J Cancer. 1983;31(1):13-20.
- Sun X., Kaufman P.D. Ki-67: more than a proliferation marker. Chromosoma. 2018;127(2):175–186.
- Matheson T.D., Kaufman P.D. The p150N domain of chromatin assembly factor-1 regulates Ki-67 accumulation on the mitotic perichromosomal layer. Mol Biol Cell. 2017;28(1):21–29.
- Kreipe H. [Ki67: biological intertumor variance versus variance of assay].Pathologe. 2018;39(Suppl 2):272-277.
- Cidado J.et al. Ki-67 is required for maintenance of cancer stem cells but not cell proliferation. Oncotarget. 2016;7(5):6281–6293.
- Denkert C. et al. Strategies for developing Ki67 as a useful biomarker in breast cancer. Breast.
2015;24 Suppl 2:S67-72. - Miller I.et al. Ki67 is a Graded Rather than a Binary Marker of Proliferation versus Quiescence. Cell Rep. 2018;24(5):1105–1112.e5.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
