Иммуномодуляторы при раке поджелудочной железы
Рак поджелудочной железы (РПЖЖ) — это одно из самых смертельных заболеваний среди солидных опухолей. Ежегодно регистрируется более 250000 смертей от рака поджелудочной железы. Он является восьмой по частоте причиной смерти от злокачественных новообразований у мужчин и женщин во всем мире, а заболеваемость РПЖЖ варьируется от 1 до 10 случаев на 100000 человек. Проблема рака поджелудочной железы актуальна в современной медицине, так как большинство пациентов с локальным или метастатическим РПЖЖ не являются кандидатами на лечебную резекцию из-за чрезвычайно неблагоприятного прогноза.
Несмотря на огромный прогресс в лечении других злокачественных опухолей благодаря прорыву в иммунотерапии рака, лечение рака поджелудочной железы развивалось медленно в течение последних двух десятилетий. Неэффективность иммунотерапии РПЖЖ объясняется несколькими факторами, в том числе слабой иммуногенностью опухоли (мутантные белки, экспрессируемые на поверхности опухолевых клеток РПЖЖ, обладают слабыми антигенными свойствами, по сравнению, к примеру, с антигенами меланомы или рака легкого), а также наличием иммуносупрессивных свойств как у самой опухоли, так и у ее микроокружения. Не последнюю роль в резистентности к терапии играет десмопластическая строма опухоли, состоящая из фибробластов, клеток поджелудочной железы, иммунных клеток, кровеносных сосудов и белков внеклеточного матрикса. Помимо уже упомянутых иммуносупрессивных свойств, она играет роль физического барьера, препятствующего доставке терапевтических агентов к опухолевым клеткам. Взаимодействие опухолевых клеток с микроокружением может приводить как к усилению роста опухоли и подавлению иммунного ответа на нее, так и к нарушению ее развития, что делает опухолевое микроокружение хорошей целью для терапевтического воздействия. Совокупностью этих факторов обосновывается неэффективность традиционной иммунотерапии. Это поднимает необходимость разработки и внедрения новых, улучшенных способов лечения РПЖЖ с помощью различных иммунологических методик, а также подготовки комбинированных схем терапии с применением различных препаратов или иных методов (например, лучевая терапия).
Устранение иммуносупрессивных свойств опухолей — это один из зарекомендовавших себя подходов в иммунотерапии рака. Ингибирование иммуносупрессивных молекул CTLA-4 и PD-1 — неплохой метод, который проявил себя в лечении таких видов рака как меланома, уротелиальная карцинома, рак почки, гепатоцеллюлярный рак и др. CTLA-4 (цитотоксический лимфоцитарный антиген 4) представляет собой ингибирующий рецептор, локализующийся на CD4+ и CD8+ лимфоцитах. Его экспрессия повышена в опухолях, и было показано, что блокада CTLA-4 вызывает противоопухолевый иммунный ответ. Препарат ипилимумаб — это человеческое моноклональное антитело, нацеленное на CTLA-4. Однако несмотря на его эффективность в терапии других опухолей, клинические испытания ипилимумаба в терапии РПЖЖ не показали эффективных результатов. Другой супрессивной молекулой является programming death 1 (PD-1, рецептор запрограммированной смерти 1). Он экспрессируется на эффекторных Т-лимфоцитах, B-лимфоцитах, NK-клетках и Treg. При связывании со своим лигандом PD-1L этот рецептор активирует ингибирование активации и пролиферации лимфоцитов. Терапия моноклональными антителами против PD-1 (препараты пембролизумаб и ниволумаб) также была эффективна при лечении солидных опухолей, таких как меланома, рак почки и урогенитальная карцинома. Также применяются моноклональные антитела против PD-1L (атезолизумаб). Однако клинические испытания на РПЖЖ не показали эффективности данных методов.
Другим подходом к лечению злокачественных новообразований является стимуляция собственного иммунитета организма пациента с помощью противоопухолевых вакцин. Такие вакцины предназначены для увеличения представления опухолевых антигенов и активации антигенспецифичных эффекторных Т-лимфоцитов и Т-клеток памяти. Выявлено несколько антигенов, которые экспрессируются в большинстве опухолей поджелудочной железы, как например карциноэмбриональный антиген (СЕА), муцин-1 (MUC-1) и белок, кодируемый мутированным геном KRAS. В настоящее время несколько вакцин были испытаны для терапии РПЖЖ. GVAX — это клеточная вакцина, в которой модифицированные клетки рака поджелудочной железы экспрессируют гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Фаза I клинических испытаний показала безопасность данной вакцины, однако эффект от терапии был неоднозначный. Несмотря на то, что не было выявлено улучшения однолетней и общей выживаемости в группах пациентов, получавших данную вакцину в сочетании с химиолучевой терапией, и пациентов, получавших только адъювантную лучевую терапию, подгруппа пациентов с длительной безрецидивной выживаемостью показала увеличение опухолеспецифичных CD8+ Т-лимфоцитов после вакцинации. Это демонстрирует, что данная методика может использоваться в отношении некоторой группы пациентов. Другой тип вакцин, на основе опухолевых пептидов, также был исследован. Вакцина на основе мутантного белка KRAS, который мутирует больше чем в 90 % случаев РПЖЖ, давала появление иммунного ответа у 58 % пациентов, причем медиана выживаемости среди таких пациентов была в два раза выше, чем у группы, не развивших иммунный ответ. Другая мультипептидная вакцина OCV-C01, содержащая фрагменты рецептора фактора роста эндотелия сосудов 1 и 2 (VEGFR1 и VEGFR2 соответственно), а также белка семейства кинезина (KIF20A), была исследована на пациентах с РПЖЖ. 58,6 % испытуемых показали развитие иммунного ответа на KIF20A, что сопровождалось значительным улучшением безрецидивной выживаемости. Данные результаты свидетельствуют о перспективности использования противоопухолевых вакцин и необходимости установления новых антигенных детерминант, более специфичных для РПЖЖ.
Хорошие результаты вакцин и важность иммуносупрессивных свойств микроокружения опухоли для успешной терапии дают обоснования для комбинирования данных методик в терапии РПЖЖ. Клиническое исследование комбинированной терапии ипилимумабом и вакциной GVAX показало эффективность данного подхода, по сравнению с монотерапией ипилимумабом, а также безопасность данного сочетания препаратов. Эффективной оказалась и комбинация GVAX с ингибиторами PD-1, которая демонстрировала значительное увеличение средней общей выживаемости по сравнению с монотерапией. В группе пациентов, получавших оба препарата, обнаруживалось увеличение CD8+ T-лимфоцитов, продуцирующих IFN-gamma. Было показано, что пациенты, получавшие GVAX за 2 недели до резекции опухоли, демонстрировали увеличение уровня PD-L1, что указывает на один из механизмов иммунорезистентности. Таким образом, комбинация вакцин и ингибиторов иммуносупрессивных молекул является обоснованной и перспективной схемой терапии, требующей дальнейших исследований.
Новым подходом к лечению РПЖЖ являются методики, воздействующие на определенный компоненты стромы рака поджелудочной железы, о роли которой в резистентности к терапии было упомянуто ранее. Мезенхимальная строма РПЖЖ содержит большое количество фибробластов, продуцирующих белок-α активирующий фибробласты (FAP-α). Высокая экспрессия этого белка коррелирует с худшим прогнозом заболевания. В эксперименте на мышах ликвидация клеток, экспрессирующих FAP-α, повышала эффективность противоопухолевых вакцин. Эффективными оказались и комбинации данной методики с анти-CTLA-4 и анти-PD-L1 препаратами. Другое исследование было направлено на блокаду рецептора колониестимулирующего фактора 1 (CSF1R), который экспрессируется на ассоциированных с опухолью М2-макрофагах и супрессорных миелоидных клетках (MDSC). Данные клетки обладают способностью блокировать цитотоксический иммунный ответ. Ингибирование CSF1R в сочетании с химиотерапией улучшает противоопухолевый иммунитет. В мышиной модели трансплантации РПЖЖ лечение ингибиторами CSF1R приводило к усилению инфильтрации опухоли Т-клетками, однако эти клетки демонстрировали повышенные уровни CTLA-4, а также наблюдалось усиление экспрессии PD-L1 в опухоле. Этот факт делает обоснованным сочетание ингибиторов CSF1R и анти-CTLA-4, анти-PD-L1 препаратов. IMC-CS4 является CSF1R-антителом, которое в настоящее время проходит клинические испытания в сочетании с GVAX и анти-PD1 терапией. Еще одна важная молекула, а точнее пара молекул, была исследована в качестве мишени для терапии РПЖЖ. Хемокин CXCL12 широко представлен в микроокружении опухоли, а его рецептор CXCR4 экспрессирован на опухолевых клетках. Показано, что CXCL12 способствует хемотаксису опухолевых клеток, что указывает на перекрестное клеточное взаимодействие между опухолевыми клетками и стромой. Это взаимодействие оказалось значимым для иммунорезистентности РПЖЖ, так как при обработке опухоли AMD3100 моноклональным антителом к CXCR4, регистрировалось снижение роста опухоли, зависимое от Т-лимфоцитов. Комбинация AMD3100 с анти-PD-L1 препаратом также оказалась эффективной. На данный момент AMD3100 находится в I фазе клинических испытаний в качестве терапии РПЖЖ под торговым названием Мозобил (Mozobil). Помимо ингибирующих агентов моноклональные антитела могут использоваться и как агонисты различных рецепторов. CD40 является молекулой, располагающейся на поверхности иммунных клеток. При связывании со своим лигандом CD40L (который экспрессирован на CD4+ Т-хелперных клетках) активирует антигенпредставляющие клетки. Было продемонстрировано, что усиление действия CD40 повышает эффективность противоопухолевых вакцин. Моноклональные антитела, активирующие CD40, приводили к регрессии опухоли в сочетании с химиотерапией в доклинических исследованиях. В клинических испытаниях I фазы терапия агонистом CD40 в сочетании с химиотерапией привела к иммунному противоопухолевому ответу в 19 % случаев у пациентов с неоперабельной формой РПЖЖ. В мышиных моделях, сочетание анти-PD-1 или анти-CTLA-4 препаратов с агонистами CD40 усиливало противоопухолевый иммунитет. 39 % мышей, получавших подобную схему терапии, демонстрировали длительную полную ремиссию и продолжительную выживаемость. Также терапия привела к уменьшению Treg и увеличению CD8+ Т-лимфоцитов в микроокружении опухоли. Важно, что в экспериментах на мышах сочетание CD40 агонистов с анти-PD-1 или анти-CTLA-4 препаратами показало улучшенную среднюю выживаемость по сравнению с комбинацией химиотерапии и CD40 агониста. На данный момент моноклональное антитело-агонист CD40 R07009789 проходит клинические испытания в комбинации с химиотерапией и ингибиторами супрессорных молекул.
Таким образом, рак поджелудочной железы является важной проблемой в современной медицине. Традиционные подходы иммунотерапии, такие как ингибиторы иммуносупрессивных молекул и противоопухолевые вакцины, малоэффективны в качестве монотерапии при РПЖЖ. В то же время, комбинации специальных препаратов, воздействующих на компоненты микроокружения опухоли с традиционной иммунотерапией и химиотерапией показали многообещающие результаты. Требуется дальнейшее всестороннее изучение данного злокачественного новообразования для разработки эффективных методов лечения, в том числе и иммунотерапии.
Источники:
- Torphy R. J., Zhu Y., Schulick R. D. Immunotherapy for pancreatic cancer: Barriers and breakthroughs //Annals of Gastroenterological Surgery. — 2018.
- Bhosale R. R. et al. Current Perspectives on Novel Drug Carrier Systems and Therapies for Management of Pancreatic Cancer: An Updated Inclusive Review // Critical Reviews™ in Therapeutic Drug Carrier Systems. — 2018. — Т. 35. — №. 3.
Источник
Величайшим достижением современной онкологии в лечении рака за рубежом является разработка и внедрение в клиническую практику различных препаратов, способствующих созданию противоракового иммунитета. Эти лекарства имеют биологическое происхождение, они не токсичны, не вызывают побочных эффектов и угнетения различных функций организма больного, как химиопрепараты. Научной базой для создания такого метода лечения являются открытия в области иммунологии, в частности, у онкологических больных.
Содержание:
- Препараты иммунотерапии в современной онкологии
- Интересные исторические факты иммунотерапии в онкологии
- Механизм воздействия и основные группы препаратов иммунотерапии
- Препараты иммунотерапии для разных видов рака
- Где можно пройти лечение рака иммунопрепаратами
Препараты иммунотерапии в современной онкологии
Установлено, что при злокачественных опухолях в организме пациентов всегда имеет место снижение его защитных свойств, то есть иммунитета. Далее, учеными, исследующими иммунологию рака в крупнейших онкологических центрах мира, было обнаружено, что потенциальные раковые клетки (незрелые клетки различных тканей) ежедневно образуются в больших количествах у каждого человека. Теоретически это создает такую ситуацию, что каждый человек ежедневно рискует заболеть 6-8 видами рака. Но у большинства людей этого не случается по той причине, что постоянно срабатывает иммунная система и обезвреживает эти аномальные клетки, воспринимая их как чужеродные, и рак развивается именно тогда, когда защитная функция организма недостаточна.

Это и легло в основу идеи создания препаратов, которые могли бы естественным образом воздействовать на злокачественные клетки – как профилактически, не давая возможности развиться опухоли, так и с целью воздействия на уже имеющуюся раковую опухоль. Сегодня арсенал таких препаратов довольно широк, и он постоянно пополняется, а применение этих лекарств в клинической практике доказывает их эффективность при лечении различных форм рака у взрослых и у детей.
Более подробную информацию о возможности пройти иммунотерапию рака можно получить на нашем сайте, заполнив форму контакта. В течение суток предоставляется бесплатная консультация ведущего онколога, вся необходимая информация и всесторонняя организационная помощь в прохождении лечения в выбранной клинике.
Закажите бесплатную консультацию
Интересные исторические факты иммунотерапии в онкологии
Препараты иммунотерапии – это новое, перспективное и еще недостаточно изученное направление в онкологии, но корнями своими оно уходит к концу 19-го века. Американский хирург Вильям Коли в 1891 г. обнаружил уникальную закономерность у онкологических больных, переболевших стрептококковой инфекцией (рожистым воспалением, скарлатиной). Спустя время после этих инфекций он отметил обратное развитие, уменьшение опухолей, в частности, саркомы. Это побудило его к созданию первой противораковой вакцины на базе ослабленных возбудителей инфекционных заболеваний. При введении в организм они не вызывали развития инфекции, а лишь стимулировали иммунную систему, и образовавшиеся антитела воздействовали на опухоль. Ученый получил серию хороших результатов в лечении рака, но его метод был подвергнут критике как противоестественный и опасный.
Лишь спустя много лет, в 60-е годы прошлого века, с развитием иммунологии и открытием различных факторов иммунитета (интерлейкина, интерферона, факторов роста и т.д.) положило начало системному созданию и применению иммунопрепаратов в онкологии. А с развитием генетики в 1991 г. был выявлен первый онкоген, кодирующий злокачественный рост. В настоящее время таких мутантных генов уже выявлено множество разновидностей и принадлежность их к развитию того или иного вида опухоли. И сами иммунные препараты уже создаются не методом иммунизации человека или лабораторных животных, а методом генной инженерии (перекодирования генов).
Механизм воздействия и основные группы препаратов иммунотерапии
Все современные препараты иммунотерапии в онкологии по механизму действия разделяются на 3 основных группы:
- Создающие активный специфический иммунитет, это противораковые вакцины, содержащие антиген конкретной опухоли и побуждающие организм вырабатывать специфические антитела против нее.
- Неспецифические иммунопрепараты или иммуномодуляторы, повышающие в целом защитные свойства организма, выработку защитных иммунных тел.
- Моноклональные антитела – принципиально новое направление в иммунотерапии рака, это – создание в лабораторных условиях специфических иммунных белковых тел из одной единственной клетки, то есть это специфическая, точечная или клеточная иммунотерапия рака.
Противораковые вакцины для иммунотерапии
Противоопухолевых вакцин создано множество разновидностей, они делятся по способу получения и действия на следующие подгруппы:
-
 клеточные вакцины, в состав которых входят целые опухолевые клетки (аутологичные – данного пациента или аллогенные – другого пациента с подобным видом рака);
клеточные вакцины, в состав которых входят целые опухолевые клетки (аутологичные – данного пациента или аллогенные – другого пациента с подобным видом рака); - антигенные вакцины, действующим фактором которых является лишь антиген, извлеченный из опухолевых клеток.
В клеточных вакцинах содержатся раковые клетки, ослабленные и лишенные способности к развитию и делению, поэтому они не могут «заразить» пациента раком, а лишь вызывают выработку на них иммунных тел. В состав антигенных вакцин входят не целые раковые клетки, а лишь их различные компоненты: белки, генетический материал (ДНК, РНК). Для их введения используются специальные вирусы-проводники, которые не вызывают заболевания, а лишь способствуют транспортировке антигенов к иммунной системе.
Примерами наиболее используемых в практике вакцин являются Oncophage (Витеспен), Onyvax, Cancer-Vax, NY-ESO-1, ALVAC-CEA, VG-1000, TRICOM, Prostvac и другие. Одни из них являются моновалентными, предназначенными для одного вида рака, другие – поливалентными, которые можно применять для лечения нескольких видов рака. Одни вакцины уже широко применяются в клинической практике, целый ряд новых вакцин проходят клинические испытания, постоянно ведется научный поиск и разработка более эффективных вакцин.
Неспецифические иммунопрепараты в онкологии, адьюванты
Эти препараты оказывают общее стимулирующее действие на иммунную систему, и таким образом усиливают в том числе и противораковый иммунитет. Они обычно применяются как адьюванты – дополнение к другим препаратам для усиления выработки специфического противоопухолевого иммунитета.
Наибольшее применение в онкологии получили следующие препараты:
- иммуномодуляторы – Талидомид, Ревлимид, Ромалист, а также бацилла Кальметта-Герена (BCG), то есть то, что нам известно, как БЦЖ – иммунизация ослабленной микобактерией туберкулеза;
- цитокины – белковые молекулы, влияющие на активность иммунных клеток и их деление: Интерлейкин-2, Интерферон-альфа, Колониестимулирующий фактор, Сарграмостин.
Моноклональные антитела в иммунотерапии
Открытие и создание моноклональных антител совершило революцию в иммунотерапии рака. Они представляют собой иммунные белки, вырабатываемые одной клеткой (клоном), потому обладают специфичным направленным действием именно на подобные клетки.
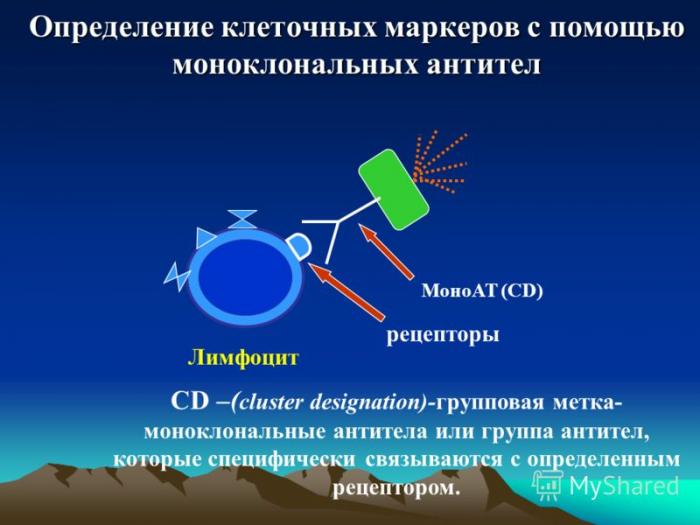
По механизму действия выделяют 2 группы моноклональных антител:
- неконъюгированные – оказывающие самостоятельное воздействие на раковую клетку и «помечающие» опухоль для иммунной системы;
- конъюгированные, или препараты целевого (таргетного) действия, несущие на себе к раковым клеткам молекулы химиопрепарата или же радиоактивные изотопы;
Наиболее широко применяются именно неконъюгированные моноклональные антитела, кроме «указательной» функции они сами воздействуют на клетки рака – угнетают факторы роста, активность ферментов, блокируют ангиогенез (образование новых сосудов в растущей опухоли). Примерами подобных препаратов являются Алемтузумаб для лечения лейкемии за границей, Ритуксимаб для лечения лимфомы, Эрбитукс для лечения рака толстой кишки, Герцептин для лечения рака молочной железы за рубежом, Рамуцирумаб для лечения рака желудка и другие препараты.
Конъюгированные моноклональные антитела – новое направление в комбинированном лечении рака, объединяющее в себе сразу 2 метода: радио- и иммунотерапию и химио- и иммунотерапию. Например, Ибритумомаб (Зевалин), применяемый для лечения лимфомы, Трастузумаб длялечения рака молочной железы.
В настоящее время в США и Европе ведутся работы по созданию поливалентных и гуманизированных моноклональных антител, а также конъюгированных с микроэлементом селеном, повышающим эффективность лечения.
Узнайте точную стоимость лечения
Препараты иммунотерапии для разных видов рака
Препараты иммунотерапии показаны на всех стадиях рака и практически при раке любой локализации. На ранних стадиях рака они сыграют большую роль в предупреждении метастазирования опухоли в лимфоузлы и органы, а также существенно снизят вероятность ее рецидива после лечения, укрепят иммунную систему. На поздних, метастатических стадиях рака они способствуют замедлению развития опухоли и ее распространения, а коньюгированные препараты отыщут вторичные раковые очаги в любом участке организма и проведут таргетное воздействие химиопрепаратом или радиоактивными частицами, непосредственно на клеточном уровне, не повреждая при этом здоровых тканей.
Припараты иммунотерапии при раке легкого
В комплексе лечения рака легких применяются:
- Бевацизумаб (Авастин) – ингибитор ангиогенеза, лишающий опухоль притока крови и приводящий к задержке ее развития, применяется в сочетании с химиопрепаратами, содержащими платину;
- Бавитуксимаб – воздействует на внешнюю белковую защиту раковых клеток и делает их заметными для иммунной системы организма;
- Патритумаб – оказывает блокирующее воздействие на белковый механизм деления раковых клеток, обычно применяется в сочетании с препаратом Эрлотиниб.
Припараты иммунотерапии при раке простаты
Для лечения рака простаты наиболее применяемы следующие препараты:
- Вакцина GVAX – клеточная вакцина, оказывающая блокирующее влияние на рост раковых клеток;
- Вакцина PROSTVAC – изготовлена на основе опухолевого антигена PSA и содержит вирусный «проводник» (из ослабленного вируса оспы кур);
- Вакцина Прованж (Provenge) – терапевтическая клеточная вакцина, изготавливаемая для каждого пациента индивидуально в специальной лаборатории;
- Вакцина ProstAtak – конъюгированная вакцина; содержащая молекулы цитостатика Валацикловира и вирусный проводник для доставки препарата непосредственно раковым клеткам;
- Ипилимумаб (Yervoy) – моноклональное антитело, активизрующее цитотоксическое действие Т-лимфоцитов и повышающее иммунный ответ за счет обнаружения раковых клеток.
Припараты иммунотерапии при раке молочной железы
При раке молочной железы, в основном, применяются вакцины и моноклональные антитела:
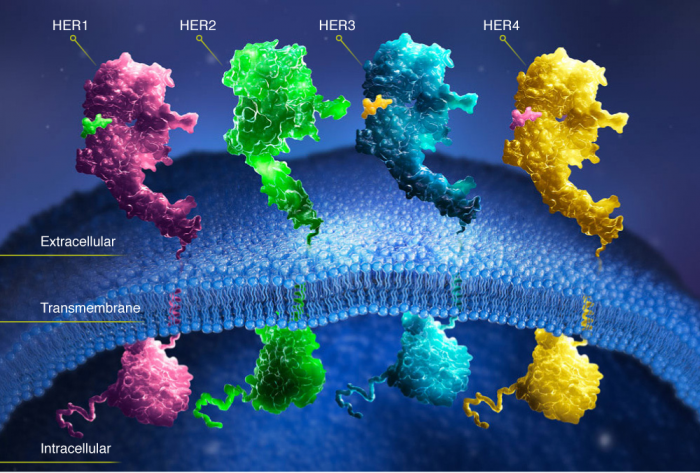
- Герцептин – содержит моноклональные антитела, блокирущие белок HER-2 в раковых клетках, тем самым препятствующие их росту и развитию;
- Вакцина Neuvenge – эффективна при наиболее агрессивном HER-2 позитивном раке груди;
- Вакцина РЕСАН (создана в Беларуси) – включает более 40 разновидностей антигенов опухоли, создает клеточный противораковый иммунитет с формированием «памяти» иммунитета, что значительно снижает число рецидивов рака;
- Тайкерб (Лапатиниб) – оказывает действие, подобное Герцептину, но имеет более широкий спектр эффективности, и применяется в сочетании с Кселодой, когда Герцептин оказывается малоэффективным.
Припараты иммунотерапии при раке желудка
Для лечения рака желудка в комплексе с химиотерапией применяются следующие иммунные препараты:
- Иматиниб (Тайверб) – моноклональное антитело, блокирующее рецепторы роста раковой клетки;
- Бортезомиб (Велкейд) – ингибитор белкового обмена в раковых клетках, повреждает структуру ДНК, повышает чувствительность опухоли к химиотерапевтическим препаратам;
- Эверолимус – препарат применяется как ингибитор иммунитета при пересадке органов, но обнаружено его сильное угнетающее действие на раковые клетки путем блокирования фермента АТФ.
Припараты иммунотерапии меланомы
Одна из самых злокачественных опухолей – меланома, устойчивая ко многим химиопрепаратам, оказалась более «податливой» к воздействию иммунотерапии:
- Ниволумаб – является моноклональным антителом таргетного действия, блокирует рост опухолевых клеток;
- Пембролизумаб (Кейтруда) – моноклональное антитело, блокирует защитный белок PD-1 меланомных клеток, делая их заметными для иммунной системы.
Большой опыт применения подобных препаратов накоплен в лечении рака в Израиле, где эффективность терапии меланомы является самой вкоысой.
Проконсультируйтесь с врачом Online
Где можно пройти лечение рака иммунопрепаратами
Иммунотерапия рака за границей – новый и пока еще дорогостоящий метод лечения рака, тем более, что большинство современных препаратов выпускаются западными фармацевтическими кампаниями. Поэтому, если ваш выбор падает на отечественной онкологии, то такое лечение можно пройти в столицах России, Украины, Казахстана, Беларуси.
Если же вы можете позволить себе лечение за границей, то во всех онкологических центрах развитых стран оно доступно на самом высоком уровне, а цены на лечение рака за рубежом более демократичными будут в клиниках Израиля. Более подробно узнайте обо всем через контактную форму на сайте.
Источник
