Деструкция бета клеток поджелудочной железы

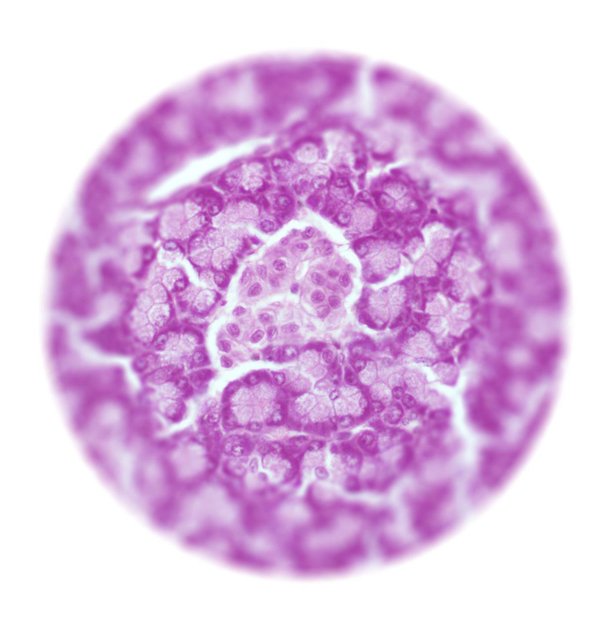 Островок Лангерганса под микроскопом
Островок Лангерганса под микроскопом1. Что такое островки Лангерганса?
В хвосте поджелудочной железы человека, словно островки в океане, разбросаны крошечные скопления особых клеток. Эти скопления и выглядят как островки, и названы так — островки Лангерганса, по имени берлинского врача, рассмотревшего их под микроскопом полтора века назад. По слогам: Лан-гер-гáнс.
Общая масса островков Лангерганса — около грамма, но это важнейший эндокринный орган, секретирующий пять жизненно необходимых гормонов, среди которых — инсулин. Insula, в переводе с латыни, означает «остров»; молекулы инсулина можно вообразить как островитян с тех самых островков Лангерганса.
Отправляясь в путь по организму, «островитяне» эти с Божественной точностью регулируют концентрацию глюкозы в крови, а глюкоза питает клетки тканей; она — основной источник энергии всех живых существ на Земле. Без инсулина глюкоза не будет усвоена, а не будучи усвоенной, в излишке, станет ядом.
2. Что происходит, когда инсулина нет
Инсулин отворяет клеточные мембраны, глюкоза проникает в клетки и потребляется ими, её уровень в крови снижается до нормы. При недостатке же инсулина мембраны прикрыты, ткани голодают, а неиспользованная глюкоза в крови собирается до критического уровня и, вместе с образующимся ацетоном, разрушает организм.
Представьте себе, что островки Лангерганса вдруг стали необитаемыми. Бета-клетки, продуцирующие инсулин, почему-то погибли, «островитян» не стало. Это смертельная ситуация, у больного есть несколько дней, возможно, неделя. Но около 20 тыс. человек в Беларуси и до 20 млн. в мире держатся годами. Как?
Оказывается, если нет своего инсулина, можно вколоть чужой. Но сколько? Введёшь мало → гипергликемия → нарастающий подрыв нервов и сосудов, повреждение зрения, почечная недостаточность; введёшь много или промажешь, уколóв вместо подкожной прослойки в мышцу → стремительная гипогликемия, кома…
Гипергликемия — избыток глюкозы в крови; гипогликемия — её недостаток. Оба состояния потенциально летальны. Между ними — норма — жизнь продолжается. Помните типичный, стрессующий зрителя, момент в фильмах, когда герой, обезвреживая мину, должен выбрать между двумя проводами — красным и синим?
Человек, у которого отказали островки Лангерганса, перманентно, днём и ночью, пребывает в таком стрессе — ошибиться нельзя! Но если герой в фильме, выбирая провод, просто гадает и ему везёт, то наш герой, дозируя инсулин, должен не гадать, а быстро (счёт на минуты) решать уравнения с несколькими переменными.
Многие из нас, зевая на уроках математики, думали: вряд ли это мне когда-то пригодится. А кому-то, вот, математика не просто пригодилась, а стала необходима, чтобы не умереть. И зевать не получится. И урок не прогулять. И «двойка в журнал» равнозначна приговору. Всегда у доски. Считай, считай… Чтобы жить.
3. Сложности контроля

Проблема ещё в том, что почти все заболевшие — дети. За них считают родители. Несколько дней могут посчитать врачи — больше не положено, учись сам. Какие-то моменты можно облегчить с помощью приложений/программ, приборов и систем, если хватает средств на их покупку (об этом ниже).
Божественная точность здорового углеводного обмена — не преувеличение. Наука, имея в распоряжении суперкомпьютеры, искусственный интеллект, миллиардные бюджеты, пока не может воспроизвести естественные алгоритмы подачи инсулина. Имеющиеся знания — уровень спасающего костыля.
Инсулин — самый исследованный гормон. Инсулинотерапии скоро 100 лет. Однако без подсчётов «вручную» всё ещё не обойтись. Говорят, есть уже квантовый телефон. Но нет пока гаджета, который повторил бы автоматически инсулин-продуцирующую функцию поджелудочной железы. А что же есть?
4. Технологии контроля и компенсации
Из продвинутого и дорогого:
1) системы непрерывного мониторинга уровня глюкозы с подкожным сенсором;
2) системы подачи инсулина частыми микродозами с подкожным катетером;
3) прототипы, интегрирующие обе системы под претенциозным и некорректным названием «искуственная поджелудочная железа».
Из доступного:
1) глюкометры с тест-полосками и ланцетами для забора крови;
2) обычные шприцы и слегка упрощающие инъекцию шприцы-ручки с ампулами инсулина.
Поёживаетесь, думая об анализе крови из пальца и об уколах в живот? А для кого-то это обыденность, многократный в течение суток ритуал.
Пальцы прокалывать приходится часто: перед каждым приёмом пищи и после, на ночь, ночью — выходит раз 10. Это минимум, если «сахарá» «послушные». Но при физических и умственных нагрузках, в пубертате и при простуде расход глюкозы предсказать трудно, поэтому количество замеров может удвоиться.
5.Почему людей с диабетом называют “сладкими”?
10 анализов в сутки, 20… Исколотые подушечки постепенно теряют чувствительность. «Сладкие» люди говорят, что уже не больно. Инъекции — больнее, но терпимо. Потерпеть надо 6-8 раз в сутки. Подкожная жировая клетчатка в местах травмирования может грубеть, деформироваться, это называется липодистрофией.
Почему эти люди «сладкие»? Потому что болезнь их по симптому — повышенному «сахару» в крови и моче — называется сахарным диабетом или, с латыни — диабетом медовым (diabetes mellītus). «Диабайно» — греческое слово, означает «протекаю», «прохожу сквозь». Что имели ввиду греки?
Согласно древним представлениям, сквозь диабетика без задержки протекала любая жидкость. Сколько бы он ни выпил — всё тут же выходило с мочой (полиурия), несчастного изнуряла неутолимая жажда. Если моча была сладкой — диабет сахарный, несладкой — несахарный (например, несахарный почечный).

6. Сколько у диабета обличий?
Несахарных диабетов — пять. Сахарных — тоже пять, они собраны в два типа: 1-го типа (T1D) — разрушены β-клетки поджелудочной железы, не продуцируется инсулин; 2-го типа (T2D) — инсулин продуцируется, но мембраны клеток в тканях воспринимают его ограниченно, сопротивляются (инсулинорезистентность).
Сахарный диабет 2-го типа ассоциирован с ожирением, злоупотреблением рафинированными продуктами, малоподвижным образом жизни; его называют бичом современности. А бичом для диабетиков 1-го типа является перенос на них представлений о причинах возникновения заболевания с диабетиков 2-го типа.
Между тем, природа T1D и T2D крайне разная. T1D — заболевание аутоимунное с преимущественно неясной этиологией, неизвестно, как его избегать; T2D — заболевание метаболическое с в основном понятной этиологией, как его избегать — известно.
7. Почему инсулинопродуцирующие клетки гибнут?
Почему же гибнут инсулоциты (β-клетки) в островках Лангерганса? Их, «сойдя с ума», атакует иммунная система. С высокой вероятностью, триггерами этого сбоя, на фоне генетической предрасположенности, являются факторы окружающей среды: вирусы, токсины. Отмечена статистическая связь T1D с питанием грудных детей продуктами из коровьего молока.
Обобщение T1D и T2D в бытовом восприятии — досаждающая проблема для людей с T1D, ведь T2D — обычно, болезнь образа жизни, её профилактика — здоровое питание/ЗОЖ. А профилактики T1D не существует, это фатальное стечение неразгаданных причин.
Приходится терпеть негативные намёки, укоры, объяснять и даже оправдываться.
Можно ли предотвратить T1D? Скорее нет, чем да. Аутоимунные болезни запускаются в неизвестный момент неизвестной комбинацией нескольких «кнопок»: например, «стресс + грипп + молоко», «токсин + наследственность + антибиотик», «вакцина + витамины + беременность» и другие гипотетические варианты.
Обойдя защиту, «хакер» может и не вскрыться, а затаиться на годы, перейти потомству. Больные и их близкие, озираясь назад, отматывая события, вдумываясь, копаясь в происшедшем, предполагают, догадываться о чём-то, но их выводы, как и гипотезы исследователей, просто подвергнуть сомнению.
Однако известны агенты, которые, попав в организм, точно разрушат β-клетки и вызовут T1D. Например, лекарственные препараты стрептозоцин, пентамидин, крысиные яды пиринурон, пириминил, вакор. Их опасность доказана, но производство и использование в некоторых странах продолжается!
Можно ли излечить T1D? Нет. Бета-клетки в островках Лангерганса не воскресить. Но чем качественнее компенсация инсулином извне, тем дольше можно протянуть. Медаль «Victory» вручается прожившим с диагнозом 50 лет (4 тыс. человек в мире), 75 лет (65 человек), 80 лет (один человек).
Источник
Два недавно опубликованных исследования, проведенные учеными Калифорнийского университета в Сан-Франциско (University of California, San Francisco, UCSF), проливают новый свет на природу бета-клеток – инсулин-продуцирующих клеток поджелудочной железы, страдающих при диабете.
 (Фото: livescience.com)
(Фото: livescience.com)
Авторы первого исследования предполагают, что некоторые случаи диабета могут быть обусловлены тем, что бета-клетки лишаются кислорода, что побуждает их вернуться в менее зрелое состояние с вытекающим отсюда последствием – потерей способности вырабатывать инсулин. Второе исследование показывает, что не вырабатывающие инсулина клетки поджелудочной железы – ациноциты – можно трансформировать в функциональные бета-клетки – потенциально новая стратегия лечения диабета.
В первом исследовании, опубликованном в журнале Genes & Development, директор Центра диабета UCSF Маттиас Хеброк (Matthias Hebrok), PhD, и научный сотрудник его лаборатории Сапна Пури (Sapna Puri), PhD, удалили из бета-клеток мышей ген VHL. Синтез инсулина в этих клеток резко сократился, и со временем у мышей развился физиологический эквивалент сахарного диабета 2 типа. Вместе с Пури и Хеброком в этом исследовании принимал участие Харухико Акияма (Haruhiko Akiyama), MD, PhD, из Университета Киото (Kyoto University), который предоставил для экспериментов мышей с моделью диабета, развивающегося у худощавых людей.
Считается, что сахарный диабет 2 типа, развивающийся, как правило, в зрелом возрасте, (но все чаще встречающийся и у детей), является результатом резистентности тканей к действию инсулина, вследствие чего у больных повышается уровень сахара в крови. В отличие от диабета 2 типа диагностируемый в детстве диабет 1 типа – аутоиммунное заболевание, при котором бета-клетки поджелудочной железы атакуются и повреждаются собственной иммунной системой больного.
Большинство научных работ, посвященных диабету 2 типа, сфокусировано на резистентности к инсулину, но доктор Хеброк и его коллеги считают, что во многих случаях, например, в подгруппе худощавых взрослых пациентов, одним из факторов возникновения заболевания может быть постепенное, развивающееся в течение длительного периода времени ослабление функции бета-клеток.
«У некоторых людей с высоким индексом массы тела бета-клетки хорошо справляются со своей функцией, в то время как у некоторых стройных – бета-клетки неэффективны», – поясняет доктор Хеброк.
В период развития поджелудочной железы изменения в экспрессии генов вызывают дифференциацию некоторых клеток в бета-клетки, но изученные исследователями лишенные гена VHL бета-клетки дедифференцировались. В них не было важнейших белков, всегда присутствующих в зрелых функциональных бета-клетках, и, наоборот, в этих клетках активно экспрессировался белок Sox9, вырабатывающийся в бета-клетках только до их полного созревания.
«Уровни маркеров зрелых клеток в этих клетках были понижены, а уровни маркеров, которых не должно было быть, повышены», – комментирует Хеброк.
Белок VHL – один из важнейших клеточных сенсоров кислорода. В условиях с низким содержанием кислорода VHL активирует внутриклеточные молекулярные пути, вызывающие компенсаторные метаболические изменения, направленные на защиту клетки. Если эти метаболические корректировки не достигают успеха, альтернативные пути подталкивают клетку к самоуничтожению.
Избирательно удалив VHL из бета-клеток, ученые имитировали условия недостатка кислорода только в одном типе клеток.
«Мы заставили бета-клетки «поверить», что они находятся в состоянии гипоксии, фактически не уменьшая количества кислорода», – продолжает Хеброк.
Даже незначительное увеличение массы тела у лиц с некоторым нарушением функции бета-клеток может повысить требования по выработке инсулина до точки, в которой эти требования начинают превышать возможности клеток.
«Бета-клетка – очень сложная клетка, вырабатывающая огромное количество инсулина жестко регулируемым образом. Лишение ее кислорода превращает «Порше» в «Вольксваген Жук» – высокооктановый гоночный автомобиль в автомобиль, который вы теперь должны заправлять бензином с низким октановым числом. Он все еще сможет доехать из пункта А в пункт Б, но не сможет сделать это так, как надо», – проводит аналогию доктор Хеброк.
Он считает, что многие случаи диабета являются результатом неуклонного, развивающегося в течение длительного времени ослабления функции уже поврежденных бета-клеток, вынужденных справляться с повышающейся потребностью в инсулине.
«То, что мы здесь показываем, – другой взгляд на процесс развития диабета», – поясняет ученый.
По его мнению, цепочку событий нельзя представить следующим образом: вы здоровы – затем у вас предиабет – затем у вас диабет – затем ваши бета-клетки погибают. Скорее это плавное снижение, где функция бета-клеток сходит на нет с течением времени.
Между тем, ученым, опубликовавшим свою статью в журнале Nature Biotechnology, удалось восстановить нормальные уровни инсулина и глюкозы у мышей, не имевших функциональных бета-клеток, путем трансформации других клеток поджелудочной железы в клетки, близкие к бета-клеткам.
Сначала исследователи ввели мышам токсин, специфически поражающий бета-клетки, что вызвало у них симптомы диабета. Спустя пять недель этим мышам имплантировали миниатюрные помпы, непрерывно в течение семи дней вводившие животным две сигнальные молекулы, известные как цитокины.
Введение этих двух цитокинов – эпидермального фактора роста и цилиарного нейротрофического фактора – восстановило у мышей нормальные уровни глюкозы и инсулина. Адекватный контроль над сахаром в крови сохранялся у животных в течение восьми месяцев – до момента завершения исследования.
Дальнейшие эксперименты показали, что введение цитокинов оказывало действие за счет «перепрограммирования» ациноцитов – клеток поджелудочной железы, которые в норме секретируют пищеварительные ферменты, а не инсулин, – заставляя их приобретать свойства бета-клеток, включая чувствительность к глюкозе и способность секретировать гормон для ее усвоения.
В предыдущих работах уже было показано, что определенные факторы транскрипции, доставляемые вирусами, могут перепрограммировать ацинарные клетки мышей, но это исследование представляет первое доказательство того, что перепрограммирование ациноцитов в бета-клетки возможно провести в организме живого животного фармакологическим путем. Поскольку вирусная доставка сложна и рискованна, новый подход представляет собой перспективную стратегию терапии диабета 1 типа и диабета 2 типа с дисфункцией бета-клеток.
«Фармакотерапия, создающая новые бета-клетки, очень помогла бы пациентам с диабетом 1 типа при условии, что сегодняшние открытия, сделанные на мышиных моделях, могут быть использованы для выявления поддающихся воздействию лекарственных препаратов мишеней в поджелудочной железе человека, и при условии, что нам удастся остановить постоянно идущее аутоиммунное разрушение бета-клеток», – говорит первый автор статьи Люк Байенс (Luc Baeyens), постдокторант лаборатории Майкла Джёмана (Michael German), MD, заместителя директора Центра диабета UCSF. «В краткосрочной перспективе эта модель может служить платформой для выявления и изучения новых соединений с терапевтическим потенциалом. В долгосрочной перспективе, несмотря на эти обнадеживающие результаты, мы пока еще очень далеки от использования выводов нашей работы в клинической практике».
Оригинальные статьи
VHL-mediated disruption of Sox9 activity compromises β-cell identity and results in diabetes mellitus
Transient cytokine treatment induces acinar cell reprogramming and regenerates functional beta cell mass in diabetic mice
Источник
[13-116]
Антитела к антигенам клеток поджелудочной железы (GAD/IA-2), IgG
Аутоантитела к глутаматдекарбоксилазе и тирозинфосфатазе бета-клеток поджелудочной железы, которые играют важную роль в патогенезе инсулинзависимого сахарного диабета и являются прогностическими маркерами развития сахарного диабета 1-го типа и потребности в введении инсулина.
Синонимы русские
Антитела к островкам поджелудочной железы (анти-GAD/IA2) класса IgG, аутоантитела к панкреатическим бета-клеткам, антитела к глутаматдекарбоксилазе (ГДК) и тирозинфосфатазе (ТФ).
Синонимы английские
Anti-GAD/IA2 antibody pool, Glutamic Acid Decarboxylase-65 (GAD) and Insulinoma Antigen 2 (Tyrosine Phosphatase, IA2, ICA-512) Autoantibodies.
Метод исследования
Иммуноферментный анализ (ИФА).
Единицы измерения
МЕ/мл (международная единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Сахарный диабет 1-го типа (СД-1, инсулинзависимый) – хроническое эндокринное заболевание, обусловленное аутоиммунной деструкцией бета-клеток островковой ткани поджелудочной железы, которое приводит к абсолютному дефициту инсулина и повышению уровня сахара в крови. Нарушения углеводного обмена и клинические проявления сахарного диабета возникают при разрушении более 80 % бета-клеток. Заболевание обычно выявляется в детском и подростковом возрасте.
Для сахарного диабета 1-го типа характерно наличие аутоантител, которые имеют непосредственное патогенетическое значение в разрушении инсулинпродуцирующих клеток и развитии заболевания. Схожий механизм развития и спектр антител выявляется при аутоиммунном диабете взрослых (LADA), который в последнее время рассматривается как вариант более поздно возникшего сахарного диабета 1-го типа, однако часто диагностируется как сахарный диабет 2-го типа в связи с возрастными особенностями.
Проявлениям диабета в течение нескольких лет предшествует повышение уровня аутоантител в крови, что является ранним признаком аутоиммунной активности болезни. К таким антителам относятся аутоантитела к глутаматдекарбоксилазе (GAD), тирозинфосфатазе белков (IA2), инсулину, цитоплазматическим компонентам островковых клеток.
Глутаматдекарбоксилаза (ГДК, GAD) – белок с молекулярной массой 65 кДа, который участвует в синтезе тормозного нейромедиатора ЦНС – гамма-аминомасляной кислоты (ГАМК). GAD экспрессируется в центральной и периферической нервных системах, в островках поджелудочной железы, яичках, яичниках, вилочковой железе и желудке. С этим антигеном реагируют сыворотки 70-80 % лиц с преддиабетом и недавно диагностированным сахарным диабетом 1-го типа.
Тирозинфосфатаза (IA-2) – аутоантиген островковых клеток, локализованный в плотных гранулах панкреатических бета-клеток. Антитела к ней выявляются у 50-75 % пациентов с сахарным диабетом 1-го типа, а также до первых клинических проявлений. По некоторым данным, IA-2 вместе с антителами к инсулину встречаются чаще у детей, чем у взрослых пациентов, и указывают на агрессивную деструкцию бета-клеток.
С течением заболевания уровень аутоантител в крови постепенно снижается, что связано с разрушением антигенного субстрата. В связи с этим у пациентов, длительно болеющих сахарным диабетом 1-го типа, определение аутоантител может обладать невысокой диагностической ценностью.
Уровень антител к GAD, IA-2, инсулину (IAA) и антигенам цитоплазматических компонентов островковых клеток (IСА) имеет большое значение для диагностики и прогнозирования диабета 1-го типа у ближайших родственников пациентов, страдающих диабетом. Предвестником СД-1 можно считать скорее сам факт выявления антител, чем определение какого-то их отдельного вида. Некоторые исследования показали, что именно наличие аутоантител к GAD и IA-2, а не фенотипические характеристики в большей степени определяют вероятность потребности в инсулинотерапии. Присутствие нескольких аутоантител значительно увеличивает риск развития заболевания в будущем по сравнению с изолированным повышением одного из видов антител.
Разработаны тест-системы как для комплексного определения аутоантител, так и для выявления их отдельных видов. Чувствительность совместного измерения уровней анти-GAD/IA-2 для диагностики сахарного диабета 1-го типа составляет 96 %, специфичность – 98 %. Антитела выявляются в среднем у 73 % пациентов с недавно диагностированным СД-1, у 95 % больных диабетом менее 5 лет и у 84 % людей, болеющих более 5 лет.
Выявление предрасположенности к развитию сахарного диабета и ранняя диагностика заболевания позволяют своевременно применить профилактические мероприятия, назначить адекватное лечение и предупредить прогрессирование болезни и развитие осложнений.
Для чего используется исследование?
- Для ранней диагностики аутоиммунного сахарного диабета (СД 1-го типа),
- для дифференциальной диагностики аутоиммунного диабета взрослых (LADA) и сахарного диабета 2-го типа,
- для диагностики преддиабета,
- для выявления предрасположенности и оценки риска развития сахарного диабета 1-го типа,
- для прогнозирования потребности в инсулинотерапии у больных сахарным диабетом.
Когда назначается исследование?
- При обследовании детей и взрослых с высоким риском развития сахарного диабета (чьи близкие родственники больны СД-1),
- при обследовании людей с гипергликемией или нарушением толерантности к глюкозе.
Что означают результаты?
Референсные значения: 0 – 4 МЕ/мл.
Причины повышения уровня антител GAD/IA2:
- преддиабет,
- сахарный диабет 1-го типа (инсулинзависимый сахарный диабет) на ранних стадиях развития,
- аутоиммунный диабет взрослых (LADA),
- гестационный диабет (диабет беременных).
Что может влиять на результат?
При некоторых системных заболеваниях соединительной ткани (например, системной красной волчанке) и болезнях щитовидной железы уровень антител GAD/IA2 может повышаться.
Важные замечания
- Антитела к глутаматдекарбоксилазе выявляются у 8 % здоровых людей.
- Необходимо помнить, что уровень аутоантител значительно снижается на более поздних стадиях заболевания в связи с разрушением бета-клеток.
Также рекомендуется
- Антитела к инсулину
- Антитела к островковым клеткам поджелудочной железы
- Глюкоза в плазме
- Глюкоза в моче
- Глюкозотолерантный тест
- Гликированный гемоглобин (HbA1c)
- Генетический риск развития гипергликемии
- С-пептид в сыворотке
- С-пептид в суточной моче
- Инсулин
Кто назначает исследование?
Эндокринолог, терапевт, педиатр, врач общей практики.
Литература
- Шаповальянц О. С., Никонова Т. В. Диагностическая и прогностическая значимость аутоантител при сахарном диабете. Новый маркер аутоиммунного процесса – антитела к ZnT8// Сахарный диабет – 2011. – № 2. – С. 18-21.
- Pozzilli P. and Mario U. Autoimmune diabetes not requiring insulin at diagnosis (latent autoimmune diabetes of the adult). Definition, characterization, and potential prevention.// Diabetes Саге. – 2001. – Vol. 24, № 8. – P. 1460-1467.
- Verge C. F., Stenger D., et al. Combined use of autoantibodies (IA-2 autoantibody, GAD autoantibody, insulin autoantibody, cytoplasmic islet cell antibodies) in type 1 diabetes: Combinatorial Islet Autoantibody Workshop // Diabetes – December 1998 -vol. 47, no. 12. – P. 1857-1866.
Источник
