Стимуляторы поджелудочной железы инсулин
Данный класс препаратов практически нигде в отечественной литературе не рассматривался. Хотя он пользуется достаточной популярностью среди западных культуристов. Поэтому применение всех этих препаратов происходит в полных научных потемках, что сильно повышает риск возможных побочных эффектов. Популярность данных препаратов объясняется тем, что хотя они теоретически и могут привести в состояние сильной гипогликемии, но на практике это гораздо менее вероятно по сравнению с Инсулином, хотя эффективность их чрезвчайно высока. Этот вид препаратов применяют как женщины, так и мужчины.
Класс сильфонил-карбомидов. Действующее вещество: глибекламид. Торговые названия: Ацетогексамид, Букарбан, Бутамид, Глипизид, Диабинес, Карбутамид, Катамил, Манинил, Надисан, Оранил, Придиан, Талбутамид, Толазамид, Хлорпропамид.
Класс биргуанидов. Действующее вещество: 1-бутилбигуанида-гидрохлорид. Торговые названия: Адебит, Буформид, Глибутид, Метморфин, Силубин, Фенформин.
В бодибилдинге данные препараты используются с двумя целями: во-первых, для усиления выброса собственного Инсулина, а также для лучшей усваиваемости его, что является наиболее безопасной формой использования данного класса препаратов; во-вторых, для усиления воздействия Инсулина, вводимого извне. Доказано, что в этом случае сила воздействия Инсулина может вырасти в 1,5–2 раза.
В медицинской практике данный класс препаратов применяется для стимуляции поджелудочной железы и назначается при всех видах сахарного диабета. Но особенно при втором его варианте, т.е. когда производство собственного Инсулина еще не полностью прекратилось, но одного лечения с помощью диеты недостаточно.
В России, в основном, распространено применение двух препаратов: Адебита и Манинила. Наиболее популярным препаратом является Адебит Поскольку он является более мягким средством по сравнению с Манинилом.
Тех, кто применяет все эти препараты, можно условно разбить на две группы: первые – это те атлеты, которые бояться применять чистый Инсулин, но все же хотели получить преимущества, которые он дает в виде усиленного анаболизма (см.Инсулин). Второй группой атлетов являются те, кто применяют Инсулин и хотят максимально усилить его воздействие.
Надо отметить, что применение Инсулина и препаратов, стимулирующих поджелудочную железу, обычно происходит на фоне приема анаболически-андрогенных стероидов, т.е. Действие Инсулина и без того усилено, а когда еще дополнительно добавляют Адебит, то воздействие усиливается в 2,5 – 5 раз. В период приема комбинации «Инсулин-Адебит» атлет должен как никогда следить за уровнем сахара. Это связано с тем, что опасность возникновения гипогликемии чрезвычайно высока, и спортсмен обязан всегда при себе иметь что-то сладкое, например, плитку шоколада.
Также Адебит очень часто применяется атлетами во время курса Гормона роста Для того, чтобы усилить эффективность Инсулина, который, в свою очередь, усилит действие Гормона роста.
Иногда практикуется прием Адебита между циклами, когда атлет не применяет стероиды и Гормон роста, но хочет иметь высокий уровень анаболизма. Необходимо обратить особое внимание на тот факт, что препараты, которые предназначены для стимуляции поджелудочной железы, хотя и обладают своим набором побочных эффектов, но все намного безопаснее чистого Инсулина. А эффект, которого можно добиться, иногда не уступает по силе Инсулину
Но без видимого эффекта привыкания и последующего снижения выработки собственного Инсулина. К тому же некоторые атлеты комбинируют прием Адебита и Манинила, а данная комбинация по своему гипогликемическому и анаболическому действию мало чем уступает непосредственным инъекциям чистого Инсулина. Достаточно часто Адебит применяется в комбинации с Кленбутеролом в конце курса для того, чтобы сохранить анаболизм на максимально высоком уровне. Это связано с тем фактом, что одной из причин падения уровня анаболизма после отмены стероидных препаратов является так назваемый «инсулинорезистентный эффект» (состояние, когда выработка Инсулина сокращается в несколько раз). В результате этого происходит ухудшение углеводного обмена и значительно увеличивается выработка кортизола, уровень которого и без того повышен в конце «курса». В большинстве случаев эту проблему удается решить приемом Адебита.
Дозы, применяемые в бодибилдинге, колеблются от 50 до 150 мг в сутки и разбиваются на два приема, которые принимаются утром и вечером после еды. Дозировка препарата, как и в случае с Инсулином, подбирается индивидуально, в зависимости от реакции организма на него.
Что же касается побочных эффектов, то они могут проявиться в виде тошноты, потери аппетита, поноса, металлического вкуса во рту. Вообще же при правильном применении этого класса препаратов побочные эффекты проявляются крайне редко.
Источник
Строение
Инсулин представляет собой белок, состоящий из двух пептидных цепей А (21 аминокислота) и В (30 аминокислот), связанных между собой дисульфидными мостиками. Всего в зрелом инсулине человека присутствует 51 аминокислота и его молекулярная масса равна 5,7 кДа.
Синтез
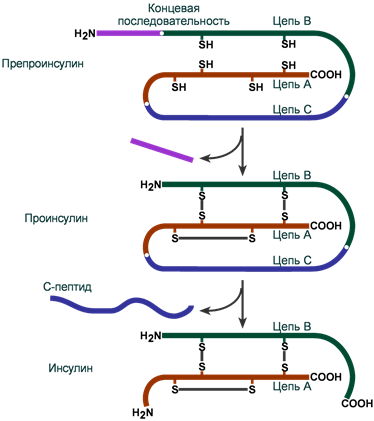
Инсулин синтезируется в β-клетках поджелудочной железы в виде препроинсулина, на N-конце которого находится концевая сигнальная последовательность из 23 аминокислот, служащая проводником всей молекулы в полость эндоплазматической сети. Здесь концевая последовательность сразу отщепляется и проинсулин транспортируется в аппарат Гольджи.
На данном этапе в молекуле проинсулина присутствуют А-цепь, В-цепь и С-пептид (англ. connecting – связующий). В аппарате Гольджи проинсулин упаковывается в секреторные гранулы вместе с ферментами, необходимыми для “созревания” гормона . По мере перемещения гранул к плазматической мембране образуются дисульфидные мостики, вырезается связующий С-пептид (31 аминокислота) и формируется готовая молекула инсулина. В готовых гранулах инсулин находится в кристаллическом состоянии в виде гексамера, образуемого с участием двух ионов Zn2+.

Схема синтеза инсулина
Около 15% молекул проинсулина поступает в кровоток. Проинсулин обладает более слабой активностью (около 1:10), но большим периодом полувыведения (около 3:1), по сравнению с инсулином. Поэтому повышение его уровня может вызывать гипогликемические состояния, что наблюдается при инсулиномах.
Регуляция синтеза и секреции
Секреция инсулина происходит постоянно, и около 50% инсулина, высвобождаемого из β-клеток, никак не связано с приемом пищи или иными влияниями. В течение суток поджелудочная железа выделяет примерно 1/5 от запасов имеющегося в ней инсулина.
Главным стимулятором секреции инсулина является повышение концентрации глюкозы в крови выше 5,5 ммоль/л, максимума секреция достигает при 17-28 ммоль/л. Особенностью этой стимуляции является двухфазное усиление секреции инсулина:
- первая фаза длится 5-10 минут и концентрация гормона может 10-кратно возрастать, после чего его количество понижается,
- вторая фаза начинается примерно через 15 минут от начала гипергликемии и продолжается на протяжении всего ее периода, приводя к увеличению уровня гормона в 15-25 раз.
Чем дольше в крови сохраняется высокая концентрация глюкозы, тем большее число β-клеток подключается к секреции инсулина.
Индукция синтеза инсулина происходит от момента проникновения глюкозы в клетку до трансляции инсулиновой мРНК. Она регулируется повышением транскрипции гена инсулина, повышением стабильности инсулиновой мРНК и увеличением трансляции инсулиновой мРНК.
Активация секреции инсулина
1. После проникновения глюкозы в β-клетки (через ГлюТ-1 и ГлюТ-2) она фосфорилируется гексокиназой IV (глюкокиназа, обладает низким сродством к глюкозе),
2. Далее глюкоза аэробно окисляется, при этом скорость окисления глюкозы линейно зависит от ее количества,
3. В результате нарабатывается АТФ, количество которого также прямо зависит от концентрации глюкозы в крови,
4. Накопление АТФ стимулирует закрытие ионных K+-каналов, что приводит к деполяризации мембраны,
5. Деполяризация мембраны приводит к открытию потенциал-зависимых Ca2+-каналов и притоку ионов Ca2+ в клетку,
6. Поступающие ионы Ca2+ активируют фосфолипазу C и запускают кальций-фосфолипидный механизм проведения сигнала с образованием ДАГ и инозитол-трифосфата (ИФ3),
7. Появление ИФ3 в цитозоле открывает Ca2+-каналы в эндоплазматической сети, что ускоряет накопление ионов Ca2+ в цитозоле,
8. Резкое увеличение концентрации в клетке ионов Ca2+ приводит к перемещению секреторных гранул к плазматической мембране, их слиянию с ней и экзоцитозу кристаллов зрелого инсулина наружу,
9. Далее происходит распад кристаллов, отделение ионов Zn2+ и выход молекул активного инсулина в кровоток.
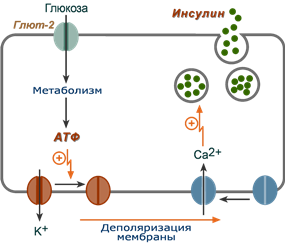
Схема внутриклеточной регуляции секреции инсулина при участии глюкозы
Описанный ведущий механизм может корректироваться в ту или иную сторону под действием ряда других факторов, таких как аминокислоты, жирные кислоты, гормоны ЖКТ и другие гормоны, нервная регуляция.
Из аминокислот на секрецию гормона наиболее значительно влияют лизин и аргинин. Но сами по себе они почти не стимулируют секрецию, их эффект зависит от наличия гипергликемии, т.е. аминокислоты только потенциируют действие глюкозы.
Свободные жирные кислоты также являются факторами, стимулирующими секрецию инсулина, но тоже только в присутствии глюкозы.
Логичной является положительная чувствительность секреции инсулина к действию гормонов желудочно-кишечного тракта – инкретинов (энтероглюкагона и глюкозозависимого инсулинотропного полипептида), холецистокинина, секретина, гастрина, желудочного ингибирующего полипептида.
Клинически важным и в какой-то мере опасным является усиление секреции инсулина при длительном воздействии соматотропного гормона, АКТГ и глюкокортикоидов, эстрогенов, прогестинов. При этом возрастает риск истощения β-клеток, уменьшение синтеза инсулина и возникновение инсулинзависимого сахарного диабета. Такое может наблюдаться при использовании указанных гормонов в терапии или при патологиях, связанных с их гиперфункцией.
Нервная регуляция β-клеток поджелудочной железы включает адренергическую и холинергическую регуляцию. Любые стрессы (эмоциональные и/или физические нагрузки, гипоксия, переохлаждение, травмы, ожоги) повышают активность симпатической нервной системы и подавляют секрецию инсулина за счет активации α2-адренорецепторов. С другой стороны, стимуляция β2-адренорецепторов приводит к усилению секреции.
Также выделение инсулина повышается n.vagus, в свою очередь находящегося под контролем гипоталамуса, чувствительного к концентрации глюкозы крови.
К лекарственным регуляторам секреции инсулина относятся производные сульфанилмочевины (глибенкламид, гликлазид) и глиниды (старликс, новонорм). Обе группы связываются с разными участками одного рецептора и блокируют АТФ-зависимые калиевые каналы, открывая Ca2+-каналы, и этим индуцируя секрецию инсулина.
Мишени
Рецепторы инсулина находятся практически на всех клетках организма, кроме нервных, но в разном количестве. Нервные клетки не имеют рецепторов к инсулину, т.к. последний просто не проникает через гематоэнцефалический барьер.
Наибольшая концентрация рецепторов наблюдается на мембране гепатоцитов (100-200 тыс на клетку) и адипоцитов (около 50 тыс на клетку), клетка скелетной мышцы имеет около 10 тысяч рецепторов, а эритроциты – только 40 рецепторов на клетку.
Механизм действия
После связывания инсулина с рецептором активируется ферментативный домен рецептора. Так как он обладает тирозинкиназной активностью, то фосфорилирует внутриклеточные белки – субстраты инсулинового рецептора. Дальнейшее развитие событий обусловлено двумя направлениями: MAP-киназный путь и ФИ-3-киназный механизмы действия (подробно).
При активации фосфатидилинозитол-3-киназного механизма результатом являются быстрые эффекты – активация ГлюТ-4 и поступление глюкозы в клетку, изменение активности “метаболических” ферментов – ТАГ-липазы, гликогенсинтазы, гликогенфосфорилазы, киназы гликогенфосфорилазы, ацетил-SКоА-карбоксилазы и других.
При реализации MAP-киназного механизма (англ. MAP – mitogen-activated protein) регулируются медленные эффекты – пролиферация и дифференцировка клеток, процессы апоптоза и антиапоптоза.
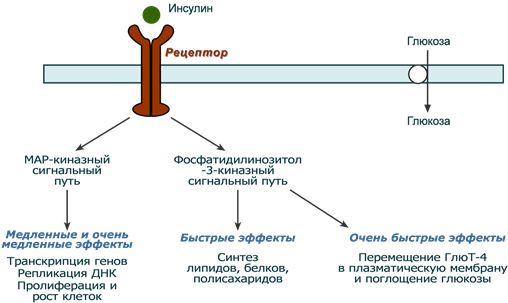
Два механизма действия инсулина
Скорость эффектов действия инсулина
Биологические эффекты инсулина подразделяются по скорости развития:
Очень быстрые эффекты (секунды)
Эти эффекты связаны с изменением трансмембранных транспортов:
1. Активации Na+/K+-АТФазы, что вызывает выход ионов Na+ и вход в клетку ионов K+, что ведет к гиперполяризации мембран чувствительных к инсулину клеток (кроме гепатоцитов).
2. Активация Na+/H+-обменника на цитоплазматической мембране многих клеток и выход из клетки ионов H+ в обмен на ионы Na+. Такое влияние имеет значение в патогенезе артериальной гипертензии при сахарном диабете 2 типа.
3. Угнетение мембранной Ca2+-АТФазы приводит к задержке ионов Ca2+ в цитозоле клетки.
4. Выход на мембрану миоцитов и адипоцитов переносчиков глюкозы ГлюТ-4 и увеличение в 20-50 раз объема транспорта глюкозы в клетку.
Быстрые эффекты (минуты)
Быстрые эффекты заключаются в изменении скоростей фосфорилирования и дефосфорилирования метаболических ферментов и регуляторных белков.
Печень
- торможение эффектов адреналина и глюкагона (фосфодиэстераза),
- ускорение гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- превращение пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиление синтеза жирных кислот (ацетил-SКоА-карбоксилаза),
- формирование ЛПОНП,
- повышение синтеза холестерина (ГМГ-SКоА-редуктаза),
Мышцы
- торможение эффектов адреналина (фосфодиэстераза),
- стимулирует транспорт глюкозы в клетки (активация ГлюТ-4),
- стимуляция гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- превращение пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиливает транспорт нейтральных аминокислот в мышцы,
- стимулирует трансляцию (рибосомальный синтез белков).
Жировая ткань
- стимулирует транспорт глюкозы в клетки (активация Глют-4),
- активирует запасание жирных кислот в тканях (липопротеинлипаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- усиление синтеза жирных кислот (активация ацетил-SКоА-карбоксилазы),
- создание возможности для запасания ТАГ (инактивация гормон-чувствительной-липазы).
Медленные эффекты (минуты-часы)
Медленные эффекты заключаются в изменении скорости транскрипции генов белков, отвечающих за обмен веществ, за рост и деление клеток, например:
1. Индукция синтеза ферментов в печени
- глюкокиназы и пируваткиназы (гликолиз),
- АТФ-цитрат-лиазы, ацетил-SКоА-карбоксилазы, синтазы жирных кислот, цитозольной малатдегидрогеназы (синтез жирных кислот),
- глюкозо-6-фосфатдегидрогеназы (пентозофосфатный путь),
2. Индукция в адипоцитах синтеза глицеральдегидфосфат-дегидрогеназы и синтазы жирных кислот.
3. Репрессия синтеза мРНК, например, для ФЕП-карбоксикиназы (глюконеогенез).
4. Обеспечивает процессы трансляции, повышая фосфорилирование по серину рибосомального белка S6.
Очень медленные эффекты (часы-сутки)
Очень медленные эффекты реализуют митогенез и размножение клеток. Например, к этим эффектам относится
1. Повышение в печени синтеза соматомедина, зависимого от гормона роста.
2. Увеличение роста и пролиферации клеток в синергизме с соматомединами.
3. Переход клетки из G1-фазы в S-фазу клеточного цикла.
Именно группой медленных эффектов объясняется “парадокс” наличия инсулинорезистентности адипоцитов (при сахарном диабете 2 типа) и одновременное увеличение массы жировой ткани и запасание в ней липидов под влиянием гипергликемии и инсулина.
Инактивация инсулина
Удаление инсулина из циркуляции происходит после его связывания с рецептором и последующей интернализации (эндоцитоза) гормон-рецепторного комплекса, в основном в печени и мышцах. После поглощения комплекс разрушается и белковые молекулы лизируются до свободных аминокислот. В печени захватывается и разрушается до 50% инсулина при первом прохождении крови, оттекающей от поджелудочной железы. В почках инсулин фильтруется в первичную мочу и, после реабсорбции в проксимальных канальцах, разрушается.
Патология
Гипофункция
Инсулинзависимый и инсулиннезависимый сахарный диабет. Для диагностики этих патологий в клинике активно используют нагрузочные пробы и определение концентрации инсулина и С-пептида.
Источник
Как ни странно, большое влияние на секреторную функцию поджелудочной железы оказывают гормоны гипофиза, щитовидной и паращитовидной желёз, а также надпочечников. Хотя главным стимулятором к выделению сока поджелудочной железы остаётся пища.
Надо сказать, что объём поджелудочного сока напрямую зависит от характера пищи. Так, при потреблении хлеба выделяется максимальное количество сока, при мясном рационе – несколько меньшее, а при молочном режиме – минимальное. Голодание же вообще приводит к резкому снижению объёма сока и уменьшению концентрации в нём ферментов.
Говоря о действии ферментов поджелудочного сока, нельзя забывать, что сама их активность изменяется под воздействием некоторых неблагоприятных факторов, например, при заболеваниях поджелудочной железы и различных патологических процессах. Впрочем, активность амилазы, трипсина и липазы можно проверить классическими анализами (крови, кала, мочи, содержимого двенадцатиперстной кишки).
Гормоны поджелудочной железы: инсулин, глюкагон, липокаин, калликреин
Фермент амилаза расщепляет находящиеся в пище углеводы на глюкозу и мальтозу, то есть на различные молекулярные соединения сахара. Глюкоза в чистом виде легко всасывается в кровь: уже в полости рта она может попадать в кровеносное русло. После усвоения глюкоза, благодаря гормону инсулину, превращается в гликоген – вещество, необходимое для питания мышц, в том числе и сердечной. Таким образом, под влиянием инсулина происходит поглощение сахара тканями. Поэтому при увеличении количества сахара в крови поджелудочная железа начинает выделять больше инсулина, а при уменьшении сахара – меньше.
Инсулин в сыворотке крови выступает в двояком виде. Первый, свободный, инсулин не связан белком. Он стимулирует, как уже было сказано, поглощение глюкозы мышечной тканью и лишь в незначительной мере занимается жировой тканью. Второй, связанный, инсулин находится в соединении с белком, и превращает глюкозу в гликоген именно для жировой ткани. (Кстати, гликоген, напитав мышцы, откладывается в печени, причём иногда в очень немалом количестве!)
Вторым после инсулина гормоном, регулирующим углеводный обмен, является глюкагон. Он вырабатывается альфа-клетками поджелудочной железы, а также слизистой оболочкой желудка и кишечника и обеспечивает выделение глюкозы в кровь из запасов гликогена в печени, когда содержание сахара в крови понижается.
Третий гормон – липокаин – усиливает образование в печени фософолипидов и способствует лучшему окислению жирных кислот. При недостаточном образовании гормона липокаина развивается жировое перерождение печени, которое можно лечить, принимая препарат «Липокаин» и активно употребляя в пищу (в том числе с самим лекарством) творог и овсяную кашу на воде. Из народных средств, если нет противопоказаний, для лечения ожирения печени нередко применяются плоды красной рябины.
Четвёртый гормон – калликреин (падутин) – пребывает в поджелудочной железе в неактивном состоянии. Он активируется в двенадцатиперстной кишке и обладает свойством понижать артериальное давление, а также, в слабой степени, понижать уровень сахара в крови.
Как работает поджелудочная железа?
Помимо внутрисекреторной и внешнесекреторной функций у поджелудочной железы есть и другие. К примеру, именно через поджелудочную железу выделяются продукты обмена или продукты, введённые извне. К последним относятся лекарства, такие, как антибиотики и сульфаниламиды.
Параллельно с описанными функциями поджелудочная железа участвует в процессах кроветворения и свёртывания крови и в регуляции кровяного давления.
Словом, поджелудочная железа, хотя и представляет собой маленький и хрупкий орган, всё же играет существенную роль в процессах жизнедеятельности организма. Вот почему так важно понимать, как устроена и как работает поджелудочная железа – она требует себе бережного, аккуратного обращения, пренебрегая которым мы рискуем навлечь на себя много неприятностей и проблем со здоровьем!
Источник
