Секрецию поджелудочной железы стимулируют

Регуляция секреции поджелудочной железы. Этапы панкреатической секрецииПоявление панкреатической секреции обусловлено тремя важными основными стимулами. Первые два стимула (ацетилхолин и холецистокинин) стимулируют ацинарные клетки поджелудочной железы, вызывая продукцию большого количества панкреатических пищеварительных ферментов и, соответственно, небольших количеств воды и электролитов, сопутствующих ферментам. Без воды большинство ферментов временно сохраняются в ацинусах и протоках до тех пор, пока не образуется более жидкий секрет, который может поступить в двенадцатиперстную кишку. Секретин в противоположность первым двум основным стимулам вызывает секрецию эпителием протоков поджелудочной железы большого количества водного раствора бикарбоната натрия. Усиливающие эффекты различных стимулов. Когда различные стимулы панкреатической секреции возникают одновременно, общая секреция гораздо больше, чем сумма секретов, вызванных каждым из них по отдельности, поэтому говорят, что разные стимулы усиливают друг друга. Таким образом, панкреатическая секреция является обычно результатом действия не одного, а комбинированных влияний перемноженных основных стимулов.
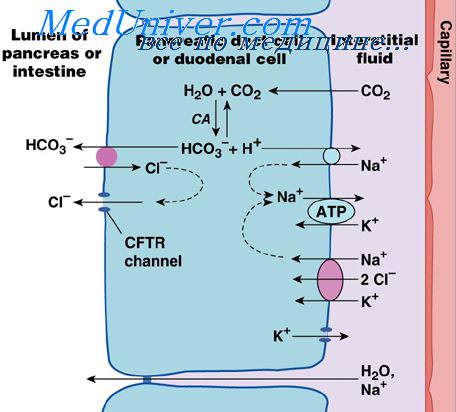
Фазы панкреатической секрецииПанкреатическая секреция аналогично желудочной секреции проходит три фазы: мозговую, желудочную и кишечную. В течение желудочной фазы продолжается нервная стимуляция ферментной секреции, составляя еще другие 5-10% панкреатических ферментов, выделяемых после приема пищи. Но опять только малые количества достигают двенадцатиперстной кишки из-за продолжающегося недостатка значимой секреции жидкости. Кишечная фаза. После того, как химус покидает желудок и поступает в тонкий кишечник, панкреатическая секреция становится обильной, главным образом в ответ на гормон секретин. Секретин стимулирует секрецию значительного количества ионов бикарбоната. Нейтрализация кислого химуса из желудка. Секретин представляет собой полипептид, содержащий 27 аминокислот (молекулярная масса около 3400). Он присутствует в слизистой двенадцатиперстной кишки и тощей кишки в неактивной форме просекретина в так называемых S-клетках. Когда кислый химус с рН менее 4,5-5,0 поступает в двенадцатиперстную кишку из желудка, это вызывает выделение дуоденальный слизи и активацию секретина, который затем абсорбируется в кровь. Единственной действительно важной составляющей химуса является соляная кислота желудка, которая вызывает выброс секретина. Секретин, в свою очередь, вызывает секрецию поджелудочной железой большого количества жидкости, содержащей высокую концентрацию иона бикарбоната (вплоть до 145 мэкв/л), но низкую концентрацию ионов хлора. Механизм образования секретина является особенно важным по двум причинам: (1) секретин начинает высвобождаться из слизистой тонкого кишечника, когда рН дуоденального содержимого падает ниже 4,5-5,0; (2) выброс секретина резко увеличивается, когда рН падает до 3,0. Это немедленно вызывает обильную секрецию панкреатического сока, содержащего существенное количество бикарбоната натрия. Конечным итогом является следующая реакция в двенадцатиперстной кишке: Затем угольная кислота немедленно диссоциирует на двуокись углерода и воду. Углекислый газ абсорбируется в кровь и выводится через легкие, оставляя нейтральный раствор хлорида натрия в двенадцатиперстной кишке. Таким способом немедленно нейтрализуется кислое содержимое, опорожняющееся в двенадцатиперстную кишку из желудка. Слизистая тонкой кишки не может противостоять переваривающему действию кислого желудочного сока, и это является существенным защитным механизмом, предотвращающим развитие дуоденальных язв. Секреция иона бикарбоната поджелудочной железой обеспечивает подходящий рН для работы панкреатических пищеварительных ферментов, действие которых оптимально в слабощелочной или нейтральной среде при рН от 7,0 до 8,0. К счастью, рН секреции натрия бикарбоната в среднем равняется 8,0. Холецистокинин и его вклад в регуляцию секреции пищеварительных ферментов поджелудочной железы. Присутствие пищи в верхнем отделе тонкого кишечника вызывает также выделение из I-клеток, находящихся в слизистой двенадцатиперстной кишки и верхней части тощей кишки, второго гормона — холецистокинина. Это полипептид, содержащий 33 аминокислоты. Такое выделение холецистокинина происходит в результате присутствия протеоз, пептонов (продуктов частичного переваривания белков) и длинноцепочечных жирных кислот в химусе, поступающем из желудка. Холецистокинин, как и секретин, с кровью доставляется к поджелудочной железе, но вместо стимуляции секреции бикарбоната натрия обусловливает преимущественное выделение ацинарными клетками пищеварительных ферментов, причем в больших количествах. Этот эффект подобен тому, который вызывает вагусная стимуляция, но только он более выраженный и составляет от 70 до 80% общей панкреатической секреции ферментов после приема пищи. Различия между эффектами панкреатической стимуляции секретином и холецистокинином показаны на рисунке, который демонстрирует: (1) интенсивную секрецию бикарбоната натрия в ответ на кислоту в двенадцатиперстной кишке, стимулированную секретином; (2) двоякий эффект в ответ на жир (мыла); (3) сильную пищеварительную секрецию ферментов, вызванную холецистокинином (когда пептоны поступают в двенадцатиперстную кишку). – Также рекомендуем “Физиология секреции желчи. Физиологическая анатомия секреции желчи” Оглавление темы “Пищеварительные соки. Переваривание углеводов, белков, жиров”: |
Источник
Секреция ПЖ находится под контролем нервных и гуморальных механизмов. Начальную секрецию ПЖ вызывают вид, запах пищи и другие раздражители (условнорефлекторные сигналы), а также жевание и глотание (безусловнорефлекторные сигналы). При этом нервные сигналы, формирующиеся в рецепторах полости рта и глотки, достигают продолговатого мозга, и затем эфферентные влияния по волокнам блуждающего нерва поступают к железе и вызывают её секрецию.
У человека с фистулой ГПП выделение панкреатического сока начинается через 2—3 мин после того, как он увидел пищу или услышат о ней. Это пример условнорефлекторного пути возбуждения панкреатической секреции. Симпатические волокна, иннервирующие ПЖ, тормозят её секреторную активность и в то же время изменяют реактивность железы по отношению к другим воздействиям, усиливая синтез органических веществ.
Торможение панкреатической секреции происходит при раздражении многих чувствительных нервов, при болевых реакциях, во время сна, при напряжённой физической и умственной работе.
Для стимуляции панкреатической секреции прямые нервные влияния имеют меньшее значение, нежели гуморальные. Ведущее значение в гуморальной регуляции секреции ПЖ принадлежит желудочно-кишечным гормонам.
Большинство регуляторов секреции ферментов ПЖ действуют на рецепторы мембраны ацинарных клеток, расположенные на их базолатеральной поверхности. Выделяют рецепторы ХК, бомбезина, ацетилхолина, субстанции Р, ВИП, секретина.
Стимуляторы панкреатической секреции. ВИП и секретин стимулируют панкреатическую секрецию, активируя аденилатциклазу. Как и в других типах клеток, аденилатциклаза способствует образованию циклического аденозинмонофосфата, в результате чего протеинкиназа А, усиливающая секрецию панкреатического сока, богатого бикарбонатами, переходит в активную форму. Другие стимуляторы поджелудочной секреции (ХК, ацетилхолин, гастрин-рилизинг пептид, субстанция Р) действуют на специфические рецепторы, во внутриклеточной передаче сигнала от которых задействованы альтернативные вторичные мессенджеры.
Эти вещества повышают внутриклеточное содержание циклического гуанозинмонофосфата, что приводит к увеличению внутриклеточного содержания инозитолтрифосфата, диацилглицерола, арахидоновой кислоты и кальция. Эти промежуточные вещества-посредники активируют различные протеинкиназы, в результате этого повышается секреция ферментов. Данные, полученные в опытах на животных, свидетельствуют, что действие комбинации агонистов на различные мембранные рецепторы может вызывать синергический, но не суммарный (аддитивный) эффект. Например, ХК увеличивает секрецию бикарбонатов, стимулированную секретином, но секретин не повышает секреторный ответ на действие ХК.
Ингибиторы секреции поджелудочной железы. Различные вещества, ответственные за подавление панкреатической секреции, действуют по принципу отрицательной обратной связи во время и после приёма пищи.
Панкреатический полипептид (ПП) представляет собой пептидный гормон, образующийся в островках Лангерганса и подавляющий панкреатическую секрецию воды, бикарбонатов и ферментов. Концентрация ПП в плазме крови возрастает после мнимого кормления, после приёма пищи, после экспериментального закисления среды ДПК, а также при стимуляции блуждающего нерва, при действии ХК, секретина, ВИП. ПП может выступать как антагонист мускариновых рецепторов и способен ингибировать выделение ацетилхолина из постганглионарных нейронов ПЖ; его конечный эффект проявляется на уровне ацинарных клеток.
Пептид YY высвобождается в дистальной части подвздошной кишки и и толстой кишке в ответ на поступление пищи смешанного характера, по жиры, находящиеся в просвете кишки, в большей степени способны стимулировать его секрецию. Пептид YY уменьшает чувствительность ПЖ к действию секретина и ХК, возможно, за счёт уменьшения секреции ацетилхолина и норадреналина и ингибирования выделения ХК слизистой оболочкой ДПК.
Соматостатин ингибирует секрецию секретина слизистой оболочкой ДПК, а также уменьшает чувствительность к секретину рецепторных полей. Единственный эффект соматостатина — снижение секреции ферментов и бикарбонатов ПЖ. Соматостатин синтезируют клетки слизистой оболочки желудка и кишечника, а также D-клетки островков Лангерганса. Его активность составляет только около 25% от активности гипоталамического соматостатина. Но только соматостатин, продуцируемый слизистой оболочкой тонкой кишки, оказывает угнетающее действие на секрецию ПЖ.
Выделение соматостатина происходит при участии автономной нервной системы в ответ на поступление жиров и аминокислот с пищей.
Соматостатин блокирует панкреатическую секрецию несколькими способами. Во-первых, он действует путём угнетения продукции стимулирующих пептидов (ХК). Во-вторых, посредством угнетающего воздействия на ЦНС и регулируя работу интрапанкреатических ганглиев, соматостатин ингибирует поступление ацетилхолина в пресинаптическую щель и, возможно, ингибирует выработку инсулина. Хотя рецепторы к соматостатину найдены также в ацинарных клетках, эти рецепторы скорее способствуют увеличению секреции, чем блокируют её.
Другие ингибиторы, представленные среди гормонов эндокринных клеток островков Лангерганса, включают панкреатический глюкагон и панкреастатин, а также нейропептиды: кальцнтонин-генерирующий пептид и энкефалины (табл. 1-3). Панкреатический глюкагон ингибирует секрецию ПЖ, стимулированную ХК, секретином или пищей; угнетает секрецию бикарбонатов, воды и ферментов. Панкреастатин ингибирует панкреатическую секрецию, тормозя высвобождение ацетилхолина эфферентными окончаниями блуждающего нерва. Кальцитонин-генерирующий пептид может проявлять свою активность через стимуляцию выделения соматостатина. Энкефалины и подобные им опиоиды снижают выделение секретина слизистой оболочкой ДПК и могут также ингибировать высвобождение ацетилхолина.
Таблица 1-3. Ингибиторные нейромодуляторы

Маев И.В., Кучерявый Ю.А.
Опубликовал Константин Моканов
Источник
Панкреатит — заболевание, которым страдает наиболее трудоспособная часть населения. Частота его неуклонно растет, а диагностика и лечение представляют значительные трудности.
По мере прогрессирования заболевания хронический панкреатит (ХП) сопровождается развитием функциональной панкреатической недостаточности вследствие потери функционирующей паренхимы органа из-за воспалительной деструкции и формирования фиброза ткани. Секреция поджелудочной железы (ПЖ) играет ключевую роль в реализации пищеварения в целом и в реализации пищеварения в тонкой кишке — в особенности [1]. Фиброз и атрофия ПЖ приводит, помимо снижения секреции ферментов, также к уменьшению секреции бикарбонатов и существенному снижению объема панкреатического секрета. При ХП фиброзная инфильтрация ведет к уменьшению количества островков Лангерганса и их дисфункции. Гормоны, вырабатывающиеся в клетках островков, оказывают влияние на функцию ацинарных клеток: инсулин усиливает выделение панкреатического сока, а соматостатин и панкреатический полипептид ингибирует секрецию энзимов [2, 3]. В настоящее время выявлено, что топографическое расположение островков и ацинарной ткани позволяет осуществлять регуляцию экзокринной функции ПЖ через островки, что подтверждается открытием портального капиллярного круга кровообращения ПЖ, наличие которого обеспечивает попадание гормонов непосредственно из островков на соседние ацинусы. Артериальное кровоснабжение осуществляется сначала через альфа- и дельта-клетки, и только потом кровь попадает к бета-клеткам. Гормоны, секретируемые альфа- и дельта-клетками, могут в высокой концентрации достигать бета-клеток и затем — ацинарной ткани ПЖ [4]. В эксперименте показано, что инсулин повышает транспорт глюкозы и аминокислот в ацинарной ткани, синтез и фосфорилирование белков, холецистокинининдуцированную секрецию амилазы [5]. Гипоинсулинемия приводит к ингибированию роста ацинарных клеток и синтеза панкреатических энзимов [6]. С другой стороны, выявлено участие гастроинтестинальных гормонов в регуляции секреторной деятельности бета-клеток. Продемонстрировано стимулирующее влияние на секрецию инсулина секретина, холецистокинина, гастрина — гормонов, регулирующих экзокринную функцию ПЖ [7, 8].
Развитие сахарного диабета (СД) при ХП варьирует между 30–83%. Среди заболеваний поджелудочной железы, сопровождающихся развитием СД, на долю ХП приходится 76%. По данным различных авторов признаки развития СД при ХП алкогольной этиологии выявляются в 30–50% случаев. Панкреатогенный СД ухудшает качество жизни и является самостоятельным фактором риска смертности при ХП [9–14]. Иммуноцитохимическими исследованиями ткани ПЖ установлено, что снижение секреции инсулина у больных ХП является следствием уменьшения количества бета-клеток островков Лангерганса [15, 16]. Эти изменения зависят от степени воспалительного процесса в ПЖ, длительности и тяжести заболевания. Так, у больных с кальцинозом, перенесших обширный панкреанекроз, нарушения эндокринной функции в той или иной степени выявляются в 90% случаев [17]. Повышение плазменного уровня амилина у больных ХП может являться, по мнению ряда авторов, маркером нарушения эндокринной функции при панкреатитах [18]. Пока сохраняется 20–40% бета-клеток, глюкоза и уровень инсулина в крови при ХП находятся в пределах нормы [2, 7]. Выделение же инсулина на стимуляцию глюкозой чаще всего снижается. Больные с панкреатическим диабетом имеют сниженную инсулиновую активность. Факторы, ответственные за развитие панкреатогенного диабета, включают: снижение массы панкреатических островков и их функции, нарушение секреции гастроинтестинальных гормонов и последствия оперативного лечения панкреатита [15]. Альфа-клетки подвержены деструкции так же, как и бета-клетки, то есть при ХП уровень глюкагона и его резервные возможности могут быть снижены, что способствует развитию гипогликемии. Гипогликемия является частым осложнением СД при ХП, как результат нарушенного отложения гликогена, вследствие неадекватного потребления калорий по причине приема алкоголя или мальабсорбции. Длительная гипогликемия может быть смертельной. Больные с СД, обусловленным ХП, характеризуются нестабильным течением диабета, сниженным потреблением инсулина, устойчивостью к кетоацидозу [19].
Таким образом, в регуляции эндокринной деятельности ПЖ имеет место интегральное воздействие целого ряда гормонов желудочно-кишечного тракта, которые влияют на функцию бета-клеток ПЖ в процессе пищеварения. Инсулин является усилителем и модулятором влияния желудочно-кишечных гормонов на ацинарные клетки. С другой стороны, СД 1-го и 2-го типа протекает с нарушением внешнесекреторной функции ПЖ и диспепсическими расстройствами [20–22]. Дефицит инсулина любого генеза рассматривается как основная причина развития фиброза, жировой дегенерации и атрофии ацинарных клеток [23]. Частота развития осложнений при СД, обусловленных ХП, такая же, как и при других формах СД, и зависит от длительности диабета и адекватности терапии [7].
Целью исследования явилось: выявление особенностей течения ХП, осложненного СД, и обсуждение принципов консервативной терапии.
Материалы, методы и результаты исследования
Обследовано 66 больных ХП в возрасте от 30 до 65 лет (55 мужчин и 11 женщин), средний возраст 46,8 ± 9,2 года. Заболевание сопровождалось у 22 (33,3%) больных формированием кальциноза ПЖ, у 13 (19,7%) — кист ПЖ, у 5 (7,6%) диагностирована псевдотуморозная форма ХП и 10 (15,2%) больных имели клиническое и лабораторное подтверждение наличия СД. У 23 (34,9%) больных в период обострения заболевания отмечалось значительное повышение уровня глюкозы крови натощак, а в период ремиссии он колебался в пределах 6,1–6,9 ммоль/л. По поводу осложненного течения ХП проведено 14 резекционных и 11 дренирующих операций на ПЖ. Диагноз ХП был поставлен на основании клинических, инструментальных, лабораторных данных. Этиологическими причинами заболевания у 50 больных было злоупотребление алкоголем, а у 6 — желчнокаменная болезнь, у 10 — этиологическая причина не выяснена.
Внешнесекреторную функцию ПЖ оценивали по результатам дыхательного теста с использованием 13С-триоктанаина, который предназначен для диагностики in vivo внешнесекреторной функции ПЖ, исследования метаболизма жиров. Триглицериды, содержащие различные жирные кислоты, являются основными компонентами природных жиров. Действующее фармакологическое вещество — 1,3-дистерарил-2-(I-13С) октаноилглицерол, меченный стабильным изотопом углерода. Он метаболизируется в два этапа. На первом этапе происходит отщепление 1-13С-каприловой кислоты в позициях 1, 3, происходящее, в основном, под действием липазы, синтезируемой ПЖ. На втором этапе происходит всасывание отщепленных молекул каприловой кислоты и 2-(1-13С)-монооктаноилглицерола, которому может предшествовать его расщепление до каприловой кислоты. Каприловая кислота при поступлении в тонкую кишку быстро всасывается, связывается с альбумином крови и через систему портального кровотока либо лимфатическую систему и систему общего кровообращения в составе липопротеинов доставляется в печень. Основной канал метаболизма каприловой кислоты — митохондриальное бета-окисление, приводящее к образованию бикарбонат-иона, содержащего углерод-13, который пополняет бикарбонатный пул крови. Это приводит к увеличению доли углерода-13 в углекислоте выдыхаемого воздуха. 13С-триоктаноин-тест проводился натощак. Процедура проведения занимает 6 часов. Во время исследования больному запрещалось курить, проявлять физическую активность и принимать пищу. Для проведения теста готовили тестовый завтрак. До и после приема тестового завтрака больной проводил сбор образцов выдыхаемого воздуха в специальные пронумерованные коллекторы. В коллектор № 1 — образцы воздуха до приема завтрака, затем с интервалом 30 минут в остальные пронумерованные коллекторы. Вывод о состоянии внешнесекреторной функции ПЖ делается на основании обработки полученных данных по суммарной доле выделенной изотопной метки к исходу шестого часа дыхательного теста. Точкой разделения пациентов с нормальной и нарушенной функцией ПЖ является величина 44%. Если суммарная доля выделяемой метки меньше указанной величины, то это указывает на нарушение внешнесекреторной функции ПЖ.
Содержание С-пептида и антител к инсулину определяли в крови иммуноферментным методом с помощью наборов реактивов (AccuBind, США; Orgentec, Германия).
Результаты исследования и их обсуждение
Полученные результаты по данным дыхательного теста свидетельствовали о снижении экзокринной функции ПЖ у больных с ХП как с осложнениями, так и без осложнений при сравнении с нормой 44% (24,3 ± 1,7 и 26,6 ± 1,3% соответственно). Значительное снижение суммарной доли выводимой метки наблюдается у больных с ХП и кальцинозом ПЖ, СД, после резекционных операций по поводу осложнений ХП (табл. 1), и имелись достоверные различия при сравнении с группой больных ХП без осложнений. Уровень же С-пептида в этих группах больных снижался и достоверно отличался при сравнении с группой больных ХП без осложнений (табл. 2), а у больных ХП и СД был снижен до 0,11 ± 0,02 нг/мл, при норме 0,7–1,9 нг/мл, то есть ниже минимальных значений нормы. У больных ХП с нарушением глюкозы натощак уровень С-пептида составил 1,22 ± 0,14 нг/мл, а у больных ХП без признаков нарушения углеводного обмена 1,76 ± 0,12 нг/мл. Выявлена прямая корреляционная зависимость между уровнем С-пептида и показателями дыхательного теста у больных ХП после резекционных операций (r = 0,84, p = 0,03). Антитела к инсулину не определялись во всей группе исследуемых больных. При ХП, осложненном СД, у 7 больных выявлялся кальциноз, у 5 — были проведены резекционные операции, 3 больных имели кальциноз ПЖ, и у них проведены резекционные операции на ПЖ. Этиологической причиной панкреатогенного СД, или СД 3-го типа, в нашем исследовании был алкоголь. Таким образом, можно заключить, что у больных ХП при формировании кальциноза ПЖ, резекциях ПЖ можно прогнозировать развитие СД, что подтверждается и литературными данными. Раннее развитие кальцификации и проведение панкреатодуоденэктомии являются факторами риска формирования СД. Так, при наличии кальцификации опасность развития СД увеличивается в 3 раза, а после тотальной панкреатэктомии СД развивается во всех случаях, после резекционных операций на ПЖ в 40–50%. Такие осложнения ХП, как псевдокисты, дуоденостеноз, холедохостеноз, тромбоз селезеночной и воротной вен, не являются факторами риска присоединения СД [24, 25]. Нарушение внешнесекреторной функции ПЖ у больных панкреатогенным СД чаще всего бывает тяжелой степени, то есть экзокринная и эндокринная недостаточность развиваются параллельно. Антитела к инсулину во всей группе исследуемых больных ХП были отрицательные, что еще раз доказывает специфический тип СД при ХП. Антитела к инсулину могут выявляться только при СД 1-го типа [26]. При СД 1-го и 2-го типа экзокринная недостаточность чаще бывает легкой и умеренной. Особое внимание следует обратить на тот факт, что на практике чаще всего неверно диагностируют СД 1-го или 2-го типа, а не СД 3-го типа, но между этими типами СД имеются различия как в патогенетических механизмах развития заболевания, так и в лечебной тактике (табл. 3) [13, 25].
.gif)
Лечение СД при ХП должно быть индивидуальным и проводится инсулином. Поддержание оптимального уровня глюкозы может предотвратить микроциркуляторные осложнения. В настоящее время инсулинотерапия проводится различными методами с применением различных форм инсулина. Используют, как правило, препараты человеческого генно-инженерного инсулина. Оптимальным является режим интенсифицированной инсулинотерапии с введением инсулина короткого действия перед каждым приемом пищи и инъекцией инсулина пролонгированного действия перед сном. Такая терапия позволяет имитировать физиологическую секрецию инсулина, при которой имеется базисный уровень гормона в крови и пик его секреции — в ответ на пищевые раздражители. Доза инсулина пролонгированного действия составляет около половины общего количества вводимого инсулина [7, 26]. Кроме того, больные СД при ХП должны обязательно получать ферментную заместительную терапию в адекватных дозах постоянно, что оказывает положительное влияние на компенсацию диабета. Влияние заместительной терапии на метаболизм глюкозы у больных СД, имеющих экзокринную недостаточность ПЖ, остается до конца не решенным. В одних исследованиях было установлено улучшение контроля глюкозы в крови и снижение гликированного гемоглобина (HbA1c) у больных СД и экзокринной недостаточностью, получавших заместительную терапию, в других — этот эффект отсутствовал, но течение сахарного диабета стало более стабильным [27]. Кроме того, ферментным потенциалом пищеварительных желез обозначается относительное количество синтезируемых железами ферментов, состоящее в прямой зависимости от величины клеточного пула-продуцентов ферментов. У больных ХП с осложненным течением заболевания после ПДР происходит значительное снижение ферментного потенциала ПЖ [28]. Среди препаратов, используемых для ферментной заместительной терапии, можно выделить Креон®. Дозировка препарата — 10 000, 25 000 и 40 000 ЕД ЕФ. При подборе ферментного препарата для заместительной терапии определяющим является активность липазы. Это связано с тем, что при заболеваниях ПЖ продукция и секреция липазы страдают раньше, чем амилолитических и протеолитических ферментов. Липаза быстрее и более выраженно инактивируется при закислении двенадцатиперстной кишки (ДПК) из-за снижения продукции панкреатических бикарбонатов. При снижении рН в ДПК происходит преципитация желчных кислот, что усугубляет нарушение всасывания жира. Доза препарата при СД, обусловленном ХП, обычно не менее 25 000–40 000 ЕД ЕФ на один прием и не менее 100 000–180 000 ЕД ЕФ в сутки. О необходимости применения высоких доз ферментных препаратов у больных с тяжелой степенью панкреатической недостаточности имеются указания в литературных источниках последних лет [29].
![Различия между СД 1-го типа, 2-го типа и СД, обусловленным хроническим?панкреатитом [13]](/FileStorage/ARTICLE/Lechacshij_vrach/2012-08/07_12/13129227/Lechacshij_vrach_008_(5394)_575.gif)
Литература
- Beger H. G., Matsuno S., Cameron J. L. (ed.) Diseases of the Pancreas. Springer, Berlin Heidlberg New York. 2008. 949 p.
- Кloppell G., Maillet B. Pathology of acute and chronic pancreatitis // Pancreas. 1993. Vol. 8. P. 659–670.
- Leeson T. S., Paparo F. F. Text/Atlas of Hystology. Philadelphia; L. Toronto, 1988. P. 463–475.
- Keller J., Layter P. Acinar-islet interactions: Pancreatic exocrine insufficiency in diabetes mellitus In: Johnson C. D., Imre C. W. et. al. Pacreas disease: Basic science clinical management. London, 2004. 21. P. 267–278.
- Karlsson Sven, Ahren B. O. Cholecystokinin and Regulation of Insulin Secretion // Scand. J. Gastroenterol. 1992. Vol.27. P. 161–165 m.
- Czako L., Hegyi H., Rakonczay J. Z., Jr. et. al. Interactions between the endocrine and exocrine pancreas and their clinical relevanc // Pancreatology. 2009, vol. 9 (4), p. 351–359.
- Pedersen N., Larsen S., Seidelin J. B., Nielsen O. H. Alcohol Modulates Levels of Interleukin — 6 and Monocyte Chemoattractant Protein — 1 in Chronic Pancreatitis // Cand. J. of Gastrenter. 2004. Vol. 39, № 3, p. 277–282.
- Sjoberg R. J., Ridd G. S. Pancreatic diabetes mellitus // Diabetes Care. 1989, vol. 12, 715–724.
- American Diabetes Association Diagnosis and classification of diabetes mellitus // Diabetes Care. 2007. Vol. 30, S42-S47.
- Diem P. Pathogenesis and treatment of diabetes secondary to chronic pancreatitis. In: Buchler M. W., Friess H., Uhl W., Malfertheiner P. (eds). Chronic Pancreatitis. Novel Concepts in Biology and Therapy. Berlin, Blackwell, 2002, 355–358 p.
- Angelopoulos N., Dervenis C., Goula A. et al. Endocrine pancreatic insufficiency in cronic pancreatitis // Pancreatology 2005, vol. 5, p. 122–131.
- Koizumi M., Yoshida Y., Abe N. Pancreatic diabetes in Japan // Pancreas 1998. Vol. 16, p. 385–391.
- YunFeng Cui, Andersen D. K. Pancreatogenic Diabetes: Special Considerations Management // Pancreatology. 2011, vol. 11, № 3, p. 279–294.
- Винокурова Л. В., Астафьева О. В. Взаимодействие экзокринной и эндокринной функций поджелудочной железы при хроническом алкогольном панкреатите // Эксперимент. и клиническая гастроэн. 2002, № 4, с. 58–60.
- Бондарь Т. П., Козинец Г. И. Лабораторно-клиническая диагностика сахарного диабета и его осложнений. М.: Изд. МИА. 2003. 87 с.
- Malka D., Hammel P., Sauvenet A. et al. Risk factors for diabetes mellitus in chronic pancreatitis // J. Gastroenterology. 2000, vol. 119, p. 1324–1332.
- Садоков В. А. Клиническое течение алкогольного панкреатита // Тер. архив. 2003, № 3, с. 45–48.
- Gasiorowska A., Orszulak-Michalak D., Kozlowska A., Malecka-Panas E. Elevatad lasting plasma level of islet amyloid polypeptide (IAPP) in chronic alcoholic pancreatitis (CAP) // Hepatogastroenterology. 2003, vol. 50 (49), p. 258–262.
- Wakasugi H., Funakoshi A., Iguchi H. Clinical assessment of pancreatic diabetes caused by chronic pancreatitis // J. Gastroenterol. 1998, vol. 33, p. 254–259.
- Севергина Э. С. Инсулинзависимый сахарный диабет — взгляд морфолога. М.: ВИДАР, 2002. 149 с.
- Spandens A., El-Salhy V., Suhr O. et al. Prevalence of gastrointestinal symptoms in young and middle — aged diabetic patients // Scandinavian J. of Gastroenteroliogy. 1999, vol. 34, № 12, p. 1196–1202.
- Malka D., Hammel P., Sauvanet A. et al. Risk factors for diabetes mellitus in chronic pacreatitis // Gastroenterology. 2000, vol. 119, p. 1324–1332.
- Морозова Н. Н. Внешнесекреторная функция поджелудочной железы при начальных формах сахарного диабета // Клин. медицина. 1980, № 1, с. 69–72.
- Malka D., Levy Ph. Acinar-islet cell interactions: Diabetes mellitus in cronic pancreatitis. In: Johnson C. D., Imrie C. W. Pancretic disease: Basic science and clinical manfgement. London, 2004, 20, p. 251–266.
- Губергриц Н. Б., Казюлин А. Н. Метаболическая панкреатология. Донецк: «Лебедь», 2011. 460 с.
- Шустов С. Б., Халимов Ю. Ш., Баранов В. Л., Потин В. В. Эндокринология в таблицах и схемах. М.: МИА. 2009. 654 р.
- Пасечников В. Д. Может ли заместительная терапия при недостаточности экзокринной функции поджелудочной железы улучшить течение сахарного диабета // Клиническая гастроэнтерология и гепатология. Русское издание. 2011, т. 4, № 4, р. 196–198.
- Коротько Г. Ф. Рециркуляция ферментов пищеварительных желез. Краснодар, 2011. 143 с.
- Dominguez-Munoz J. Enrigue. Clinical Pancreatology for Practising Gastroenterologists and Surgeons. 2007. 535 р.
Л. В. Винокурова, доктор медицинских наук
И. С. Шулятьев, кандидат медицинских наук
Г. Г. Варванина, доктор медицинских наук
В. Н. Дроздов, доктор медицинских наук, профессор
ГУ ЦНИИ гастроэнтерологии Департамента здравоохранения города, Москва
Контактная информация об авторах для переписки: gastroenter@rambler.ru
Купить номер с этой статьей в pdf
Источник