Причины асцита при раке поджелудочной железы
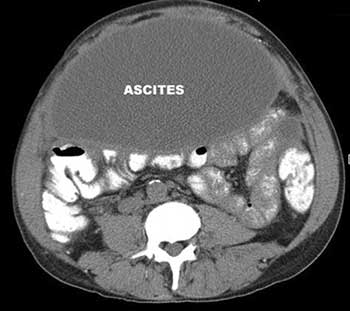
Асцит — патологическое состояние, при котором в брюшной полости скапливается жидкость. Причины его бывают различными. Чаще всего к асциту приводит цирроз печени. Так же он возникает как осложнение онкологических заболеваний, при этом ухудшается состояние больного, снижается эффективность лечения.
Некоторые цифры и факты:
- На ранних стадиях онкологических заболеваний умеренный асцит развивается примерно у 15–50% пациентов;
- Тяжелый асцит развивается примерно у 7–15% онкологических больных;
- При асците в брюшной полости может скапливаться до 5–10 литров жидкости, в тяжелых случаях — до 20 литров.
При каких видах рака может развиваться асцит?
Чаще всего асцит развивается при следующих онкологических заболеваниях:
- рак яичников;
- рак печени;
- рак поджелудочной железы;
- рак желудка и кишечника;
- рак матки;
- рак молочной железы;
- неходжкинские лимфомы, лимфома Беркитта.
Почему рак приводит к скоплению жидкости в брюшной полости?
При раке печени причины асцита те же, что при циррозе (собственно, рак печени в большинстве случаев и развивается на фоне цирроза): нарушение оттока крови, повышение давления и застой в венах, нарушение синтеза альбумина и снижение онкотического давления крови.

При злокачественных опухолях других органов (желудка, кишечника, матки, яичников) асцит возникает из-за поражения раковыми клетками брюшины. Из-за этого нарушается всасывание жидкости. Если опухолевые клетки поражают лимфатические узлы, асцит может возникать из-за нарушения оттока лимфы.
Проявления асцита при онкологических заболеваниях
Если в брюшной полости скапливается небольшое количество жидкости (100–400 мл), симптомы отсутствуют. В таких случаях асцит обнаруживают зачастую случайно во время УЗИ или КТ органов брюшной полости.
Постепенно, по мере нарастания асцита, живот увеличивается в объеме. Пациент чувствует тяжесть в животе, ноющие боли. За счет задержки жидкости увеличивается масса тела. Происходит сдавление внутренних органов, возникают такие симптомы асцита брюшной полости, как тошнота и рвота, отрыжка, расстройство стула и мочеиспускания. Изменяется внешний вид пупка: он выбухает, как во время беременности. Больной чувствует слабость, постоянную усталость, снижается аппетит.
К каким осложнениям приводит асцит?
При выраженном, длительно существующем асците жидкость скапливается в плевральной полости, развивается гидроторакс. Это приводит к еще большему расстройству дыхания, тяжелой одышке.
*По аналогии с брюшной полостью, в грудной клетке находится тонкая оболочка из соединительной ткани — плевра, париетальный листок которой выстилает стенки, висцеральный покрывает легкие.
При портальной гипертензии микроорганизмы из кишечника могут проникать в асцитическую жидкость. Развивается спонтанный бактериальный перитонит. Ситуация усугубляется тем, что в асцитической жидкости мало антител, поэтому иммунный ответ слабый.
Редкое, но очень тяжелое осложнение асцита — гепаторенальный синдром. При этом цирроз и печеночная недостаточность приводят к серьезному нарушению функции почек, вплоть до тяжелой почечной недостаточности. Пациенты с гепаторенальным синдромом в среднем живут от 2 недель до 3 месяцев. Причины этого состояния до конца не известны. Считается, что кровоток в почках нарушается из-за чрезмерного применения мочегонных средств, внутривенных контрастов во время рентгенографии и компьютерной томографии, некоторых лекарственных препаратов.
Методы диагностики
Внешние признаки асцита становятся хорошо заметны, когда количество жидкости в брюшной полости достигает 0,5–1 литра. Живот при этом заметно увеличен. Когда пациент стоит, он выглядит отвисшим, в положении лежа — распластан, боковые его части выступают. Врачи называют такую картину образно «животом лягушки».
Если во время осмотра врач обнаруживает у пациента признаки асцита, он может назначить следующие методы диагностики:
- УЗИ, КТ и МРТ помогают диагностировать асцит и оценить количество жидкости в брюшной полости, состояние внутренних органов, обнаружить злокачественную опухоль, оценить количество, размеры, локализацию патологических очагов, степень прорастания опухоли в различные органы и ткани;
- Биохимический анализ крови помогает оценить функцию печени, почек, определить уровни электролитов, степень снижения количества белка;
- Исследование свертываемости крови помогает выявить нарушения, связанные с расстройством функции печени (печень синтезирует некоторые факторы свертывания);
- Диагностический лапароцентез — процедура, во время которой проводят пункцию брюшной полости под контролем УЗИ и получают небольшое (примерно столовую ложку) количество асцитической жидкости. В ней исследуют уровни лейкоцитов и эритроцитов, общего белка и альбумина, глюкозы, амилазы. Проводят анализы на присутствие микроорганизмов, цитологическое исследование на предмет наличия опухолевых клеток.
Лечение асцита в онкологии
Лечение асцита у онкологических больных — сложная задача. От правильного подхода к ее решению зависит качество и продолжительность жизни пациента, эффективность противоопухолевой терапии. В идеале нужна клиника, которая специализируется на лечении асцита у онкобольных.
Консервативное лечение
Такая терапия помогает выводить до 1 литра жидкости в сутки. Она существенно улучшает состояние примерно у 65% пациентов. Но применять ее можно только при умеренном асците. Многие пациенты на поздних стадиях рака плохо переносят ограничение жидкости и соли. Поэтому консервативная терапия не рассматривается как основной метод лечения асцита при онкологии.
Лапароцентез
Лапароцентез — процедура, во время которой в брюшную полость под контролем УЗИ вводят троакар — специальный инструмент в виде трубки с острыми краями (напоминает иглу, только толще) и выводят жидкость. Лапароцентез проводят под местной анестезией в стерильных условиях, во время процедуры пациент сидит или лежит. Троакар вводят по средней лини живота или по линии, которая соединяет пупок с подвздошной костью. Во время процедуры из брюшной полости можно безопасно вывести до 5–6 литров жидкости.
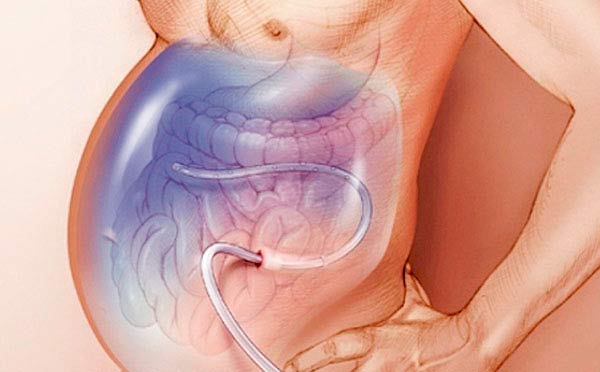
После лапароцентеза врач может установить в брюшную полость перитонеальный катетер — трубку, соединенную с резервуаром для оттока асцитической жидкости. При выраженном асците катетер может быть оставлен на несколько дней.
Возможные осложнения во время и после лапароцентеза:
- Падение артериального давления при выведении большого количества жидкости. Для того чтобы этого не произошло, асцитическую жидкость выводят медленно, постоянно контролируют пульс и артериальное давление пациента;
- Белковая недостаточность из-за потери большого количества альбуминов вместе с асцитической жидкостью. Для борьбы с белковым дефицитом внутривенно вводят альбумин;
- Боль. При необходимости после лапароцентеза назначают обезболивающие препараты.
- Жидкость, которая остается после процедуры в некоторых отделах брюшной полости. Для того чтобы вывести всю жидкость, врач может установить более одного перитонеального катетера в разных местах.
- Перитонит в результате проникновения микроорганизмов в брюшную полость. Редкое осложнение. Для его профилактики и лечения назначают антибактериальные препараты, может потребоваться хирургическое вмешательство.
- Нарушение оттока жидкости по перитонеальному катетеру. Чаще всего возникает из-за того, что конец катетера «присосался» к стенке брюшной полости или внутренним органам. Зачастую, чтобы справиться с этой проблемой, достаточно изменить положение тела. Если это не помогает, может потребоваться замена катетера.
- Выделение жидкости после удаления катетера. Для ее сбора на 1–2 дня на место пункции накладывают специальный резервуар.
- Сращение сальника (части брюшины) или участка кишки с брюшной стенкой возникает при повторных пункциях. Если это приводит к значительному нарушению работы кишки, может потребоваться хирургическое рассечение спаек.
Внутрибрюшинная химиотерапия
Некоторым пациентам назначают внутрибрюшинную химиотерапию — химиопрепарат вводят в высоких дозах в брюшную полость, иногда предварительно нагрев его до 41 градуса (такую химиотерапию называют гипертермической). Это помогает уменьшить асцит. Проводят системную химиотерапию.
Один из новых препаратов для лечения асцита у онкологических больных — моноклональное антитело Катумаксомаб. Его также вводят внутрибрюшинно. Катумаксомаб взаимодействует с рецепторами опухолевых и иммунных клеток и индуцирует иммунную реакцию. Но препарат действует лишь на раковые клетки, обладающие определенными молекулярно-генетическими характеристиками.
Хирургическое лечение
Некоторым пациентам показана оментогепатофренопексия. Во время этой операции сальник подшивают к печени или диафрагме. Благодаря возникновению такого контакта улучшается всасывание асцитической жидкости.
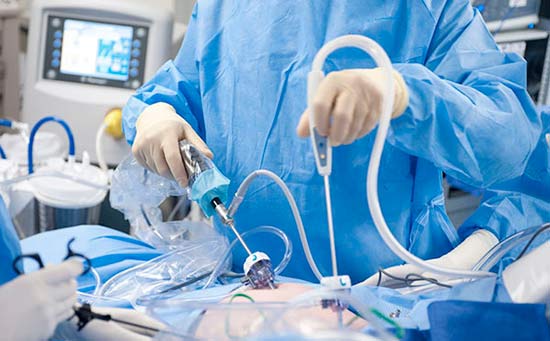
В качестве паллиативного хирургического вмешательства прибегают к перитонеовенозному шунтированию. В брюшную полость устанавливают катетер, который соединяет ее с венозной системой. Катетер оснащен клапаном — он открывается, когда давление в брюшной полости превышает центральное венозное давление. При этом происходит сброс жидкости в вены.
Деперитонизация стенок брюшной полости — вмешательство, во время которого хирург удаляет участки брюшины, тем самым создавая дополнительные пути для оттока асцитической жидкости.
Применяются и другие виды хирургического лечения.
Прогноз при асците у онкологических больных
Обычно асцит возникает на поздних стадиях рака, ухудшает прогноз для онкологического пациента. При злокачественных опухолях, осложнившихся асцитом, отмечается низкая выживаемость. Паллиативное лечение помогает улучшить качество жизни, несколько увеличить ее продолжительность. Врач должен тщательно оценить состояние пациента, выбрать оптимальные методы лечения, исходя из их потенциальной эффективности и рисков.
Цены
В Европейской клинике действует специальное предложение на дренирование асцита в условиях дневного стационара – 50000 руб.
В цену включено:
- Осмотр и консультация хирурга-онколога.
- Общий анализ крови, биохимический анализ крови, ЭКГ.
- УЗИ органов брюшной полости с определением уровня свободной жидкости
- Проведение лапароцентеза с УЗИ навигацией.
- Комплексная медикаментозная терапия, направленная на восстановление водно-электролитного баланса.
Удаление жидкости из брюшной полости проводится с применением наиболее современных методик, передового опыта российских и зарубежных врачей. Мы специализируемся на лечении рака и знаем, что можно сделать.
Источник
Панкреатогенный асцит (ПА) является редким осложнением хронического панкреатита, обусловленным наличием дефекта протоковой системы поджелудочной железы, сообщающегося со свободной брюшной полостью, т.е. внутренним панкреатическим свищом [7].
ПА может возникнуть вследствие не только хронического панкреатита, но и травмы поджелудочной железы, стриктуры панкреатического протока, вирсунголитиаза. По данным ресурса PubMed, за последние 10 лет опубликованы единичные работы, посвященные диагностике и лечению больных с ПА [3, 15, 16, 20]. В 2003 г. J. Gomez-Cerezo и соавт. [14] проанализировали данные литературы с 1975 по 2000 г. За указанный период опубликовано 139 наблюдений. В связи с отсутствием рандомизированных исследований единая тактика лечения этой категории больных отсутствует. В абдоминальном отделении Института хирургии им. А.В. Вишневского в 2000-2013 гг. оперированы 670 больных хроническим панкреатитом, из них у 17 (2,3%) заболевание было осложнено ПА. Приводим клиническое наблюдение.
Больной О., 40 лет, поступил в Институт хирургии им. А.В. Вишневского 26.02.14 с жалобами на боли в верхнем отделе живота опоясывающего характера, тошноту, увеличение объема живота, одышку.
Из анамнеза известно, что пациент в течение 4 лет страдает хроническим калькулезным панкреатитом, неоднократно был госпитализирован в хирургические стационары по месту жительства. В декабре 2013 г. появилась одышка, отметил увеличение живота в размерах. В январе 2014 г. с указанными жалобами был госпитализирован в стационар по месту жительства, где выполнен лапароцентез, при котором эвакуировано 12 л жидкости. Цитологическое исследование жидкости не производили, уровень амилазы не определяли. Онкомаркеры в пределах нормы. Причина асцита не установлена. Выписан из стационара с диагнозом: хронический калькулезный панкреатит, постнекротические кисты поджелудочной железы. Асцит неясного генеза.
При поступлении в Институт состояние больного средней тяжести. Кахектичен, индекс массы тела 16,79 кг/м2. Потеря в массе тела за последние полгода составила 32%. Кожный покров обычной окраски, тургор кожи снижен. Подкожная жировая клетчатка практически отсутствует. В легких везикулярное дыхание, проводится симметрично. Тоны сердца звучные, шумов нет. Пульс 72 удара в 1 мин. АД 110/70 мм рт.ст. Живот значительно увеличен в объеме за счет свободной жидкости; венозный рисунок подкожных вен передней брюшной стенки усилен. При пальпации живот мягкий, незначительно болезненный в левом подреберье. Печень не пальпируется, перкуторно размеры ее соответствуют норме. Пальпация живота малоинформативна из-за большого количества жидкости, опухолевидных образований и воспалительных инфильтратов в брюшной полости не определяется. Область почек не изменена, поколачивание по поясничной области безболезненно. Нервно-психический статус соответствует таковому у человека, злоупотребляющего приемом алкогольных напитков. При ректальном исследовании на высоте пальца патологических образований не определяется, геморроидальные узлы не увеличены. Данные лабораторных методов исследования свидетельствуют об анемии средней степени тяжести смешанного генеза, белковой недостаточности. При эзофагогастродуоденоскопии слизистая оболочка осмотренных органов не изменена, расширения вен подслизистого слоя нет. Ультразвуковое исследование: хронический калькулезный панкреатит, псевдокиста головки поджелудочной железы, панкреатическая гипертензия, свободная жидкость в брюшной полости в большом количестве. При диагностической тонкоигольной пункции получена жидкость с содержанием амилазы 6007 Е/л и белка 3,8 г/л, атипичных клеток не выявлено. Компьютерная томография: в паренхиме поджелудочной железы множественные кальцинаты; панкреатический проток расширен до 5 мм, в его просвете крупные конкременты (до 5-6 мм); в головке поджелудочной железы постнекротическая киста диаметром 34 мм, в теле поджелудочной железы киста диаметром 23 мм, из которой, вероятнее всего, исходит свищевой ход (см. рисунок). Рисунок 1. КТ брюшной полости, артериальная фаза, сагиттальный срез. Дефект главного панкреатического протока (стрелка). Заключение: хронический калькулезный панкреатит, постнекротическая киста головки поджелудочной железы, панкреатическая гипертензия. Асцит.
Рисунок 1. КТ брюшной полости, артериальная фаза, сагиттальный срез. Дефект главного панкреатического протока (стрелка). Заключение: хронический калькулезный панкреатит, постнекротическая киста головки поджелудочной железы, панкреатическая гипертензия. Асцит.
На основании данных обследования установлен диагноз: хронический калькулезный панкреатит, панкреатическая гипертензия; внутренний панкреатический свищ, ПА. Алиментарная дистрофия.
В предоперационном периоде больному проводили интенсивное парентеральное и энтеральное питание высококалорийными смесями на протяжении 14 дней. В связи с нарастанием одышки за счет увеличения асцита потребовалось дважды выполнять лапароцентез с эвакуацией по 2,5 и 3 л жидкости. Масса тела больного возросла на 5 кг.
11.03 больной оперирован. Произведена поперечная лапаротомия. В брюшной полости прозрачная опалесцирующая жидкость, которая аспирирована в объеме 5 л. Париетальная и висцеральная брюшина гиперемирована, фибринозных наложений нет. Большой сальник в проекции средней трети желудка и поперечная ободочная кишка образуют рыхлый инфильтрат, фиксированный к передней брюшной стенке. При отделении инфильтрата от париетальной брюшины из его ткани начал выделяться панкреатический сок, что позволило обнаружить свищевой канал, уходящий в сторону тела поджелудочной железы. Вскрыта сальниковая сумка. Головка поджелудочной железы увеличена до 6-7 см, вовлечена в плотный воспалительный инфильтрат, не позволяющий идентифицировать ткани. Вскрыта кистозная полость в области тела поджелудочной железы, из которой исходил ранее обнаруженный свищевой ход. Размер вскрытой кисты 3×4 см, со стороны хвоста поджелудочной железы в нее открывается панкреатический проток. Зонд проведен в проток на расстояние 5 см – стриктур и конкрементов нет. Начата мобилизация предполагаемой передней поверхности железы в проксимальном направлении, при этом вскрылась полость и обозначился просвет постнекротической кисты. Отверстие в стенке кисты расширено, что позволило ревизовать ее полость. Размер кисты 4×5 см. Дальнейшая мобилизация головки поджелудочной железы и ее резекция признаны неоправданными из-за опасности повреждения сосудов и сложности формирования панкреатодигестивного анастомоза. Решено ограничиться паллиативным вмешательством. Стенки ранее вскрытых постнекротических кист иссечены и объединены в единую полость, дном которой являлся панкреатический проток. Наложен цистоеюноанастомоз на отключенной по Ру петле тощей кишки. Послеоперационный период протекал без осложнений. По дренажной трубке, подведенной к анастомозу, выделялась прозрачная жидкость в объеме 500 мл в сутки, не содержавшая амилазу. Ситуация была расценена как выделение транссудата, обусловленного асептическим воспалением. На 5-е сутки после операции количество отделяемого по дренажу сократилось до 100 мл, дренаж был удален. В удовлетворительном состоянии больной выписан на 8-е сутки после операции.
Первое сообщение о внутренних панкреатических свищах у 2 больных хроническим панкреатитом, осложненным ПА, опубликовано в 1953 г. [25]. Панкреатогенным считается асцит, возникший вследствие неопухолевого заболевания поджелудочной железы и характеризующийся содержанием амилазы более 1000 Е/л, а также уровнем белка не менее 3 г/л [5, 7]. В 43-80% наблюдений развитие ПА связано с поступлением панкреатического сока через дефект постнекротической кисты, в 10% наблюдений – через дефект панкреатического протока. У 10% больных причина асцита остается неуточненной [11, 18, 21].
ПА является редким осложнением хронического панкреатита. Частота его у больных с хроническим панкреатитом составляет 3,5-14% [4, 6, 17]. P. Broe и J. Cameron [5] описали 185 больных с панкреатогенным асцитом, причинами которого были хронический панкреатит (77,6%), травматическое повреждение поджелудочной железы (8,4%), стеноз выходного отдела главного панкреатического протока и вирсунголитиаз (4%); в 10% наблюдений причина не установлена.
ПА чаще встречается у мужчин в возрасте 20-50 лет [6]. Клинические проявления заключаются в снижении массы тела при значительном увеличении размера живота, болях в животе различной интенсивности [9]. Отсутствие перитонеальных симптомов при наличии в брюшной полости панкреатогенной жидкости некоторые авторы связывают с инактивацией панкреатических ферментов при поступлении их в свободную брюшную полость [7, 10, 23]. За счет экскреторной недостаточности наблюдаются мальабсорбция, нарушение усвоения белка, витаминов, микроэлементов, что ведет к истощению, нарушению гомеостаза.
Диагностический поиск должен проходить в трех направлениях: оценка общего состояния пациента и нутритивного статуса; уточнение природы асцита; визуализация панкреатического протока для уточнения возможной локализации его дефекта [1, 5, 6].
Для уточнения природы асцита проводится пункция брюшной полости с анализом полученной жидкости для определения уровня амилазы и белка.
Уточнение возможной локализации дефекта панкреатического протока или постнекротической кисты является важной диагностической составляющей и играет роль в планировании объема оперативного вмешательства. Ранее с этой целью проводили интраоперационную панкреатикографию. С развитием эндоскопических методов диагностики стали чаще применять эндоскопическую ретроградную панкреатикографию.
Недостатком эндоскопической ретроградной панкреатикографии является инвазивный характер этого исследования, которое сопряжено с возможным развитием кровотечения из большого сосочка двенадцатиперстной кишки, а также острого панкреатита. С развитием современных методов диагностики, таких как компьютерная томография (КТ), магнитно-резонансная томография, магнитно-резонансная панкреатикохолангиография (МРПХГ), актуальность эндоскопических методов утрачена. По данным КТ может быть получена исчерпывающая информация о состоянии паренхимы поджелудочной железы, парапанкреатических скоплениях, размерах и ходе панкреатического протока, наличии конкрементов, стриктур и постнекротических кист. Выявление причины и уточнение локализации дефекта с помощью этого метода возможны у половины больных. Точность КТ и МРПХГ составляет 50 и 67% соответственно, при их сочетании вероятность визуализации внутреннего панкреатического свища достигает 94% [12]. Таким образом, в клинической практике рекомендуется использование обоих этих методов.
Лечение пациентов с панкреатическим свищом и ПА является сложной задачей. Наличие у больных алиментарной недостаточности вплоть до кахексии, анемии, белковой недостаточности, нарушений свертывающей системы, а также сахарного диабета и прочих метаболических нарушений требует интенсивной предоперационной подготовки.
Больные, не способные перенести радикальное хирургическое вмешательство, подлежат консервативному лечению. Терапия заключается в подавлении секреторной активности поджелудочной железы аналогами соматостатина, энтеральном и парентеральном питании, коррекции водно-электролитного дисбаланса, контроле массы тела. При возникновении признаков дыхательной недостаточности необходим лапароцентез [13, 19]. Целесообразна попытка выполнения эндоскопического лечения – эндоскопической ретроградной панкреатикографии со стентированием панкреатического протока [8, 15].
Радикальное хирургическое лечение заключается в устранении панкреатической гипертензии за счет формирования панкреатоеюно- или цистоеюноанастомоза [2, 22, 24].
Источник
