Повышение иммунитета при раке поджелудочной железы
Рак поджелудочной железы (РПЖЖ) — это одно из самых смертельных заболеваний среди солидных опухолей. Ежегодно регистрируется более 250000 смертей от рака поджелудочной железы. Он является восьмой по частоте причиной смерти от злокачественных новообразований у мужчин и женщин во всем мире, а заболеваемость РПЖЖ варьируется от 1 до 10 случаев на 100000 человек. Проблема рака поджелудочной железы актуальна в современной медицине, так как большинство пациентов с локальным или метастатическим РПЖЖ не являются кандидатами на лечебную резекцию из-за чрезвычайно неблагоприятного прогноза.
Несмотря на огромный прогресс в лечении других злокачественных опухолей благодаря прорыву в иммунотерапии рака, лечение рака поджелудочной железы развивалось медленно в течение последних двух десятилетий. Неэффективность иммунотерапии РПЖЖ объясняется несколькими факторами, в том числе слабой иммуногенностью опухоли (мутантные белки, экспрессируемые на поверхности опухолевых клеток РПЖЖ, обладают слабыми антигенными свойствами, по сравнению, к примеру, с антигенами меланомы или рака легкого), а также наличием иммуносупрессивных свойств как у самой опухоли, так и у ее микроокружения. Не последнюю роль в резистентности к терапии играет десмопластическая строма опухоли, состоящая из фибробластов, клеток поджелудочной железы, иммунных клеток, кровеносных сосудов и белков внеклеточного матрикса. Помимо уже упомянутых иммуносупрессивных свойств, она играет роль физического барьера, препятствующего доставке терапевтических агентов к опухолевым клеткам. Взаимодействие опухолевых клеток с микроокружением может приводить как к усилению роста опухоли и подавлению иммунного ответа на нее, так и к нарушению ее развития, что делает опухолевое микроокружение хорошей целью для терапевтического воздействия. Совокупностью этих факторов обосновывается неэффективность традиционной иммунотерапии. Это поднимает необходимость разработки и внедрения новых, улучшенных способов лечения РПЖЖ с помощью различных иммунологических методик, а также подготовки комбинированных схем терапии с применением различных препаратов или иных методов (например, лучевая терапия).
Устранение иммуносупрессивных свойств опухолей — это один из зарекомендовавших себя подходов в иммунотерапии рака. Ингибирование иммуносупрессивных молекул CTLA-4 и PD-1 — неплохой метод, который проявил себя в лечении таких видов рака как меланома, уротелиальная карцинома, рак почки, гепатоцеллюлярный рак и др. CTLA-4 (цитотоксический лимфоцитарный антиген 4) представляет собой ингибирующий рецептор, локализующийся на CD4+ и CD8+ лимфоцитах. Его экспрессия повышена в опухолях, и было показано, что блокада CTLA-4 вызывает противоопухолевый иммунный ответ. Препарат ипилимумаб — это человеческое моноклональное антитело, нацеленное на CTLA-4. Однако несмотря на его эффективность в терапии других опухолей, клинические испытания ипилимумаба в терапии РПЖЖ не показали эффективных результатов. Другой супрессивной молекулой является programming death 1 (PD-1, рецептор запрограммированной смерти 1). Он экспрессируется на эффекторных Т-лимфоцитах, B-лимфоцитах, NK-клетках и Treg. При связывании со своим лигандом PD-1L этот рецептор активирует ингибирование активации и пролиферации лимфоцитов. Терапия моноклональными антителами против PD-1 (препараты пембролизумаб и ниволумаб) также была эффективна при лечении солидных опухолей, таких как меланома, рак почки и урогенитальная карцинома. Также применяются моноклональные антитела против PD-1L (атезолизумаб). Однако клинические испытания на РПЖЖ не показали эффективности данных методов.
Другим подходом к лечению злокачественных новообразований является стимуляция собственного иммунитета организма пациента с помощью противоопухолевых вакцин. Такие вакцины предназначены для увеличения представления опухолевых антигенов и активации антигенспецифичных эффекторных Т-лимфоцитов и Т-клеток памяти. Выявлено несколько антигенов, которые экспрессируются в большинстве опухолей поджелудочной железы, как например карциноэмбриональный антиген (СЕА), муцин-1 (MUC-1) и белок, кодируемый мутированным геном KRAS. В настоящее время несколько вакцин были испытаны для терапии РПЖЖ. GVAX — это клеточная вакцина, в которой модифицированные клетки рака поджелудочной железы экспрессируют гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF). Фаза I клинических испытаний показала безопасность данной вакцины, однако эффект от терапии был неоднозначный. Несмотря на то, что не было выявлено улучшения однолетней и общей выживаемости в группах пациентов, получавших данную вакцину в сочетании с химиолучевой терапией, и пациентов, получавших только адъювантную лучевую терапию, подгруппа пациентов с длительной безрецидивной выживаемостью показала увеличение опухолеспецифичных CD8+ Т-лимфоцитов после вакцинации. Это демонстрирует, что данная методика может использоваться в отношении некоторой группы пациентов. Другой тип вакцин, на основе опухолевых пептидов, также был исследован. Вакцина на основе мутантного белка KRAS, который мутирует больше чем в 90 % случаев РПЖЖ, давала появление иммунного ответа у 58 % пациентов, причем медиана выживаемости среди таких пациентов была в два раза выше, чем у группы, не развивших иммунный ответ. Другая мультипептидная вакцина OCV-C01, содержащая фрагменты рецептора фактора роста эндотелия сосудов 1 и 2 (VEGFR1 и VEGFR2 соответственно), а также белка семейства кинезина (KIF20A), была исследована на пациентах с РПЖЖ. 58,6 % испытуемых показали развитие иммунного ответа на KIF20A, что сопровождалось значительным улучшением безрецидивной выживаемости. Данные результаты свидетельствуют о перспективности использования противоопухолевых вакцин и необходимости установления новых антигенных детерминант, более специфичных для РПЖЖ.
Хорошие результаты вакцин и важность иммуносупрессивных свойств микроокружения опухоли для успешной терапии дают обоснования для комбинирования данных методик в терапии РПЖЖ. Клиническое исследование комбинированной терапии ипилимумабом и вакциной GVAX показало эффективность данного подхода, по сравнению с монотерапией ипилимумабом, а также безопасность данного сочетания препаратов. Эффективной оказалась и комбинация GVAX с ингибиторами PD-1, которая демонстрировала значительное увеличение средней общей выживаемости по сравнению с монотерапией. В группе пациентов, получавших оба препарата, обнаруживалось увеличение CD8+ T-лимфоцитов, продуцирующих IFN-gamma. Было показано, что пациенты, получавшие GVAX за 2 недели до резекции опухоли, демонстрировали увеличение уровня PD-L1, что указывает на один из механизмов иммунорезистентности. Таким образом, комбинация вакцин и ингибиторов иммуносупрессивных молекул является обоснованной и перспективной схемой терапии, требующей дальнейших исследований.
Новым подходом к лечению РПЖЖ являются методики, воздействующие на определенный компоненты стромы рака поджелудочной железы, о роли которой в резистентности к терапии было упомянуто ранее. Мезенхимальная строма РПЖЖ содержит большое количество фибробластов, продуцирующих белок-α активирующий фибробласты (FAP-α). Высокая экспрессия этого белка коррелирует с худшим прогнозом заболевания. В эксперименте на мышах ликвидация клеток, экспрессирующих FAP-α, повышала эффективность противоопухолевых вакцин. Эффективными оказались и комбинации данной методики с анти-CTLA-4 и анти-PD-L1 препаратами. Другое исследование было направлено на блокаду рецептора колониестимулирующего фактора 1 (CSF1R), который экспрессируется на ассоциированных с опухолью М2-макрофагах и супрессорных миелоидных клетках (MDSC). Данные клетки обладают способностью блокировать цитотоксический иммунный ответ. Ингибирование CSF1R в сочетании с химиотерапией улучшает противоопухолевый иммунитет. В мышиной модели трансплантации РПЖЖ лечение ингибиторами CSF1R приводило к усилению инфильтрации опухоли Т-клетками, однако эти клетки демонстрировали повышенные уровни CTLA-4, а также наблюдалось усиление экспрессии PD-L1 в опухоле. Этот факт делает обоснованным сочетание ингибиторов CSF1R и анти-CTLA-4, анти-PD-L1 препаратов. IMC-CS4 является CSF1R-антителом, которое в настоящее время проходит клинические испытания в сочетании с GVAX и анти-PD1 терапией. Еще одна важная молекула, а точнее пара молекул, была исследована в качестве мишени для терапии РПЖЖ. Хемокин CXCL12 широко представлен в микроокружении опухоли, а его рецептор CXCR4 экспрессирован на опухолевых клетках. Показано, что CXCL12 способствует хемотаксису опухолевых клеток, что указывает на перекрестное клеточное взаимодействие между опухолевыми клетками и стромой. Это взаимодействие оказалось значимым для иммунорезистентности РПЖЖ, так как при обработке опухоли AMD3100 моноклональным антителом к CXCR4, регистрировалось снижение роста опухоли, зависимое от Т-лимфоцитов. Комбинация AMD3100 с анти-PD-L1 препаратом также оказалась эффективной. На данный момент AMD3100 находится в I фазе клинических испытаний в качестве терапии РПЖЖ под торговым названием Мозобил (Mozobil). Помимо ингибирующих агентов моноклональные антитела могут использоваться и как агонисты различных рецепторов. CD40 является молекулой, располагающейся на поверхности иммунных клеток. При связывании со своим лигандом CD40L (который экспрессирован на CD4+ Т-хелперных клетках) активирует антигенпредставляющие клетки. Было продемонстрировано, что усиление действия CD40 повышает эффективность противоопухолевых вакцин. Моноклональные антитела, активирующие CD40, приводили к регрессии опухоли в сочетании с химиотерапией в доклинических исследованиях. В клинических испытаниях I фазы терапия агонистом CD40 в сочетании с химиотерапией привела к иммунному противоопухолевому ответу в 19 % случаев у пациентов с неоперабельной формой РПЖЖ. В мышиных моделях, сочетание анти-PD-1 или анти-CTLA-4 препаратов с агонистами CD40 усиливало противоопухолевый иммунитет. 39 % мышей, получавших подобную схему терапии, демонстрировали длительную полную ремиссию и продолжительную выживаемость. Также терапия привела к уменьшению Treg и увеличению CD8+ Т-лимфоцитов в микроокружении опухоли. Важно, что в экспериментах на мышах сочетание CD40 агонистов с анти-PD-1 или анти-CTLA-4 препаратами показало улучшенную среднюю выживаемость по сравнению с комбинацией химиотерапии и CD40 агониста. На данный момент моноклональное антитело-агонист CD40 R07009789 проходит клинические испытания в комбинации с химиотерапией и ингибиторами супрессорных молекул.
Таким образом, рак поджелудочной железы является важной проблемой в современной медицине. Традиционные подходы иммунотерапии, такие как ингибиторы иммуносупрессивных молекул и противоопухолевые вакцины, малоэффективны в качестве монотерапии при РПЖЖ. В то же время, комбинации специальных препаратов, воздействующих на компоненты микроокружения опухоли с традиционной иммунотерапией и химиотерапией показали многообещающие результаты. Требуется дальнейшее всестороннее изучение данного злокачественного новообразования для разработки эффективных методов лечения, в том числе и иммунотерапии.
Источники:
- Torphy R. J., Zhu Y., Schulick R. D. Immunotherapy for pancreatic cancer: Barriers and breakthroughs //Annals of Gastroenterological Surgery. — 2018.
- Bhosale R. R. et al. Current Perspectives on Novel Drug Carrier Systems and Therapies for Management of Pancreatic Cancer: An Updated Inclusive Review // Critical Reviews™ in Therapeutic Drug Carrier Systems. — 2018. — Т. 35. — №. 3.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Опухоль поджелудочной железы симптомы и лечение. По своему происхождению новообразования в поджелудочной железе бывают доброкачественными или злокачественными.
Часто их выявляют после инструментального обследования других органов. На УЗИ однозначно вид опухоли не определить. При подозрении на новообразование в поджелудочной железе нужно обратиться к врачу, который назначит дополнительное всестороннее обследование.
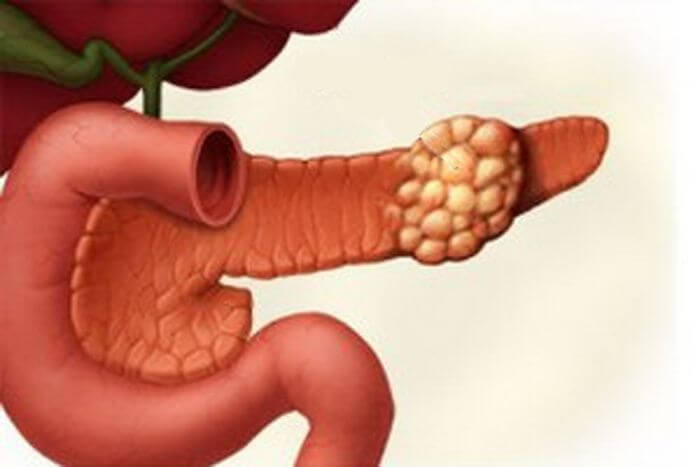
Классификация опухолей
Новообразование в поджелудочной железе разделяются:
По локализации — месту возникновения в структуре железы:
- головка;
- тело;
- хвост;
- островки Лангерганса;
- протоки.
Гистологическому строению определяется, из каких клеток образовалась опухоль:
- эпителиальное происхождение;
- железистой паренхимы;
- из островкового эпителия;
- неэпителиального генеза;
- дизонтогенетические.
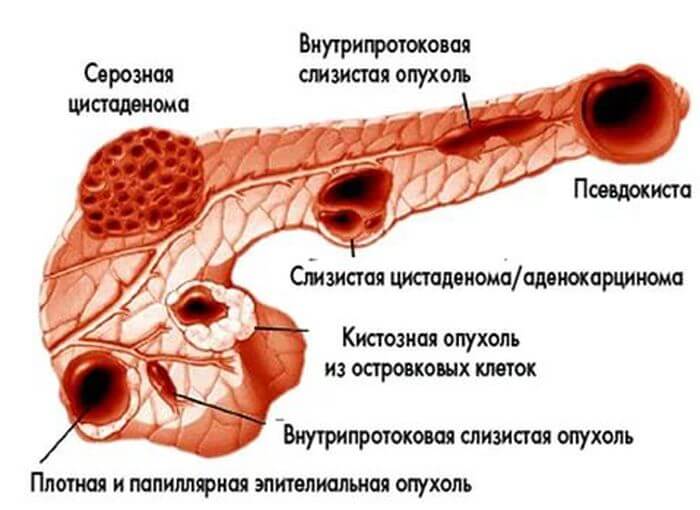
Функциональным нарушениям – состояние, связанное с изменением регуляции в организме: гормональной или нервной. Орган остается неповрежденным, но деятельность поджелудочной железы нарушается.
Симптомы
Развитие опухоли до поры протекает без видимых симптомов. Когда она разрастается и возможно прорастает в близлежащие органы: желудок, тогда появляются типичные симптомы, с которыми доктор знаком. По симптомам он назначает всестороннее обследование.
Злокачественная опухоль поджелудочной железы проявляет свои симптомы при значительном разрастании:
Закупорка протоков
Закупорке протоков (обтюрация) – появляется при сдавливании образованием органов, которые нарушают свое функционирование, и проявляется болями, свидетельствующими о том, что новообразование просочилось сквозь нервные окончания. У каждого пациент симптомы проявляются индивидуально и зависят от места возникновения.
Опухоль головки поджелудочной железы провоцирует боль в правом подреберье. Опухоль хвоста поджелудочной железы вызывает дискомфорт и боль в левом подреберье. Если образованием охвачено тело поджелудочной железы, то боль проявляется вкруговую, опоясывающая.
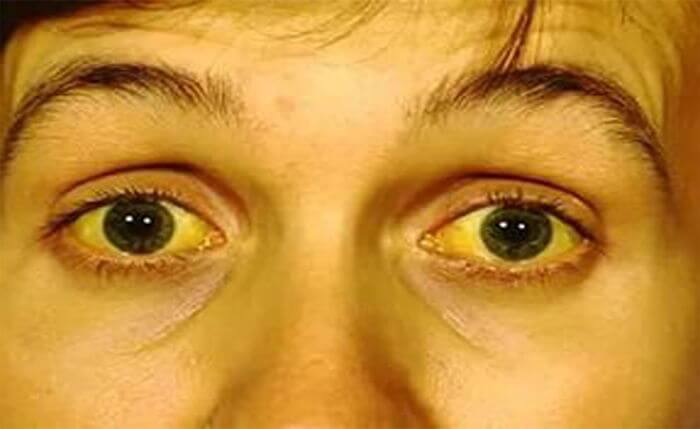
Боль сильно увеличивается при несоблюдении диеты, а также лежа на спине. Сдавливание органов приводит к закупорке желчных протоков, проявляющееся в оттоке желчи из печени в кишечник. Результатом становится механическая желтуха. У нее свои симптомы:

- желтушное окрашивание кожи, склер или слизистых оболочек;
- обесцвечивание стула;
- потемнение мочи;
- изменение размера печени и желчного пузыря в сторону увеличения;
- возникновение кожного зуда.
Рак поражает близлежащие органы, из которых может, в любой момент открыться кровотечение.
Интоксикация
Интоксикация организма. Ее признаки часто путают с признаками заболеваний и отклонений в ЖКТ. Симптомы похожи, но действие на организм интоксикации значительно тяжелее:
- резкое снижение веса;
- потеря аппетита;
- вялость, немощь, апатия;
- повышение температуры.
Доброкачественная опухоль поджелудочной железы позволяет классифицировать симптоматику 2 видов:
Ранняя стадия имеет бессимптомное течение, и приобретает их в процессе роста:
- боли вверху живота, подреберьях, правом или левом, отдающая в спину, усиливающаяся по ночам;
- дискомфорт и боль после приема пищи;
- постепенная потеря веса;
- тошнота, снижение аппетита, немощь и потеря трудоспособности.
Поздняя стадия – проявляется симптомами, как и при злокачественной опухоли. Помимо перечисленных выше, симптомов вызывает страх и нервные расстройства, повышает потоотделение. Симптомы могут возникать постепенно или внезапно. И они отличаются, завися от типа доброкачественного образования.
Риски возникновения
Точной причины появления раковых клеток нет. Но опухолевый процесс имеет свои факторы риска, о которых многие знают. Среди них:
- Вредные привычки: алкоголь, курение.
- Генная предрасположенность.
- Неправильное питание.
- Панкреатит.
- Неблагоприятная экологическая обстановка.
Диагностика
Всесторонне обследование пациента, используя различные методы исследования, позволит выяснить тяжесть опухоли: очаги, размеры, действие на соседние органы, метастазирование.
Обследование поможет определиться с методикой лечения:
- УЗИ. Позволяет увидеть новообразование, очаг его распространения.
- Компьютерная томография с введением контрастного вещества выявит не только очаги опухоли, но и метастазы, если они есть.
- Рентгенологические методы: А) Рентгенография определяет последствия прорастания опухоли на желудок и двенадцатиперстную кишку, сдавливание органов, диффузия слизистых оболочек, снижение моторики. В) Релаксационная дуоденография определяет локализацию опухоли и последствия ее разрастания. С) Ирригография выявляет дефекты в поперечно-ободочной кишке в результате прорастания опухоли.
- Эндоскопическая ретроградная холангиопанкреатография позволяет осмотреть желчную и панкреатическую системы с целью выявления их поражений. Взять материал для биопсии из неблагополучных очагов.
- Эндоскопический ультразвук. За счет технического оснащения: эндоскоп, видеокамера, ультразвуковой датчик, возможно, исследовать новообразование, введя инструменты через кишку. Такое исследование позволяет выявить новообразование на ранних стадиях.
- Рентгенохирургическая диагностика с контрастом позволяет выявить причины механической желтухи и смещение артерий.
- Радионуклидное исследование позволяет выявить закупорку общего с поджелудочной железой желчного протока.
- Нашумевший спорный тестер Джека Андраки, основан на анализе крови или мочи, используя специальную бумагу.
Главное в диагностике — установка медицинского диагноза на основании интерпретация полученных результатов исследования и анализов, формирование экспертного заключения.
Лечение
Необходимое лечение подбирается доктором на основании диагностики и анализов.
Хирургическая терапия всегда показана при обнаружении доброкачественного образования. Исследование гистологии со срезов образования позволит точно установить была ли она доброкачественной. Основные операции по удалению новообразований:
- Резекция состоит в удалении части поджелудочной железы, чаще в ее хвосте.
- Удаление непосредственно образования способом вылущивания. Выполняются для опухолей, которые продуцируют гормоны: доброкачественная инсулома.
- Панкреатодуоденальная резекция производится в случае размещения образования на головке железы. Оно удаляется вместе с 12-перстной кишкой.
- Селективная артериальная эмболизация закупоривает сосуд, на котором растет образование с целью отключить подпитку кровоснабжением. Используется при гемангиоме.
Химиотерапия
Химиотерапия призвана лечить злокачественное образование при помощи токсинов и ядов, которые называются химиопрепаратом. Она бывает: предоперационной, послеоперационной, профилактической, лечебной.
Поскольку раковые клетки бесконечно делятся, то химиотерапия циклично повторяется в расчете с клеточным циклом деления. Процедура состоит из капельного введения препарат или приёмом таблеток.
Наружная радиотерапия, являющаяся разновидностью терапии лучевой. Суть излечения — бомбардирование зоны новообразования излучением от медицинского ускорителя в виде пучка элементарных частиц. Проводится сеансами через фиксированный промежуток времени. Показания к применению:
- Сокращение размера опухоли на поджелудочной железе перед хирургическим вмешательством.
- Локально-возникшем раке поджелудочной железы.
- Уменьшение страданий при метастазах.
- Предотвращение рецидивов рака после хирургической операции.
Симптоматическая терапия направлена на снятие болей и облегчения страданий умирающего пациента: гормональная терапия – это лечение с помощью применения гормонов, способных тормозить рост рака. Продлевает продолжительность жизни.
Виротерапия применяет онкотропные или онколитические вирусы в терапевтических целях, мобилизуя против злокачественных клеток естественные защитные силы иммунной системы организма.
Нанонож как необратимая электропорация, разрушающая раковые клетки путем воздействия на них электрическим полем большой интенсивности локализовано. Для этого применяется специальный аппарат — нанонож.
В настоящее время слывет одним из самых результативных способов уничтожения опухоли в поджелудочной железе. Факт возможности повторения процедуры важное обстоятельство для повторного проведения при рецидивах или неоперабельном раке.
Шансы на выздоровление или жизнь после оперативного лечения
Сама операция на поджелудочной железе мало опасна. Прогноз оптимистичней при ранних сроках выполнения операции. Полностью выздоравливают пациенты с доброкачественными опухолями: глюкагономы, инсуломы, гастриномы и их разновидности
Рак поджелудочной железы имеет печальную статистику:
- На операцию поступают пациенты, у которых отсутствуют множественные метастазы, А это, как правило, лишь 15% больных. Для 85 % предоставляются виды лечения, направленные на продление жизни.
- Смертность на операционном столе у одного пациента из 6.
- Продолжительность жизни до 5 лет у каждого десятого больного после хирургического вмешательства, у остальных меньше.
После оперативного лечения возможны осложнения в функционировании организма. Любая операция влечет приспособление организма к потере органа или его части. Если орган жизненно важен, то адаптация проходит тяжелее. У пациентов после удаления опухоли поджелудочной железы, симптомы и лечение влекут 2 проблемы: сбои при пищеварении, снижение инсулина в организме.
Решаются проблемы дефицита путем назначения медикаментозных препаратов. При сопутствующих удалениях частей близлежащих органов: желудка, селезенки, двенадцатиперстной кишки врач посоветует надлежащую терапию и диету.
Профилактика
Поскольку ученые неутомимо работают над вопросом изучения причин, дающих толчок развитию рака, а ответа на них нет со 100 % достоверностью, поэтому руководства во избежание заболевания нет.
Лучший способ профилактики исключить знакомые всем факторы риска. Быть внимательным к себе при проявлениях болей в месте расположения железы. Не откладывать визит к доктору и хотя бы поверхностное обследование УЗИ.
Опухоль поджелудочной железы симптомы и лечение животрепещущая тема для многих страдающих заболеванием.
Источник
