Пилори рак поджелудочной железы
Факторы внешней среды
Возможно, в качестве запускающего момента выступают различные факторы внешней среды, в частности курение. Существуют данные о сильной взаимосвязи курения и риска развития ХП, который, в свою очередь, может трансформироваться в рак ПЖ. Ранее считалось, что риск развития рака ПЖ у выкуривающих одну пачку сигарет в день в 4 раза выше, чем у некурящих, а при курении более 40 сигарет в день риск развития рака ПЖ повышается в 10 раз.
На аутопсии у курящих обнаруживают гиперпластичсскис изменения в эпителии протоков ПЖ (увеличивается число кпеток с атипичными ядрами), причём эти изменения особенно выражены у злостных курильщиков. Остаётся, однако, непонятным, курение — прямой фактор риска для развития рака ПЖ или его действие опосредовано через развитие ХП, для которого и характерно развитие гиперпластических процессов в протоковом эпителии.
По данным большинства проведённых в последние годы исследований определено, что курение — не прямой фактор риска для рака ПЖ. Существуют данные, что приблизительно одна треть из всех опухолей, возникающих на фоне ХП, связана с курением, в то время как оставшиеся две трети, по всей видимости, связаны с другими причинами, провоцирующими канцерогенез в комбинации с курением. Прекращение курения не снижает риск рака ПЖ до уровня тех, кто никогда не курил.
Предполагалось, что важнейшую роль в онкогенезе рака ПЖ несут нитрозоамины, содержащиеся в табаке, которые, попадая в ПЖ, реагируют с ДНК и активируют специфические онкогены (K-ras). Данное мнение укрепилось после того, как стало известно, что с помощью нитрозаминов можно индуцировать рак ПЖ у животных в эксперименте.
На данный момент достаточно однозначны суждения о роли пищевых продуктов в генезе рака ПЖ. Особое значение принадлежит потреблению животных белков и мяса.
Показана прямая зависимость между смертностью от рака ПЖ и уровнем потребления мясных продуктов. В странах с высоким потреблением мяса и животного жира на душу населения (Новая Зеландия, Дания, США, Канада) смертность от рака ПЖ наибольшая, в то время как в Японии, Италии и Израиле, где потребляемость названных продуктов значительно ниже, меньше и показатели смертности от этого заболевания.
В Японии замечено, что у тех, кто ест мясо ежедневно, риск возникновения рака ПЖ в 2,54 раза выше по сравнению с теми, кто ест в основном, морепродукты. Разноречивы сведения о значении вида мяса. Одни исследователи утверждают, что более рискованно ежедневно питаться свининой, а другие показывают преимущественную опасность от потребления говядины. Возможно, один из механизмов канцерогенеза при употреблении в пищу большого количества мяса и животных жиров — гиперсекреция холецистокинина слизистой оболочкой ДПК на фоне ежедневного поступления в неё химуса с преобладанием компонентов животного происхождения. Косвенно подтверждают эту теорию развития рака ПЖ данные о защитном эффекте фруктово-овощной диеты в отношении возникновения этого заболевания.
В контексте вышесказанного нельзя не упомянуть данные нескольких проспективных исследований и исследований случай-контроль, согласно которым в ряде регионов, где население употребляет в пищу большое количество рыбы, значительно реже встречается рак ПЖ благодаря индукции апоптоза и выраженному подавлению пролиферации раковых клеток.
Последние исследования свидетельствуют, что высокое содержание длинноцепочечных w3-полиненасыщенных жирных кислот в рационе питания связано с подавлением опухолевого роста и метастазирования, в том числе при раке ПЖ. По экспериментальным данным, такие компоненты рыбьего жира, как декозогексаеновая и эйкозопентаеновая кислоты, в животных моделях проявляли тормозящие эффекты за счет подавления митоза и потенцирования апоптоза.
Ряд исследований показал, что противоопухолевый эффект рыбьего жира опосредован низкой продукцией метаболитов в реакциях, катализируемых циклооксигеназой и липоксигеназой. Циктооксигеназа-2 не только конвертирует арахидоновую кислоту в простагландины, стимулирующие воспалительные реакции в повреждённых тканях, но и производит мутагены при метаболизировании ряда канцерогенных веществ, стимулируюших пролиферацию и ангиогенез.
По экспериментальным данным, циклооксигеназа-2 ингибирует апоптоз у трансгенных мышей с повышенной экспрессией циклооксигепазы-2 и вызывает прогрессирующие изменения клеток, включая дисплазию и потерю нормальной архитектоники ткани. У людей во всех случаях рака ПЖ выявлена высокая экспрессия циктооксигеназы-2 опухолевой тканью, достоверно превышающая уровень экспрессии этого фермента в ткани здоровой ПЖ (примерно в 3-4 раза).
Значение алкоголя в возникновении рака ПЖ до сих пор не доказано. Результаты разных публикаций весьма противоречивы. Существуют даже данные о защитной роли столового вина, возможно обусловленной высоким содержанием в виноградном вине биофлавоноидов, обладающих выраженными антиоксидантными свойствами.
На наш взгляд, взаимосвязь потребления алкоголя и рака ПЖ может быть объяснена достаточно просто — этанол провоцирует эпизоды ОП, утяжеляет течение ХП, способствует более быстрому развитию панкреатолитиаза и сахарного диабета, что служит непосредственным фоном для развития рака.
Крайне противоречивы сведения о роли потребления кофе в отношении рака ПЖ. Сенсационными и пугающими были результаты первых эпидемиологических исследований, когда была показана связь между ежедневным потреблением этого напитка и повышенным риском возникновения новообразования. Эпидемиологические данные были отчасти подтверждены сведениями о мутагенности этого напитка, его катализирующей активности по превращению в желудке пищевых нитритов в нитрозамины. Между тем последующие, более строгие эпидемиологические исследования не подтвердили канцерогенный эффект кофе и чая.
Целая группа индустриальных химических веществ повышает риск развития рака ПЖ при длительном производственном или бытовом контактах: дериваты бензилина. в-нафтиламинов, нитрозаминов, металлическая пыль, различные растворители, дихлордифенилтрихлорметилметан и другие.
Как известно, патогенез и прогрессирование ХП связаны с профилем цитокинов, персистирующих в ткани ПЖ: фактора некроза опухоли а, интерлейкинов 6 и 8, ростовых факторов, которые в больших концентрациях обнаружены и при раке ПЖ. Первичное эффекторное звено острой воспалительной реакции — моноциты, которые дифференцируются в тканевые макрофаги и, как известно, тесно взаимодействуют с цитокиновой сетью. Рак ПЖ обычно характеризуется значительной десмолластической реакцией; как правило, в гистологических препаратах рака ПЖ выявляют макрофаги.
Именно поэтому, весьма обоснованным выглядит мнение, что при воспалении каскад секретируемых в больших количествах цитокинов может ускорить опухолевый рост. Несмотря на название, фактор некроза опухоли а, выделяемый макрофагами, играет важную роль в процессе онкогенеза на фоне хронического воспаления, поскольку один из его биологических эффектов — ингибирование апоптоза клеток рака ПЖ.
Возможно и непосредственное повреждение ДНК на фоне ХП свободными радикалами кислорода и некоторыми соединениями азота, образующимися в больших количествах лейкоцитами и макрофагами при воспалении. В условиях оксидативного стресса на клеточный геном действуют многочисленные генотоксические вещества, приводящие к разрывам нитей ДНК. Одно из наиболее опасных таких веществ — 7,8-дигидро-8-оксогуанин, остатки которого в ДНК нередко образуют аномальные пары с аденином в ходе репликации, вызывая трансверсионные мутации. Необходимо отметить, что такие мутации, обнаруживаемые при раке ПЖ, особенно распространены в спектре мутаций защитного гена р53.
Повторное повреждение ткани и регенерация, наблюдаемые при ХП в присутствии высокоактивного азота и разновидностей кислорода, в итоге заканчиваются генетическими изменениями типа точечных мутаций, дслеций или перестановок. Таким образом, ХП значительно увеличивает риск развития рака ПЖ за счёт генетической неустойчивости; воспалительные клетки, хемокины и цитокины регулируют рост, миграцию и дифференцировку всех типов клеток в микроокружении опухоли, включая неопластические клетки, фибробласты и эндотелиальные клетки.
За последние годы проведено множество исследований различных факторов риска развития рака ПЖ, о которых мы ещё не говорили, в частности половой и расовой принадлежности, сахарного диабета и инфекции Helicobacter pylori (И. pylori). Так, было выявлено, что рак ПЖ значительно чаще встречается у мужчин, чем у женщин, а также у лиц негроидной расы и больных, страдающих в течение длительного времени сахарным диабетом. Однако высокая частота сочетания сахарного диабета и рака ПЖ не даёт однозначного ответа на вопрос — действительно ли диабет предрасполагает к развитию рака ПЖ или рак ПЖ приводит к вторичному диабету Кроме того, не совсем понятно, сам ли сахарный диабет потенцирует развитие рака ПЖ, либо непосредственно панкреатит, на фоне которого могла развиться инкреторная недостаточность ПЖ, трансформируется в рак.
Относительно расовых различий было показано, что, например, в Соединённых Штатах Америки (США) чернокожее население заболевает раком ПЖ чаще – 14,9 случаев на 100 тыс. населения в год, в то время как люди белой расы значительно реже — 8,7 случаев на 100 тыс. населения в год.
Гастроктомия или резекция желудка, проведённые по поводу пептических язв и доброкачественных опухолей желудка, повышают риск развития рака ПЖ в 3—5 раз. Существует несколько теоретических объяснений этому. Во-первых, желудок участвует в разложении канцерогенных агентов. Во-вторых, при отсутствии желудка более активна секреция холецистокинина и гастрина, обусловливающих гиперсекрецию панкреатического сока и нарушение функционирования ПЖ. Косвенно подтверждает вышеизложенное тот факт, что аналоги соматостатина (антагонисты холецистокинина) тормозят развитие рака ПЖ в эксперименте.
Helicobacter pylori и рак поджелудочной железы
В ряде эпидемиологических исследований показана более высокая инфицированность И. pylori больных раком ПЖ по сравнению с остальным населением. Данные наблюдения подтверждены контролируемыми исследованиями в Финляндии, показавшими, что H.pylori-позитивные люди имеют статистически достоверно более высокий риск развития рака ПЖ по сравнению с H.pylori-отрицательной субкогортой. Точная роль Н. pylori в патогенезе рака ПЖ до сих пор подробно не изучена. Возможно, в этиопатогенезе рака ПЖ играет роль другая разновидность рода Helicobacter, а серологические исследования с антителами против Н. pylori могут быть, фактически, ложноположительными.
Ввиду неблагоприятного прогноза рака ПЖ, дальнейшие научные исследования с целью идентификации H. pylori и определения его роли в канцерогенезе этого новообразования могут иметь потенциальное значение для разработки профилактических мероприятий (эрадикании), подобно применяемым в настоящее время у больных с семейным анамнезом рака желудка либо с уже развившейся опухолью желудка. Поскольку рак ПЖ чаще возникает у лиц более низких социальных классов, возможна случайная ассоциация ХП и рака ПЖ, хотя это пока не подтверждено.
На основе имеющихся данных невозможно исключить патогенетическую связь между И. pylori и раком ПЖ. Местные воспалительные эффекты Н. pylori в желудке способствует хроническому выделению бактериальных цитотоксических веществ и провоспалительных посредников, приводящих к реализации системных эффектов инфекции. Гипотетическое существование разновидностей Helicobacter, способных к хроническому инфицированию ткани ПЖ, определяет необходимость дальнейшего изучения данной проблемы.
Маев И.В., Кучерявый Ю.А.
Опубликовал Константин Моканов
Источник
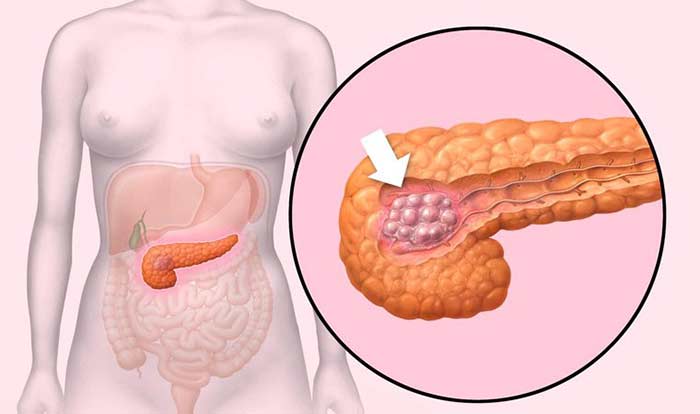
Поджелудочная железа имеет длину примерно 15 см и анатомически состоит из трех частей: головки, тела и хвоста. Головка находится в правой верхней части живота, на уровне первых двух поясничных позвонков. Ее охватывает двенадцатиперстная кишка.
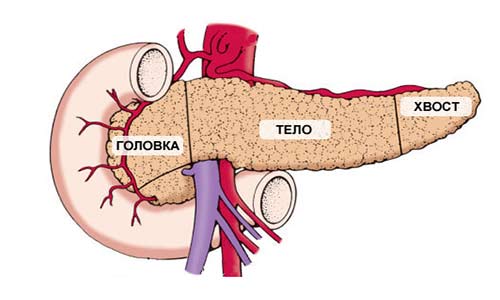
Основная функция поджелудочной железы — выработка пищеварительных ферментов. Проток железы выходит из ее головки, затем соединяется с холедохом — главным желчным протоком — и вместе они впадают в двенадцатиперстную кишку.
Кроме того, в поджелудочной железе есть эндокринные клетки, которые вырабатывают гормоны. Самый известный из них — инсулин.
Какие виды рака могут возникать в головке поджелудочной железы?
В 60–70% случаев рак поджелудочной железы возникает в ее головке. Более 80% опухолей представляют собой аденокарциномы. Они развиваются из клеток, которые выстилают протоки железы.
Реже встречаются кистозные опухоли. В большинстве случаев кисты поджелудочной железы носят доброкачественный характер, но в некоторых случаях в них обнаруживаются раковые клетки. Установить точный диагноз помогает биопсия.
Если опухоль происходит из клеток, продуцирующих фермент, ее называют ацинарно-клеточным раком. Обычно он диагностируется в более молодом возрасте, медленно растет и имеет более благоприятный прогноз.
Редко встречаются опухоли из эндокринных клеток: инсулиномы, глюкагономы, гастриномы, соматостатиномы.
Стадии рака головки поджелудочной железы
На стадии I опухоль имеет размеры не более 4 см и находится в пределах органа, не распространяется в соседние структуры и лимфоузлы. Выделяют подстадии IA (опухоль менее 2 см) и IB (опухоль 2–4 см).

На стадии II опухоль более 4 см в диаметре (подстадия IIA), либо она имеет любой размер, но при этом распространяется в соседние органы (желчный проток, двенадцатиперстную кишку), лимфоузлы (подстадия IIB). При этом процесс не затрагивает крупные кровеносные сосуды.
Если опухоль поражает большее количество лимфатических узлов, прорастает в соседние органы и крупные кровеносные сосуды, но при этом отсутствуют отдаленные метастазы, диагностируют III стадию рака головки поджелудочной железы.
При IV стадии имеются отдаленные метастазы.
Факторы риска
Нормальная клетка становится раковой, когда в ней происходят определенные мутации. Зачастую невозможно точно сказать, что именно привело к изменениям в ДНК, таким образом, причины рака головки поджелудочной железы неизвестны. Ученые знают лишь о факторах риска — различных внешних воздействиях и состояниях организма, при которых повышается вероятность заболевания:
- Вредные привычки: курение (повышает риск примерно на 20%), алкоголь.
- Низкая физическая активность и избыточная масса тела.
- Рацион питания с преобладанием красного и обработанного мяса, с низким содержанием фруктов и овощей.
- Семейная история (близкие родственники, у которых был диагностирован рак головки поджелудочной железы), некоторые генетические дефекты и наследственные синдромы.
- Хронический панкреатит.
- Заболевания желудка: инфекция Helicobacter pylori, язвенная болезнь.
- Вирусный гепатит.
- Есть данные в пользу того, что риски повышают заболевания зубов и десен.
Симптомы рака головки поджелудочной железы
На ранних стадиях опухоль, как правило, не проявляет себя. Затем возникают некоторые симптомы, но они неспецифичны, чаще всего они указывают на какое-либо иное заболевание.
Наиболее характерным проявлением рака головки поджелудочной железы является желтуха. Именно она зачастую становится первым симптомом, с которым пациент обращается к врачу. Рядом с головкой железы находится желчный проток. По мере роста опухоль сдавливает его, нарушая отток желчи. В итоге токсичный продукт распада гемоглобина — билирубин — не выводится в кишечник, а поступает в кровь. Это приводит к тому, что кожа и белки глаз приобретают желтоватый цвет, беспокоит зуд.
Так как билирубин в составе желчи не выводится в кишечник, стул становится светлым. Моча, напротив, темнеет.
Другие возможные симптомы: боль в животе, тошнота и рвота, снижение веса, нарушение пищеварения, тромбоз глубоких вен ноги, повышение температуры тела. В редких случаях из-за опухоли разрушаются эндокринные клетки, которые производят инсулин. Повышается уровень сахара в крови, развивается сахарный диабет.
Методы диагностики. Скрининг
Обычно, если появились симптомы, это говорит о том, что опухоль уже проросла за пределы поджелудочной железы. Зачастую именно на этом этапе пациенту устанавливают диагноз. В настоящее время нет рекомендованных скрининговых исследований, которые помогали бы диагностировать заболевание на ранних бессимптомных стадиях.
Обычно в первую очередь врач назначает пациенту УЗИ органов брюшной полости, как самый быстрый, доступный, безопасный и неинвазивный метод диагностики. Более информативные исследования — КТ и МРТ, они помогают выявить опухоль поджелудочной железы, узнать, распространился ли рак в соседние органы и регионарные лимфоузлы.
Для оценки состояния желчных протоков применяют холангиопанкреатографию. Для этого в протоки вводят рентгеноконтрастное вещество эндоскопически, через двенадцатиперстную кишку, либо с помощью иглы через кожу, после чего выполняют рентгенограммы.
Обнаружить метастазы помогает ПЭТ-сканирование. Во время процедуры в организм вводят безопасное радиоактивное вещество, которое накапливается в раковых клетках и делает их видимыми на специальных снимках.
Наиболее точный метод диагностики рака головки поджелудочной железы — биопсия. Опухолевую ткань для цитологического и гистологического исследования можно получить разными способами:
- С помощью иглы через кожу, под контролем КТ или ультразвука.
- Во время лапароскопии.
- Во время эндоскопического УЗИ: исследования, при котором ультразвуковой датчик находится на конце эндоскопа, введенного в двенадцатиперстную кишку.
- Во время холангиопанкреатографии.
Лечение рака головки поджелудочной железы
Основной метод лечения рака головки поджелудочной железы — хирургический. В некоторых случаях хирург может удалить только головку поджелудочной железы вместе с частью тонкой кишки и/или желудка, желчным пузырем и общим желчным протоком. Затем тело и хвост железы подшивают к тонкой кишке, после чего они могут и дальше выполнять свои функции.
В некоторых случаях приходится удалять всю железу. После такой операции придется всю жизнь принимать ферменты и вводить инсулин.
Рак поджелудочной железы отвечает на химиотерапию и лучевую терапию. Их назначают в качестве адъювантного (для предотвращения рецидива после операции) или неоадъювантного (для сокращения размеров опухоли перед хирургическим вмешательством, перевода неоперабельного рака в операбельный) лечения. Если опухоль неоперабельна, лучевая терапия и химиотерапия становятся основными видами лечения.
У некоторых пациентов возможно применение таргетного препарата эрлотиниба (Тарцева). Он блокирует EGFR — белок-рецептор, который заставляет раковые клетки размножаться.
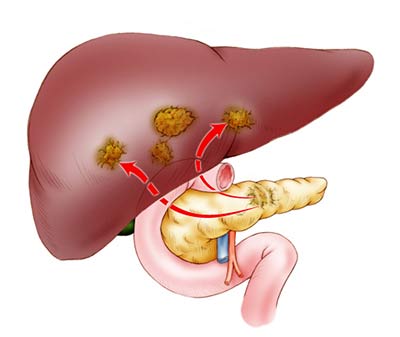
При неоперабельном раке головки поджелудочной железы облегчить симптомы и улучшить состояние пациента помогает паллиативная хирургия:
- При нарушении оттока желчи проводят стентирование желчного протока или отсекают его выше места блока и соединяют с двенадцатиперстной кишкой (такая операция называется холедохоеюностомией).
- При нарушении проходимости двенадцатиперстной кишки также можно установить стент. Если это невозможно, выполняют еюностомию — тощую кишку подшивают к коже и выводят наружу отверстие (еюностому). Через него пациент получает питание с помощью катетера.
Прогноз и выживаемость
Если рассматривать все стадии рака поджелудочной железы, то показатели выживаемости, согласно европейской статистике, будут выглядеть следующим образом:
- В течение года после того, как был установлен диагноз, в живых остаются 20% пациентов.
- В течение пяти лет — 5%.
- В течение десяти лет — 1%.
Прогноз наиболее благоприятен, если рак не успел распространиться за пределы органа. В таких случаях пятилетняя выживаемость составляет 7–25%.
Основная причина низкой выживаемости — поздняя диагностика опухолей поджелудочной железы.
Источник
