Патология островкового аппарата поджелудочной железы

Поджелудочная (панкреатическая) железа относится к органам с двойной секрецией. Внешнесекреторный аппарат железы вырабатывает составные части панкреатического сока, экскретируемо-го в двенадцатиперстную кишку. Около 1,5—2% массы железы приходится на эндокринную ткань (островки Лангерганса) — группы скоплений специальных паренхиматозных клеток. Кровоснабжение поджелудочной железы осуществляется поджелудочно-двенадцатиперстной артерией и ветвями селезеночной артерии, причем кровоснабжение островков Лангерганса существенно обильнее, чем других частей органа. Вены поджелудочной железы впадают в воротную вену через селезеночную или верхнюю брыжеечную вену. Иннервируется железа ветвями блуждающего и симпатического нервов.
В островках Лангерганса имеется несколько видов клеток: β-клетки, расположены ближе к центру островков и составляют до 60—70 % всех клеток; δ-клетки (2—8 %) — предшественники других клеток островков и α-клетки (около 25 %), находятся ближе к периферии островков. Протоплазма α- и β-клеток содержит гранулы, а δ-клетки негранулированы. α-Клетки неаргирофильны и являются местом образования глюкагона; β-клетки образуют инсулин, δ-клетки — соматотропин. РР-клетки, также имеющиеся в железе, расположены по периферии островков и в паренхиме возле протоков малого и среднего диаметра. Они секретируют панкреатический полипептид. В островках выявлено некоторое количество клеток — продуцентов вазоактивного интерстициального пептида (ВИП) и гастроинтерстициального пептида (ГИП).
Инсулин — низкомолекулярный белок с молекулярной массой около 6000 Д. В его состав входит 16 аминокислот и 51 аминокислотный остаток. В настоящее время синтезирован искусственным путем. Он образуется из проинсулина под влиянием протеаз; его активность составляет около 5 % активности инсулина. Считается, что биологический эффект инсулина связан с его способностью соединяться со специфическими рецепторами цитоплазматических мембран клеток, после чего передается сигнал на систему цАМФ через фермент аденилатциклазу оболочки клетки цАМФ, который регулирует синтез белка и утилизацию глюкозы при участии Са++ и Мg++.
С кровью инсулин поступает в печень, где около половины его инактивируется под воздействием инсулиназы, а остальная часть связывается с белками, частично оставаясь свободной.
Из печени инсулин поступает в кровь в свободном и связанном с белками состоянии. Это соотношение регулируется уровнем гликемии. При понижении сахара в крови преобладает белковосвязанная фракция, а при гипергликемии — свободный инсулин, который действует на инсулиночувствительные субстанции, а связанная фракция — только на жировую ткань, в которой имеются пептидазы, освобождающие инсулин из связанного состояния. Период полураспада инсулина — около 30 мин. Инсулин кроме печени инактивируется в жировой ткани, мышцах, почках, плаценте.
Основным биостимулятором синтеза инсулина является глюкоза, под влиянием которой в поджелудочной железе синтез инсулина повышается, а с уменьшением ее — снижается.
Стимуляторами освобождения и секреции инсулина являются также СТГ, АКТЕ, глюкокортикоиды, глюкагон, секретин, аргинин, лейцин, гастрин, бомбезин, панкреозимин, желудочный ингибитор — полипептид, нейротензин, β-адреностимуляторы, сульфаниламиды, соматостатин.
Соматостатин — 14-членный пептид, обнаружен в гипоталамусе, образуется также в δ-клетках островков Лангерганса, клетках щитовидной железы, желудка и лимфоидных органов. Он подавляет секрецию ТТГ, СТГ, АКТГ, гастрина, секретина, мотилина, ренина, вазоактивного желудочного пептида (ВЖП), панкреатических ферментов, желудочного сока; снижает перистальтику кишечника, сократимость мочевого пузыря, абсорбцию ксилозы. Под его влиянием уменьшается освобождение ацетилхолина из нервных окончаний и электровозбудимость нервов. Является ингибитором секреции инсулина и глюкагона. Парасимпатическая стимуляция увеличивает секрецию инсулина, а симпатическая — уменьшает. Важную роль в секреции инсулина играют холинэргитические волокна блуждающего нерва.
Инсулинстимулирует перенос Сахаров через мембрану клеток жировой, мышечной, почечной тканей; усиливает фосфорилирование, окисление и превращение глюкозы в гликоген и жиры; способствует превращению жирных кислот в триглицириды жировой ткани; стимулирует синтез липидов; ингибирует липолиз и активность глюкозо-6-фосфатазы; стимулирует образование макроэргических связей, транспорт аминокислот через цитоплазматические мембраны; ослабляет глюкогенолиз из белка; способствует его синтезу из аминокислот. Все ткани, кроме нервной, сетчатки, почечной и эритроцитов, чувствительны к инсулину.
Глюкагонявляется антагонистом инсулина. Это полипептид, состоящий из 29 аминокислотных остатков с молекулярной массой 3485 Д. Он усиливает распад гликогена в печени и тормозит его синтез; усиливает липолиз, гликонеогенез, биосинтез глюкозы из аминокислот; способствует снижению кальциемии и фосфатемии, выходу калия из печени, отчего наступает значительная, но скоротечная гиперкалиемия, сменяющаяся затем гипокалиемией, которая обусловлена гиперкалийурией и усилением депонирования калия клетками.
Секреция глюкагона снижается при гипергликемии, повышении в крови свободных жирных кислот и под влиянием соматостатина.
Глюкагон тормозит агрегацию тромбоцитов, способствует увеличению минутного объема кровотока. Под его влиянием увеличивается образование СТГ, инсулина, катехоламинов, кальцитонинов, выделение воды и электролитов с мочой, а секреция панк-реозимина, гастрина, панкреатических ферментов снижается.
Кроме панкреатического глюкагона известен также кишечный глкжагон, секретируемый α-клетками слизистой оболочки желудка и кишечника. Он усиливает липолиз, гликогенолиз, стимулирует секрецию инсулина. Секреция кишечного глюкагона повышается при поступлении в кишечник пищи и соединений кальция.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
И УГЛЕВОДНЫЙ ОБМЕН
Углеводы являются основным энергетическим материалом, реализующимся при распаде глюкозы в цикле Кребса (аэробном цикле трикарбоновых кислот) на Н2О и СО2. Образование гликогена из моно- и дисахаридов, гексоз и пентоз происходит под влиянием инсулина, а основное количество углеводов у жвачных расщепляется в преджелудках под воздействием микрофлоры до ЛЖК, а у моногастричных — в тонком кишечнике под влиянием ферментов поджелудочной железы (мальтазы, амилазы, лактазы) до моносахаридов. Более 85 % моносахаридов переходят в глюкозу уже в тонком кишечнике и около 15 % — в печени. В процессах фосфорилирования глюкоза является активным звеном окисления, синтеза гликогена и жира. На первом этапе фосфорилирования образуется гексозомонофосфат:
глюкоза + АТФ -> гексакиназа -> гексозомонофосфат + АДФ.
Особенностью этого превращения является то, что к молекуле глюкозы присоединяется не простая (неорганическая), а обогащенная энергией фосфорная кислота (макроэргическая связь), что делает глюкозу биологически активной, причем активатором гексокиназы в этом процессе является инсулин. Проникая через стенку кишечника и под влиянием фосфатазы дефосфорилируясь, глюкоза поступает в портальное кровообращение, теряя физиологическую активность. В печени она вторично фосфорилируется, образуя глюкозо-6-фосфат (Г-6-Ф), становясь снова физиологически активной под действием инсулина, и образует гликоген. Значение этого цикла в том, что он является единственным источником рибозо-5-фосфата, используемого в синтезе РНК. При окислении глюкозы в пентозном цикле образуется основная часть восстановленного NАДН — никотинамидадениндинуклеотида, необходимого для синтеза жирных кислот. В анаэробном цикле окисляется около 25 % Г-6-Ф, а около 55 % под влиянием глкжозо-6-фосфатазы, освобождаясь от фосфорной кислоты, из печени переходит в общий проток. 9 % из 55 (принятых за 100 %) этой глюкозы превращается в гликоген мышечной ткани, а около 30 % — в жир. Основная часть глюкозы (около 60 %) окисляется в тканях, обеспечивая энергетический баланс организма в анаэробном (с образованием молочной кислоты) и аэробном (с образованием Н2О и СО2) циклах. Молочная кислота в печени и мышцах может ресинтезироваться в гликоген, а образовавшаяся в аэробном гликолизе пировиноградная кислота декарбоксилируется с образованием ацетилкоэнзима А (ацетил-КоА), который необходим в дальнейшем синтезе жирных кислот, кетоновых (ацетоновых) тел, холестерина. В цикле ди- и трикарбоновых кислот в легких, почках, мышцах и частично в печени ацетил-КоА окисляется до Н2О и СО2, а катализатором этого процесса является инсулин. Аэробный гликолиз является наиболее эффективным — в его процессе образуется 36 молекул аденозинтрифосфорной кислоты (АТФ), тогда как в анаэробном только две молекулы АТФ.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
И ЛИПИДНЫЙ ОБМЕН
Основной резерв энергии организма — жиры. Из жировых депо жиры в виде свободных неэстерифицированных жирных кислот (НЭЖК) поступают в кровь, а затем в печень, где диализируются и используются тканями как энергетический материал. НЭЖК доставляют около 50 % тепловой энергии основного обмена.
Триглицериды жировых депо, поступая в кровь, образуют комплексы с α- и β-глобулинами и затем выходят из них в виде α- и β-липопротеидов. В норме жир в печени не задерживается, а откладывается в жировых депо. Этот процесс активируется гепарином, продуцируемым тучными клетками. Нормальными промежуточными продуктами обмена НЭЖК являются ацетоновые (кетоновые) тела, содержание которых в крови здоровых животных составляет в среднем 2—7 мг%. Кетоновые тела образуются в основном в печени. Усиленный кетоногенез (при недостаточности аэробного цикла, энергетическом голодании) — причина ацетонемии, кетоза, являющихся причиной дистрофии внутренних органов (миокарда, почек, печени), яловости, ацетонурии, ацетонолактии, «голодных» кетозов овец и свиней.
Непосредственно участвуют в обмене жиров фосфолипиды, способствующие окислению жира через стадию лецитина. Они же повышают устойчивость холестерина в крови, что препятствует его отложению в стенках сосудов.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
И БЕЛКОВЫЙ ОБМЕН
Более половины белков сыворотки крови (6—8 г%) составляют альбумины. Остальная часть их представлена α1-, α2-, β- и γ-глобулинами.
Альбумины синтезируются в паренхиматозных клетках печени, а глобулины — в ретинулоэндотелиальной системе (РЭС). Все питательные вещества в процессе обмена между кровью и клетками тканей проходят через основное вещество соединительной ткани, важнейшими элементами которой являются коллагеновые и эластические волокна белковой природы. Из этого следует, что любой фактор или состояние, влияющие на обмен белка, оказывают воздействие и на них.
Высокомолекулярные линейные полиэлектролиты соединительной ткани называются кислыми мукополисахаридами, а в соединении с белком — мукопротеидами (мукополисахаридными комплексами). В крови имеются также гликопротеиды — белки с содержанием около 4 % избытка глюкозамина.
Повышение белкового синтеза происходит под влиянием инсулина вследствие усиления переноса аминокислот в цитоплазму, активации ферментов пептидного цикла и усиления утилизации глюкозы (источника энергии макроэргических связей). Наряду с инсулином синтез белка стимулирует соматотропный гормон гипофиза (СТГ). Наоборот, АКТЕ, ТТГ, глюкокортиноиды, гормоны щитовидной железы стимулируют диализ белка до аминокислот.
САХАРНЫЙ ДИАБЕТ
Сахарный диабет представляет собой синдром хронической гипергликемии вследствие генетических и экзогенных факторов на почве абсолютного или относительного дефицита инсулина, сопровождающийся нарушением промежуточного обмена, особенно углеводного. Принято выделять три пути развития инсулинзави-симого сахарного диабета: 1) предрасположенность к аутоиммунному нарушению островков Лангерганса; 2) повышенная чувствительность β-клеток к вирусам и 3) ослабление противовирусного иммунитета. Чаще возникает в критические периоды — максимального роста и продуктивности, гормональной, иммунологической и других видов перестройки.
Сахарный диабет может возникать вторично — при панкреатитах, кистах, опухолях поджелудочной железы, гемохроматозах, особенно при эндокринных нарушениях других желез внутренней секреции, от ятрогенных причин, длительного применения диуретиков (особенно диазидов, кортикостероидов), при нарушениях кормления (длительное кормление турнепсом, брюквой, репой, капустой). Он чаще бывает вследствие относительной внепанкреатической инсулиновой недостаточности, чем абсолютной (панкреатической).
Патогенез инсулинзависимого сахарного диабета связан с деструкцией β-клеток, что приводит к абсолютному недостатку инсулина — «вирусному» или аутоиммунному. Повреждение более 90 % клеток поджелудочной железы приводит к развитию клинических симптомов диабета.
При дефиците инсулина понижается проницаемость для глюкозы цитоплазматических мембран в мышечной и жировой тканях, снижается ее фосфорилирование и окисление глюкозы, переход в спирт, усиливается гликонеогенез из белка и выделение углеводов из печени в кровь. Это приводит к неполной утилизации углеводов тканями — гипергликемии. В крови повышается содержание молочной кислоты — продукта анаэробного гликолиза. Возникает глюкозурия, полидипсия, ацетонемия, гипергликемия, что приводит к повышению осмотического давления крови и нарушению функций ЦНС. Нарушается липидный обмен (увеличение содержания в крови НЭЖК). Печень подвергается жировой дистрофии. Возрастает холестеринемия. Снижение концентрации фосфолипидов, гиперхолестеринемия, повышение содержания β-липопротеидов при диабете предрасполагают к ангиопатиям, атеросклерозу. Липоидозу способствует уменьшение расщепления триглицеридов в стенке сосудов, нарушается синтез, усиливается распад белков. Содержание альбуминов снижается, α1-, β – и γ-глобулинов повышается, что связано как с недостатком инсулина, так и с недостаточностью гипофиза, надпочечников и половых желез. Это приводит к ретенционной азотемии и гиперазотурии. Нарушение промежуточного обмена приводит к снижению сопротивляемости инфекциям, тяжелым ангиопатиям.
В клинической стадии на передний план выступают полидипсия, полифагия, сухость слизистых ротовой полости, полиурия, ацетонурия, ацетонолактия, ацидоз, общая слабость, снижение и утрата продуктивных показателей, зудливость, сухость кожи, остеопороз, костно-суставная патология, изменения ЭКГ, протеинурия, ретинопатия, возможны гангрена конечностей, хвоста, нарушение пищеварения, признаки нарушения функций ЦНС, гипергликемическая кома.
Для диагностики редких форм сахарного диабета применяют исследование «сахарной кривой» — динамики уровня сахара в крови после сахарной нагрузки. Чем медленнее возвращается уровень гликемии к исходному показателю (до сахарной нагрузки), тем сильнее выражен сахарный диабет.
Источник
Поджелудочная железа лежит позади желудка, рядом с двенадцатиперстной кишкой. Это железа смешанной функции. Эндокринную функцию осуществляют клетки поджелудочной железы, расположенные в виде островков (островки Лангерганса).Островки Лангерганса вырабатывают инсулин или антидиабетический гормон.
Инсулин действует главным образом на углеводной обмен, оказывая на него влияние, противоположное адреналину. Если адреналин способствует быстрейшему расходованию в печени запасов углеводов, то инсулин сохраняет, пополняет эти запасы.
Патофизиология поджелудочной железы. При заболеваниях поджелудочной железы, приводящих к снижению выработки инсулина, большая часть поступающих в организм углеводов не задерживается в нем, а выводится с мочой в виде глюкозы. Это приводит мочеизнурению(сахарный диабет).Характерные признаки диабета- постоянный голод, неудержимая жажда, обильное выделение мочи и нарастающее исхудание.
Гипогликемия характеризуется понижением содержания сахара в крови и может возникнуть при передозировке инсулина. Если не принять мер, может развиться гипогликемическая кома.
9. Половые железы, внутрисекреторная функция. Физиологическая роль половых желез в организме. Патология половых желез. Особенности нарушения функций половых желез в детском возрасте.
Половые гормоны вырабатываются половыми железами, которые относятся к числу смешанных, так как часть их клеток выполняет внешнесекреторную функцию, другая часть- внутрисекреторную. Половые гормоны в течение всей жизни оказывают мощное влияние на формирование тела, обмен веществ и половое поведение.
Мужские половые гормоны(андрогены)вырабатываются особыми клетками семенников. Они выделены из экстрактов семенников, а также из мочи мужчин.
Истинным мужским половым гормоном является тестостерон и его производное – андростерон. Они обусловливают развитие полового аппарата и рост половых органов, развитие вторичных половых признаков: огрубление голоса, изменение телосложения – шире становится плечи, увеличиваются мышцы, усиливается рост волос на теле и лице. Совместно с гормонами гипофиза тестостерон активирует сперматогенез (созревание сперматозоидов).
Женские половые гормоны-эстрогены вырабатываются в яичниках. Они оказывают влияние на развитие половых органов, выработку яйцеклеток, обусловливают подготовку яйцеклеток к оплодотворению, матки- к беременности, молочных желез- к кормлению ребенка.
Истинным женским половым гормоном считают эстрадиол. К женским половым гормонам относится и прогестерон-гормон беременности(гормон желтого тела).
Патология половых желез.При гиперфункции семенников в раннем возрасте отмечается преждевременное половое созревание, быстрый рост тела и развитие вторичных половых признаков. Поражение семенников или их удаление(кастрация) в раннем возрасте вызывает прекращение роста и развития половых органов; вторичные половые признаки не развиваются, увеличивается период роста костей в длину, отсутствует половое влечение, не растут волосы на лице, голос сохраняется высоким в течении жизни.
Гиперфункция яичников вызывает ранее половое созревание с выраженными вторичными признаками и менструацией. Описаны случаи раннего полового созревания девочек в 4-5 лет.
Источник

Описание
Глаукома — весьма распространенное заболевание. Среди лиц старше 40 лет она встречается ов 1—1,5% случаев. В подавляющем большинстве случаев она развивается на фоне других общих заболеваний (атеросклероз, гипертоническая болезнь, сахарный диабет и др.).
Различают первичную и вторичную глаукому. Первичной называют глаукому, развивающуюся вне связи с заболеваниями глаза, вторичная глаукома возникает как следствие предшествовавшего заболевания глаза (набухающая катаракта, воспаление сосудистого тракта, внутриглазная опухоль, травмы и др.).
Изучению частоты возникновения глаукомы при общих заболеваниях (атеросклероз, гипертоническая болезнь и др.), в том числе при сахарном диабете, в настоящее время уделяется особое внимание. Установлено, что у больных сахарным диабетом глаукома встречается чаще (в 4,7—14% случаев), чем у лиц, не страдающих этим заболеванием [Кашинцева Л. Т, 1977]. Поэтому вопрос о широком охвате лиц старше 40 лет профилактическими осмотрами с измерением внутриглазного давления является весьма актуальным. У больных сахарным диабетом измерение внутриглазного давления должно проводиться регулярно и в более молодом возрасте. С другой стороны, всех больных глаукомой нужно исследовать для выявления возможно имеющегося у них сахарного диабета. По некоторым данным, при первичной глаукоме впервые выявляется свыше 20% больных сахарным диабетом (латентным и явным).
Имеется много сведений о частоте нарушения гидродинамики глаза у больных сахарным диабетом. Убедительные данные получены Л. Т. Кашинцевой (1977). Автором установлено, что у 1/3 больных сахарным диабетом коэффициент легкости оттока был ниже нормального, что свидетельствует об увеличении сопротивления оттоку камерной влаги. Внутриглазное же давление может оставаться нормальным за счет компенсаторного снижения продукции внутриглазной жидкости. При длительном и тяжелом течении сахарного диабета компенсаторные возможности уменьшаются. Повышение сопротивления оттоку внутриглазной жидкости может быть вызвано изменениями в иридокорнеальном углу и в дренажной системе глаза.
У больных сахарным диабетом иридокорнеальный угол чаще бывает средней ширины, реже узкий и очень узкий и еще реже широкий. Пигментация угла, гониосинехии у больных сахарным диабетом (рис. 65)
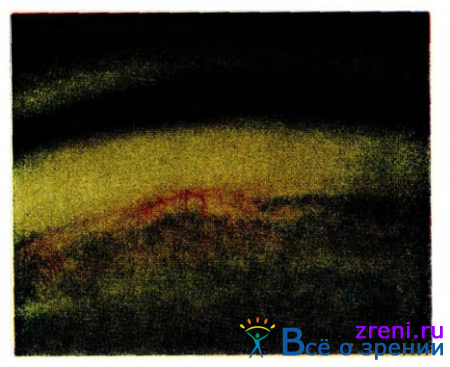
Рис. 65. Рубеоз радужной оболочки, гониосинехии.
встречаются чаще. Гистоморфологические изменения показали, что ткани дренажной системы глаза у больных сахарным диабетом резко изменены. Данные этих исследований дают основание считать, что одной из непосредственных причин расстройства гидродинамики глаза являются патологические изменения именно в дренажной системе [Кашинцева Л. Т., 1977].
Следует отметить, что изменения угла передней камеры глаза у больных сахарным диабетом могут создать не только предпосылки для развития глаукомы, но и явиться их следствием.
Колебания уровня сахара крови оказывают известное влияние на уровень внутриглазного давления. Сопоставления амплитуды колебаний уровня гликемии и амплитуды колебаний уровня внутриглазного давления в течение суток у больных сахарным диабетом показало, что у большинства больных амплитуда колебаний уровня внутриглазного давления в течение суток была значительной, но строгой зависимости их от уровня гликемии не отмечалось [Асадулина М. М., Марголис М. Г., 1971].
Приведенные данные о частоте возникновения глаукомы у больных сахарным диабетом свидетельствуют о большом значении в патогенезе глаукомы расстройств инсулярного аппарата поджелудочной железы.
В профилактике глаукомы большое значение имеет раннее распознавание сахарного диабета. Больным с клинически выраженным, а также с латентным диабетом необходимо регулярно (не менее 1 раза в 6 мес) измерять внутриглазное давление, а также при необходимости проводить и другие исследования.
Предрасположенность больных сахарным диабетом к нарушению регуляции внутриглазного давления следует учитывать как офтальмологам, так и терапевтам и эндокринологам.
Изменения зрительного нерва при сахарном диабете встречаются, по данным различных авторов, у 0,6—24,3% больных. Характер поражения зрительного нерва при сахарном диабете различен. Может возникнуть ретробульбарный неврит, почти всегда двусторонний. В случаях, когда процесс захватывает не только ствол зрительного нерва, но и хиазму, зрительные тракты, появляется и соответствующая симптоматика (гомонимная или гетеронимная гемианопсия и др.). Некоторые авторы находят при сахарном диабете и другие изменения зрительного нерва (отек, гиперемия) [Fischer F, 1966]. Гиперемию диска зрительного нерва, перипапиллярный отек нередко отмечали в своих исследованиях Н. Б. Шульпина, М. Г. Марголис (1969). Эти изменения наблюдались при диабето-гипертонической и диабето-почечной ретинопатии.
Существует представление, что ретробульбарный неврит вызывается инфекционным или токсическим началом на фоне нарушенных метаболических процессов, свойственных сахарному диабету. Возникновение ретробульбарного неврита связывают и с дефицитом витамина В12, что согласуется с наблюдениями улучшения течения процесса у больных сахарным диабетом при введении данного витамина [Fischer F, 1961]. Это заболевание рассматривают и как первичный дистрофический процесс, обусловленный токсическим началом [Трон Е. Ж, 1962], и, наконец, предполагают, что вовлечение в процесс зрительного нерва при сахарном диабете является следствием поражения капилляров в поверхностных участках диска зрительного нерва аналогично капиллярным изменениям при диабетической ретинопатии [Vanko L. et al, 1972]. На основании гистологических исследований отрезков зрительных нервов глаз, энуклеированных после смерти, сделан вывод о вторичной нисходящей дистрофии некоторых нервных волокон [Вгоser G. et al, 1967].
При сахарном диабете наиболее часто поражается отводящий нерв, в результате чего возникает парез или паралич латеральной прямой мышцы. Иногда поражаются глазодвигательный и блоковый нервы, что влечет за собой парез и паралич мышц века и глазного яблока, иннервируемых названными нервами. Возможно и поражение лицевого нерва. Одни авторы рассматривают эти поражения как воспалительный процесс, возникающий на фоне нарушенного обмена веществ, другие как результат сосудистых расстройств. Прогноз обычно благоприятный.
При сахарном диабете наблюдаются и зрачковые расстройства: миоз, анизокория, симптом Аргайла Робертсона, а также нарушение реакции на аккомодацию при сохранении реакции на свет, понижение реакции на свет и на средства, расширяющие зрачок.
Возникновению катаракты нередко предшествует развитие миопии (иногда значительной), что обусловлено увеличением преломляющей силы хрусталика. При сахарном диабете это выражено особенно сильно.
При сахарном диабете наблюдается транзиторное изменение рефракции как в сторону усиления, так и в сторону ослабления. Это обусловлено состоянием аккомодативного аппарата. Особенно часто значительные колебания рефракции наблюдаются у больных с лабильным течением сахарного диабета, когда уровень гликемии изменяется в больших пределах. При снижении уровня гликемии рефракция ослабляется, а при повышении усиливается, что особенно выражено у молодых людей.
Транзиторное изменение рефракции может возникнуть при использовании гипогликемизирующих препаратов (сульфаниламиды). Возникающую близорукость рассматривают как аллергическую реакцию, выражающуюся в спазме аккомодации.
Диабетическая кома. Вследствие нарастающей инсулиновой недостаточности и нарушения усвоения тканями глюкозы возникает кетоацидоз, увеличивается (в 10 и более раз) содержание в крови кетоновых тел. Выраженный кетоацидоз приводит к кетоацидотической (диабетической) коме, которая развивается медленно. Появляется слабость, апатия, теряется аппетит, увеличивается жажда, полиурия, возникает тошнота, головная боль, боль в подложечной области и в конечностях, сонливость, учащается и углубляется дыхание. В дальнейшем появляется рвота, дыхание становится более глубоким и шумным, выдыхаемый воздух приобретает запах ацетона. Сонливость увеличивается, может наступить потеря сознания. В результате дегидратации резко понижается внутриглазное давление, что легко определяется наощупь. Понижение внутриглазного давления иногда сопровождается сморщиванием хрусталика, возникновением складчатости его капсулы и даже помутнением хрусталика. Зрачки обычно сужены. Кожа сухая, холодная, слизистая оболочка полости рта также становится сухой, температура тела снижается, артериальное давление понижается, мышцы часто расслабляются, сухожильные рефлексы снижаются. Гипергликемия может достигнуть 1000 мг%, уровень кетоновых тел возрастает до 60 мг% и выше, в крови обычно лейкоцитоз. Глюкозурия высокая (выше 4%), реакция мочи на ацетон резкоположительная.
Гипогликемическая кома имеет быстрое начало, она возникает в результате снижения уровня гликемии под влиянием инсулинотерапии до 70—50 мг% (по Хагедорну—Йенсену). Первые признаки гипогликемии: общая слабость, потливость, повышенная возбудимость, головная боль, тремор рук, головокружение, покраснение или, наоборот, побледнение лица, часто чувство мучительного голода. Эти явления могут нарастать, сопровождаться тоническими и клоническими судорогами, сдвигами в психике, потерей сознания. Наблюдаются зрительные расстройства, которые выражаются в том, что изображения предметов становятся расплывчатыми, последние иногда кажутся либо большего размера, чем в действительности, либо меньшего. Появляется двоение (диплопия), выпадение поля зрения (скотомы). В начальных фазах гипогликемической комы отмечается расширение зрачков, при глубокой коме — сужение их и отсутствие зрачковых реакций на свет. Указанные изменения развиваются не в результате местных поражений, а вследствие поражения центральной нервной системы. При гипогликемической коме иногда наблюдается понижение внутриглазного давления, но в меньшей степени, чем при диабетической коме.
Для дифференциальной диагностики важно знать признаки, отличающие гипогликемическую кому от гиперкетонемической. При гипогликемической коме отсутствует запах ацетона в выдыхаемом воздухе больного, кожа у него влажная, пульс обычный, сухожильные рефлексы понижены или отсутствуют. Кетонурии не отмечается, уровень гликемии снижен, содержание кетоновых тел в крови нормальное, количество лейкоцитов также в норме.
Гиперосмолярная кома возникает в основном в результате высокой гипергликемии и гиперосмолярности крови, что ведет к сгущению ее и сильному обезвоживанию организма. Кетоацидоза и ацетонурии не наблюдается, в выдыхаемом воздухе больного запах ацетона не ощущается.
Гиперосмолярная кома обычно развивается у пожилых и старых людей при нетяжелой форме сахарного диабета постепенно (в течение нескольких часов или дней). Сознание расстраивается в различной степени, дыхание становится поверхностным и учащенным, возникают тахикардия, аритмия, понижение артериального давления. Отмечается сухость кожи, слизистых оболочек, языка, понижение внутриглазного давления, в крови — высокий лейкоцитоз.
Гиперинсулинизм — это состояние организма, при котором продукция инсулина повышена по сравнению с физиологическим уровнем.
Ниже будут описаны лишь те формы гиперинсулинизма, при которых наблюдаются гипогликемические состояния.
Различают две формы такого гиперинсулинизма: первая форма обусловлена опухолями (инсулинпродуцирующими) островкового аппарата поджелудочной железы, вторая развивается под влиянием различных алиментарных факторов [Баранов В. Г, 1977].
Инсулинпродуцирующая опухоль — инсулинома может быть доброкачественной (аденома) и злокачественной (аденокарцинома). Инсулиномы в основном локализуются в поджелудочной железе, но изредка в сальнике, стенках желудка, двенадцатиперстной кишки и др. Аденокарцинома обычно бывает более крупных размеров, чем аденома.
Наиболее часто гипогликемические состояния при указанных опухолях возникают натощак и после голодания. Они обусловлены снижением уровня истинной глюкозы крови ниже 40— 50 мг%!.
При гиперинсулинизме, возникающем под действием алиментарных факторов, гипогликемические состояния также возникают обычно натощак, через несколько часов после приема пищи, а также после голодания и в большинстве случаев не бывают тяжелыми. Клиника гипогликемических состояний и глазных симптомов при них описана выше.
—
Статья из книги: Патология органа зрения при общих заболеваниях | Комаров Ф.И., Нестеров А.П., Марголис М.Г., Бровкина А.Ф.
Источник
