Ошибки при кт поджелудочной железы
Травмы поджелудочной железы составляют менее 10 % всех травм брюшной полости. Большая часть повреждений этого органа — результат тупой травмы живота. Удар об рулевое колесо во время столкновений транспортных средств, травмы от ремня безопасности и повреждения, связанные с огнестрельным оружием, являются распространенными причинами травм поджелудочной железы у взрослых. В то же время у детей наиболее распространенной причиной травмы поджелудочной железы является удар об велосипедную ручку или прямой удар. Спортивные травмы и падения на верхнюю часть живота являются менее распространенными причинами. Дети более восприимчивы к травме поджелудочной железы, по сравнению со взрослыми, из-за меньших защитных возможностей брюшной жировой клетчатки.
Селезенка, левая почка и дистальный отдел двенадцатиперстной кишки могут быть повреждены вместе с телом и хвостом поджелудочной железы в результате тупой травмы, приходящейся на левую половину живота. Печень, желчный пузырь и правая почка могут быть одновременно повреждены при травме правой половины живота.
В целом, последствия травмы поджелудочной железы лучше всего оцениваются с помощью КТ с наложением срезов и последующей реконструкцией.
Травма поджелудочной железы часто упускается из виду. В первые 2–3 часа после травмы больной может вообще ни на что не жаловаться, а после — иметь жалобы, которые не отражают истинной тяжести его состояния.
Физикальное обследование тоже зачастую малоэффективно, потому что ранние клинические признаки травмы неясны при осмотре. Визуально у больного могут определяться кровоподтеки в боковых и/или периумбиликальной областях, при пальпации возможна болезненность в эпигастрии. Но все эти признаки не патогномоничны и не говорят о повреждении поджелудочной железы однозначно
Повышенные уровни сывороточной амилазы и липазы также имеют ограниченную ценность, поскольку этот симптом может наблюдаться при других повреждениях органов брюшной полости, к тому же повышение может отсутствовать в течение 6 ч после травмы. И все же стойкое повышение этих двух показателей может указывать на патологические процессы в поджелудочной железе.
Важно. Ранняя диагностика и лечение повреждений поджелудочной железы имеют решающее значение. Пациенты, которые подвергаются оперативному вмешательству в течение 24 часов, имеют более низкую смертность.
Очевидно, что необходима высокая степень клинической настороженности, чтобы повреждения поджелудочной железы не оставались незамеченными. Если в анамнезе встречаются тупые травмы верхней части живота и повышенные уровни сывороточных ферментов, стоит задуматься о повреждении поджелудочной железы.
Мультиспиральная КТ (МСКТ) обладает чувствительностью, приближающейся к 80 %, и является основным методом визуализации, используемым при оценке пациентов с травмами. МСКТ чувствительна в 91 % случаев и специфична в 90 % при выявлении повреждений протоков поджелудочной железы, а полученные изображения МСКТ с использованием контраста во время портально-венозной фазы и вовсе являются наиболее точными в случае обнаружения повреждений паренхимы и протоков поджелудочной железы. Изображения МСКТ могут быть полезны при определении глубины разрывов поджелудочной железы и повреждения протоков.
Результаты МСКТ при травмах поджелудочной зависят от времени: иногда результаты визуализации не информативны в течение 6–12 ч после травмы. Повреждение поджелудочной железы может быть скрыто помехами, связанными с повреждением соседнего органа или близким наложением фрагментов поврежденной поджелудочной железы. Постепенное развитие перипанкреатического воспаления, отека железы и забрюшинной клетчатки становится заметным при последующих МСКТ.
Таким образом, повторное сканирование через 12–24 ч обычно полезно для пациентов с серьезным подозрением на повреждение поджелудочной. Последующие компьютерные томографии часто выполняются пациентам с одновременными повреждениями нескольких органов брюшной полости, поэтому внимание к поджелудочной железе на этих сканированиях может помочь обнаружить ранее не диагностированные повреждения поджелудочной железы.
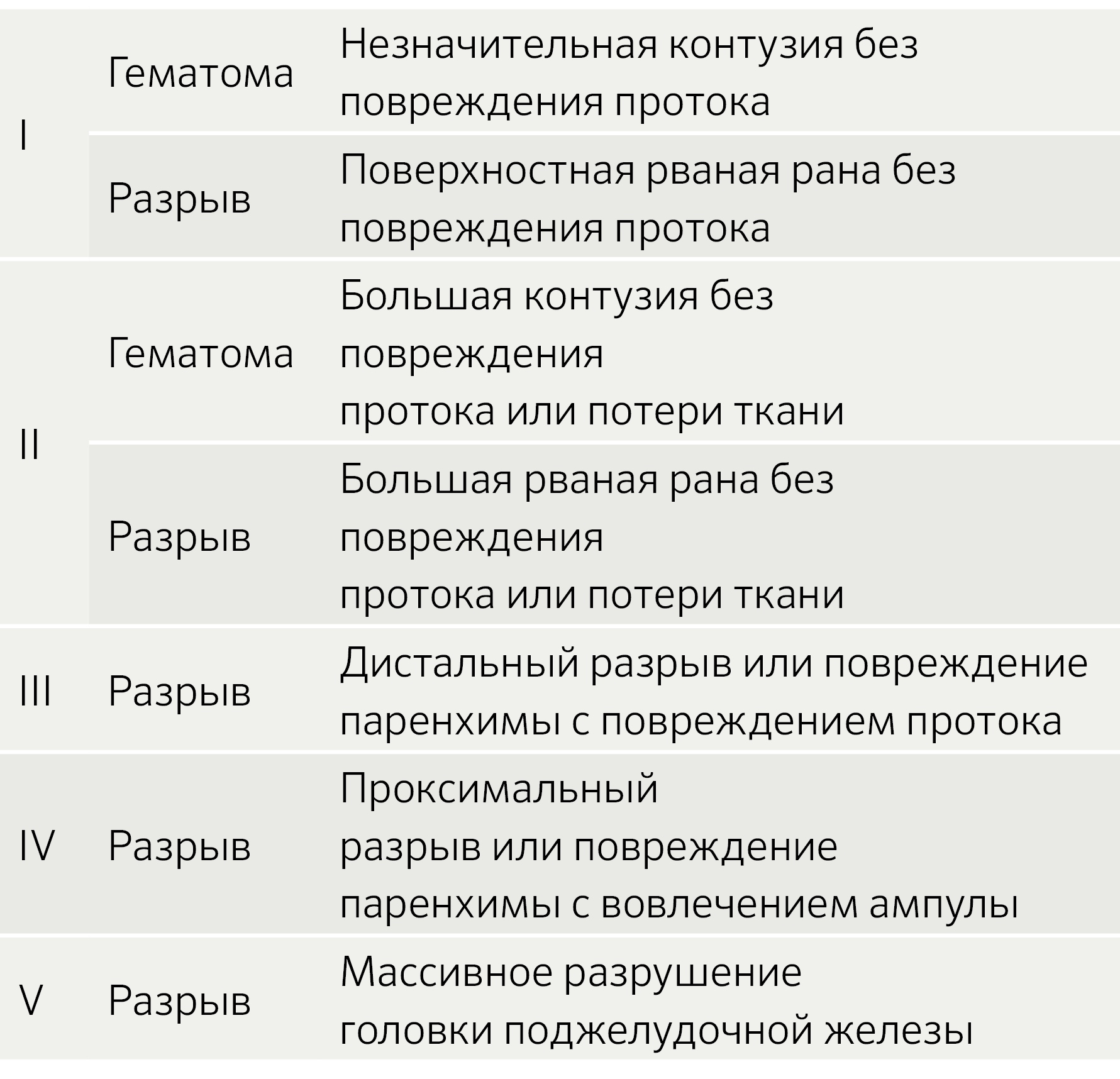
Шкала повреждений органов (Organ Injury scale — OIS) Американской ассоциации хирургии травм (AAST) по тяжести повреждений поджелудочной железы является наиболее широко принятой системой классификации повреждений поджелудочной железы (таблица 1).
Таблица 1. Шкала AAST OIS (American Association for the Surgery of Trauma) для травм поджелудочной железы.
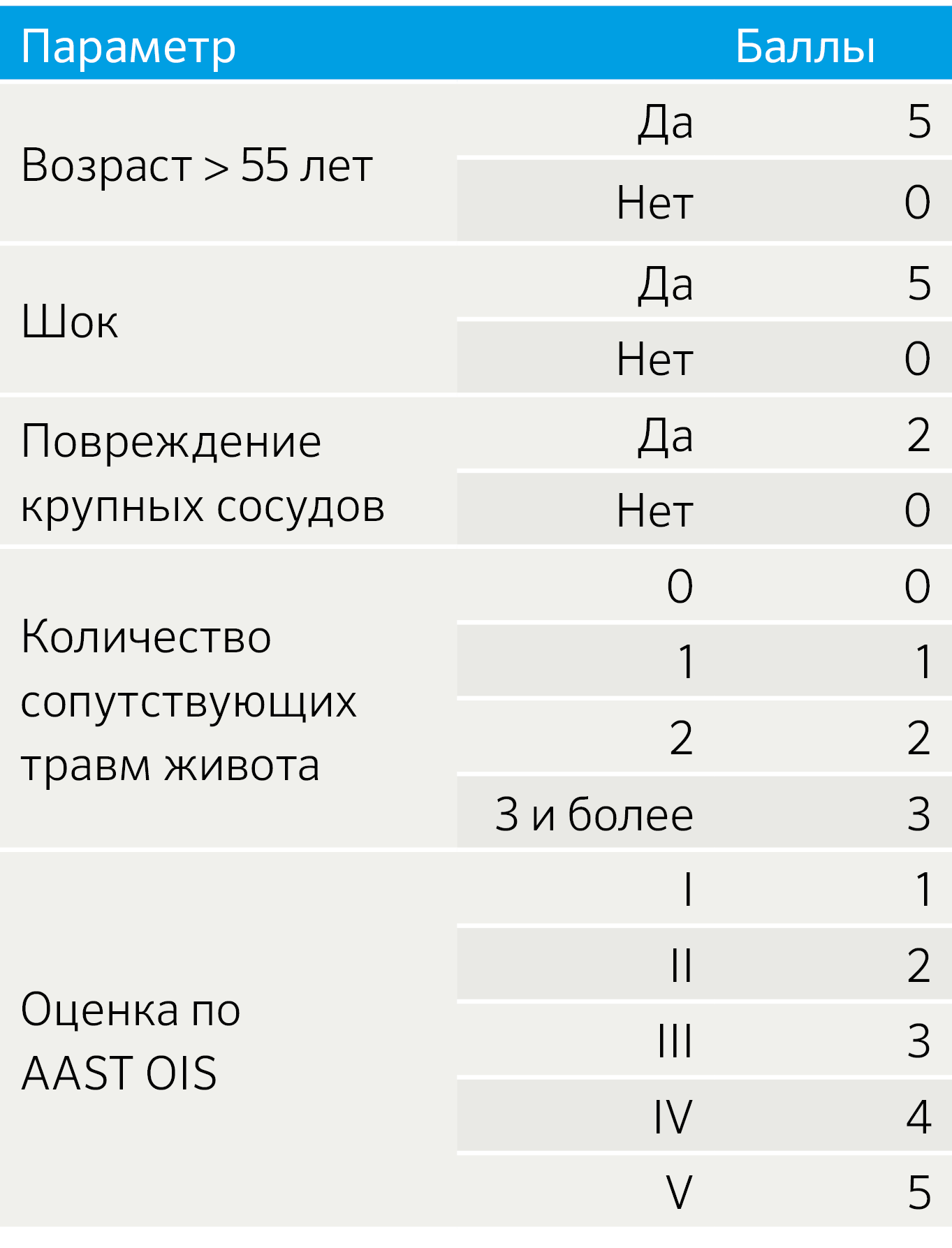
В то же время система оценки OIS описывает повреждение поджелудочной железы с точки зрения анатомического расположения и вовлечения протока, но не учитывает состояние пациента, что имеет высокую прогностическую ценность для клинического исхода. Криге и соавторами опубликована шкала оценки смертности от травм поджелудочной железы (Pancreatic injury mortality score, PIMS) (таблица 2), которая учитывает такие переменные, как: возраст > 55 лет; шок при поступлении, масштаб травмы поджелудочной железы и сопутствующие заболевания. Повреждение протока не может быть визуализировано на МСКТ, но может быть выведено на основе глубины разрыва паренхимы поджелудочной железы.
Таблица 2. Шкала PIMS
Расшифровка:
— 0–4 балла — низкий риск летального исхода;
— 5–9 баллов — средний риск летального исхода;
— 10 и более баллов — высокий риск летального исхода.
Модифицированная КТ-градация повреждения поджелудочной железы, предложенная Wong и соавторами (таблица 3), — еще одна система, используемая для определения повреждения протоков. Эта оценка основана на наличии или отсутствии разрывов поджелудочной железы, месте разрывов и глубине разрывов. Травмы класса А описывают разрыв, включающий менее 50 % толщины поджелудочной железы, обычно без повреждения протока; травмы класса В и С происходят слева или справа от верхней брыжеечной артерии, соответственно включают более 50 % толщины поджелудочной железы и обычно сопровождаются повреждением протока.
Таблица 3. КТ классификация травм поджелудочной железы

На КТ поджелудочной железы при травмах OIS I и II степени проявляются слабо контурирующие «потухшие» участки на фоне нормальной паренхимы или очаговое или диффузное расширение поджелудочной железы. Незначительная контузия (I степень) (изображение 1) включает одну анатомическую область поджелудочной железы, при II степени травмы (изображение 2) задействуется более одной анатомической области поджелудочной железы.
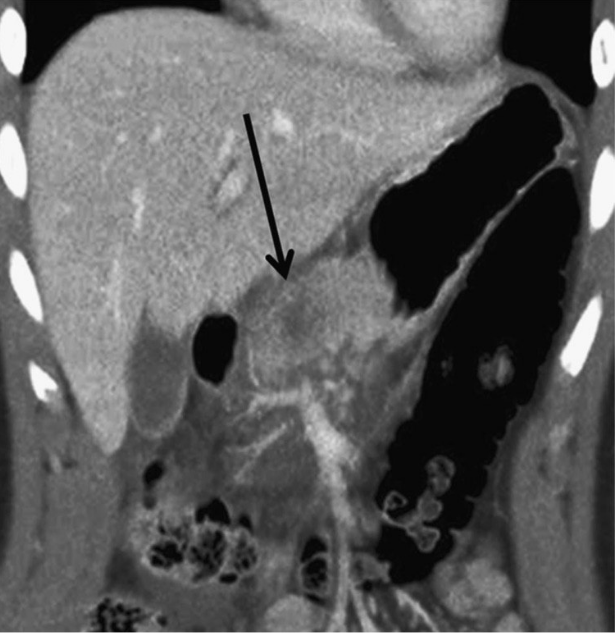
Изображение 1. Сорокадвухлетний мужчина с травмой поджелудочной железы. Изображение показывает небольшую гиподенсную область в передней части головки поджелудочной железы (стрелка), указывая на травму I степени.

Изображение 2.
18-летний мужчина с травмой живота после того, как его лягнула корова. На изображении показана большая контузия в области тела поджелудочной железы, предполагающая травму II степени (стрелка), а также перипанкреатическая жидкость.
Разрывы поджелудочной железы, наблюдаемые при III (изображение. 3) и IV (изображение 4) степенях, представляют собой линейные расщелины, перпендикулярные длиннику поджелудочной железы и заполненные жидкостью или кровью (изображение 5). Если есть четкое разделение паренхимы, возможно, присутствует разрыв поджелудочной железы. Наиболее распространенным местом разрыва поджелудочной железы является тело или головка поджелудочной железы. Поверхностные образования включают менее 50 % толщины железы, в то время как разрывы включают более 50 % железы и имеют высокую частоту сопутствующих травм. Разрыв поджелудочной железы может быть пропущена или недооценен даже при МСКТ из-за наложения фрагментов разрыва.
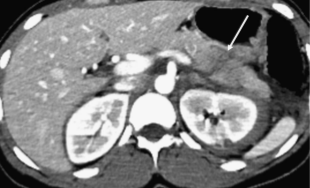
Изображение 3. 30-летняя женщина получила травму живота во время ДТП. Изображение МСКТ показывает линейный гиподенсный участок перпендикулярно длиннику поджелудочной железы в области хвоста (белая стрелка), что указывает на разрыв хвоста III степени.
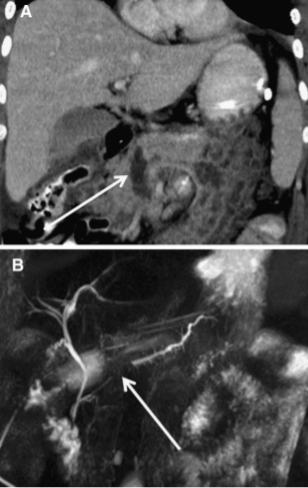
Изображение 4. 55-летний мужчина после удара бейсбольной битой по животу. На МСКТ-снимке (А) обнаружена большая рваная рана головки поджелудочной железы (стрелка), затрагивающая более 50 % толщины паренхимы и указывающая на высокую вероятность повреждения протока.
На магнитно-резонансной холангиопанкреатографии (В) у того же пациента подтверждается повреждение протока (стрелка).
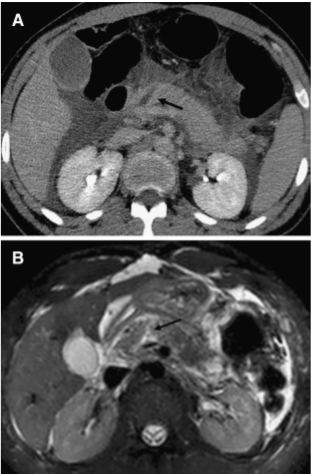
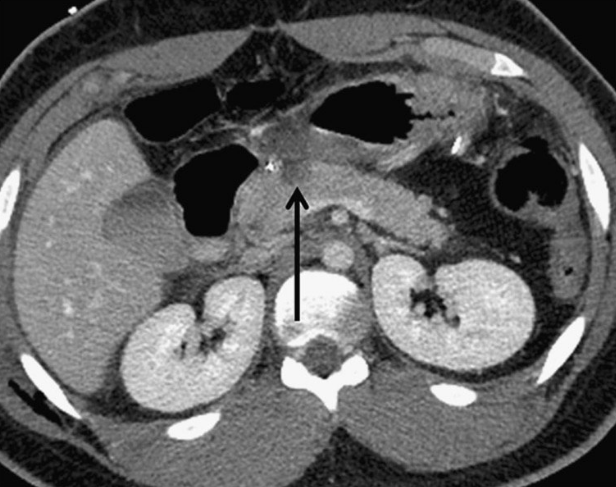
Изображение 5. Разрыв поджелудочной железы IV степени у 41-летнего мужчины, пострадавшего в результате ДТП. На МСКТ (А) показан линейный разрыв (стрелка) в головке поджелудочной железы справа от верхней брыжеечной вены.
На МРТ (В) изображение того же пациента демонстрирует разрыв в головке поджелудочной железы (стрелка).
Иногда нормальные морфологические расщелины поджелудочной железы, заполненные жиром, окружающим интрапанкреатические сосуды, могут быть неправильно истолкованы как разрыв тканей железы (изображение 6).
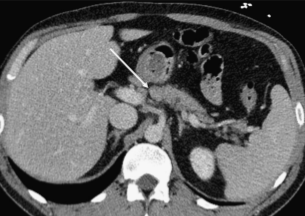
Изображение 6. Панкреатическая расщелина (стрелка) может быть ошибочно принята за разрыв поджелудочной железы, часто наблюдается в месте соединения головки и тела и содержит жировую ткань.
Интрапанкреатические гематомы также считаются весьма специфическим признаком травм поджелудочной железы и на МСКТ проявляются как скопление жидкости или крови внутри паренхимы, либо в пределах разрыва или расширения пространства между фрагментами железы и/или в области перипанкреатической ткани (изображение 7).
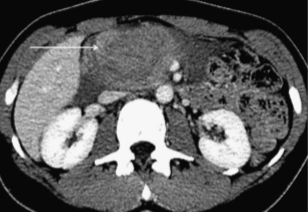
Изображение 7. Гематома поджелудочной железы у 32-летнего мужчины, попавшего в автомобильную аварию. На МСКТ-изображении показана большая гематома (стрелка) в головке поджелудочной железы. Отсутствует активная экстравазация из близлежащих брыжеечных сосудов.
Травма поджелудочной железы V класса (изображение 8) включает в себя серьезное повреждение поджелудочной железы и связана с множественными травмами других органов.Такие пациенты, как правило, гемодинамически нестабильны и имеют высокий риск летального исхода.
Вместо заключения
МСКТ — не единственный метод визуализации. В процессе диагностики большой интерес представляют МР-холангиопанкреатография, МРТ и ЭРХПГ. О них расскажем в следующий раз.
МСКТ же обладает исключительной ценностью в случае с травмой поджелудочной железы благодаря скорости, возможности быстрого и подробного обзора органов брюшной полости и эффективному выявлению тяжелых повреждений поджелудочной железы и других органов.
Список литературы
- Choron RL, Efron, DT, et al. (2018) Isolated and Combined Duodenal and Pancreatic Injuries: A Review and Update. Curr Surg Rep 6: 20. 7. Grunherz L, Jensen KO, Neuhaus V, Mica L, Werner CML, Ciritsis, et al. (2018)
- Early computed tomography or focused assessment with sonography in abdominal trauma: what are the leading opinions? Eur J Trauma Emerg Surg 44: 3-8. 8. Teh SH, Sheppard BC, Mullins RJ, et al. (2007)
- Diagnosis and management of blunt pancreatic ductal injury in the era of high-resolution computed axial tomography. Am J Surg 193:641–643.
- Wong YC, Wang LJ, Fang JF, Lin BC, Ng CJ, Chen RJ, et al. (2008) Multidetector-row computed tomography [CT] of blunt pancreatic injuries: can contrast-enhanced multiphasic CT detect pancreatic duct injuries? J Trauma. 64[3]:666-72. 10.
- Juza RM, Pauli, et al. (2019) Endoscopic Management of Acute Biliopancreatic Disorders. J Gastrointest Surg 23: 1055. 11. Cirillo RL Jr, Koniaris LG, et al. (2002) Detecting blunt pancreatic injuries J Gastrointest Surg. Jul-Aug; 6[4]
Источник
Рак поджелудочной железы (ПЖ) имеет наихудший прогноз среди всех злокачественных опухолей органов пищеварения. Опухоль распространяется на общий желчный проток, двенадцатиперстную кишку, паравазальные соединительные структуры, нервные волокна, лимфатические сосуды и лимфатические узлы вокруг общей печеночной артерии, верхних брыжеечных сосудов, чревного ствола, селезеночных сосудов. Периневральная внеорганная инвазия обнаруживается у 81-100% больных протоковым раком ПЖ [1, 4, 10, 13]. Хирургическое удаление опухоли продолжает оставаться единственным методом радикального лечения больных раком поджелудочной железы, которое позволяет получать обнадеживающие результаты. В свою очередь полнота хирургической резекции (R0/R1/R2) зависит от точности предоперационного и интраоперационного выявления опухоли [5, 6, 8, 12]. Тяжелый прогноз рака ПЖ ставит проблему своевременной диагностики в ряд наиболее актуальных. КТ признана «золотым стандартом» в диагностике рака ПЖ [2, 3, 9, 14].
Несмотря на большой прогресс в разработке новых методов обследования, только около 50% неоперабельных опухолей ПЖ диагностируются до операции и около 10% опухолей ложно диагностируются как нерезектабельные [4, 5, 11]. У 21-55% больных на дооперационном этапе при КТ ошибочно диагностируют опухоль ПЖ как резектабельную, только чтобы интраоперационно убедиться в обратном. Наиболее частой причиной ошибки является вовлечение магистральных сосудов, канцероматоз или метастазы в печень маленького размера (<15 мм) [3, 13]. Чтобы избежать диагностических ошибок при оценке сосудистой инвазии и повысить точность определения резектабельности и нерезектабельности опухоли, необходимо четкое представление о КТ-критериях вовлечения хирургически значимых сосудов панкреатогепатобилиарной области [14].
Цель настоящего исследования – изучить возможности КТ с болюсным контрастным усилением при обследовании больных раком ПЖ и при оценке резектабельности опухоли на дооперационном этапе лечения.
За период с января 2004 по май 2011 г. в Институте хирургии им. А.В. Вишневского обследованы 174 человека с объемными образованиями ПЖ, требующими проведения комплексной диагностики (67 женщин, средний возраст 58±0,9 года и 107 мужчин, средний возраст 59±1,1 года).
У всех пациентов на дооперационном этапе было выполнено КТ-исследование органов брюшной полости (СКТ, МСКТ) с болюсным контрастным усилением, также были проанализированы дополнительные методы обследования: МРТ, УЗИ в В-режиме, дуплексное сканирование в режиме цветового допплеровского картирования, эндо-УЗИ, онкомаркеры, протоколы операций и результаты гистологического исследования.
Прямым КТ-признаком рака ПЖ являлось обнаружение гиподенсного по отношению к окружающей паренхиме очага (не менее чем на 10 ед. Н), чаще с нечеткими неровными контурами.
Непрямые КТ-признаки рака ПЖ: локальное увеличение размеров, панкреатическая и билиарная гипертензия с блоком на уровне образования, причем для рака ПЖ более характерен сигарообразный обрыв общего желчного протока, в то время как его обрыв по типу писчего пера определялся при опухоли терминального отдела общего желчного протока. Также оценивали локальную инвазию опухоли в смежные органы и/или парапанкреатические сосуды, увеличение регионарных лимфатических узлов, метастатическое поражение печени, асцит.
Для объективизации диагностических возможностей КТ понятия «резектабельность» и «операбельность» мы рассматривали отдельно. Другими словами, мы раздельно оценивали способность метода в выявлении сосудистой инвазии и определении отдаленных метастазов. В большинстве работ, посвященных данной теме, преимущественно рассчитывается усредненная точность метода в стадировании рака ПЖ, которая не дает четких представлений об истинных преимуществах и ограничениях КТ.
В нашем исследовании опухоль считалась резектабельной при отсутствии распространения на верхнюю брыжеечную артерию, чревный ствол и общую печеночную артерию.
Если имелись отдаленные метастазы (в том числе в отдаленные лимфатические узлы), инфильтративное поражение ретроперитонеальных тканей и органов, в том числе корня брыжейки толстой и тонкой кишки или брюшной аорты, ситуация расценивалась как неоперабельная.
Для компьютерно-томографической оценки распространенности опухоли на магистральные сосуды мы использовали следующую градацию:
– тип 0 – между опухолью и стенкой сосуда прослеживается сохранная жировая прослойка или неизмененная паренхима поджелудочной железы (рис. 1); Рисунок 1. Рак головки ПЖ (а, б). Тип 0. Между опухолью и стенкой сосуда прослеживается сохранная жировая прослойка или неизмененная паренхима поджелудочной железы.
Рисунок 1. Рак головки ПЖ (а, б). Тип 0. Между опухолью и стенкой сосуда прослеживается сохранная жировая прослойка или неизмененная паренхима поджелудочной железы.
– тип 1 – тесный контакт опухоли и стенки сосуда, жировая прослойка прослеживается фрагментарно (рис. 2); Рисунок 2. Рак головки ПЖ (а, б). Тип 1. Тесный контакт опухоли и стенки сосуда, жировая прослойка прослеживается фрагментарно.
Рисунок 2. Рак головки ПЖ (а, б). Тип 1. Тесный контакт опухоли и стенки сосуда, жировая прослойка прослеживается фрагментарно.
– тип 2 – жировая прослойка между стенкой сосуда и опухолью не прослеживается, сосуд инфильтрирован (рис. 3); Рисунок 3. Рак головки ПЖ (а, б). Тип 2. Жировая прослойка между стенкой сосуда и опухолью не прослеживается, сосуд инфильтрирован.
Рисунок 3. Рак головки ПЖ (а, б). Тип 2. Жировая прослойка между стенкой сосуда и опухолью не прослеживается, сосуд инфильтрирован.
– тип 3 – сосуд деформирован, просвет сужен (рис. 4); Рисунок 4. Рак головки ПЖ. Тип 3. а – каплевидная деформация ВБВ; б – сосуд деформирован, просвет сужен.
Рисунок 4. Рак головки ПЖ. Тип 3. а – каплевидная деформация ВБВ; б – сосуд деформирован, просвет сужен.
– тип 4 – опухоль прилежит к сосуду, охватывая <50% окружности сосуда (рис. 5); Рисунок 5. Рак головки ПЖ (а, б). Тип 4. Опухоль прилежит к сосуду, охватывая <50% окружности ВБА.
Рисунок 5. Рак головки ПЖ (а, б). Тип 4. Опухоль прилежит к сосуду, охватывая <50% окружности ВБА.
– тип 5 – опухоль прилежит к сосуду, охватывая >50% окружности сосуда, просвет сосуда не дифференцируется, расположен в структуре опухоли (рис. 6). Рисунок 6. Рак головки ПЖ (а, б). Тип 5. Опухоль прилежит к сосуду, охватывая >50% окружности сосуда, просвет сосуда не дифференцируется, расположен в структуре опухоли.
Рисунок 6. Рак головки ПЖ (а, б). Тип 5. Опухоль прилежит к сосуду, охватывая >50% окружности сосуда, просвет сосуда не дифференцируется, расположен в структуре опухоли.
С целью объективизации факторов, определяющих резектабельность, в нашем исследовании больные были разделены на 2 группы в зависимости от вида проведенного оперативного вмешательства. В 1-ю группу вошли 93 (53,4%) больных раком ПЖ (58 мужчин и 35 женщин, средний возраст 57,5±0,9 года) с резектабельными опухолями, которым произведена радикальная операция. 2-ю группу составил 81 (46,6%) пациент с нерезектабельным раком поджелудочной железы (49 мужчин и 32 женщины, средний возраст 60,4±1,1 года), в том числе пациенты, которым выполнены различные виды паллиативных хирургических вмешательств (включая больных, которым на дооперационном этапе планировалась операция, а во время операционной ревизии радикальное вмешательство оказалось невозможным из-за местного распространения опухоли и отдаленного метастазирования).
Мы проанализировали две группы по 11 КТ-признакам и сравнили с интраоперационными находками и результатами патоморфологического исследования.
Пользуясь описанной выше градацией контакта опухоль-сосуд (тип 0 – тип 5), у каждого больного в нашей работе (n=174) мы исследовали 8 хирургически значимых сосудов (воротную вену, селезеночную вену, верхнюю брыжеечную вену, верхнюю брыжеечную артерию, чревный ствол, общую печеночную артерию, селезеночную артерию и нижнюю полую вену), всего 1392 сосуда и сравнили данные с интраоперационными протоколами и результатами патоморфологического исследования.
В 1-й и 2-й группах исследовались онкомаркеры крови: в группе больных с резектабельными опухолями средний уровень карбоангидратного антигена 19-9 составил 657,4±279,2 ед/мл (норма 0-37 ед/мл), в группе с нерезектабельным раком – 2728,2±2212,8 ед/мл, что достоверно выше, чем в 1-й группе. Средний уровень канцероэмбрионального антигена в 1-й группе составил 6,38±1,91 нг/мл (норма 0-3 нг/мл), в группе больных с нерезектабельным раком – 24,1±15,7 нг/мл (статистически значимые различия по сравнению с 1-й группой; p<0,05).
Средний размер удаленных опухолей в 1-й группе был достоверно меньше, чем во 2-й, и составил 43,2±2,3 мм (диапазон от 15 до 100 мм), во 2-й группе – 59,6±2,8 мм (диапазон от 20 до 100 мм). В обеих группах размеры опухолей, измеренные при КТ (МСКТ)-исследовании, были значительно ниже истинных (со статистически значимым различием по сравнению с размерами, указанными в протоколах операции и патоморфологического исследования; р<0,05). В 1-й группе размер опухоли, указанный в протоколах исследования, составил 29,2±1,3 мм (диапазон от 11 до 66 мм), во 2-й – 38,1±2,0 мм (диапазон от 14 до 85 мм). Размеры опухоли, измеренные по данным КТ, совпали с истинными в 24% наблюдений, превосходили их в 1% и были недооценены в 75%.
Выявлена умеренная прямая зависимость (r=0,316) размера опухоли от степени ее дифференцировки. Подобные данные получены и в других исследованиях [1, 8].
На основании протоколов исследования мы сравнили точность всех методов инструментальной диагностики в определении размеров первичной опухоли. Хирургам и онкологам следует иметь в виду, что все методы инструментального обследования (КТ, МРТ, УЗИ, эндо-УЗИ) имеют тенденцию к занижению размеров опухоли при дооперационном стадировании больных раком ПЖ. Это может существенно влиять на объем операции и послеоперационную выживаемость, а также имеет важные последствия для неоадъювантной терапии, при планировании которой необходимо соответствующим образом расширять зону воздействия.
При нерезектабельном раке (2-й группа) опухоль достоверно чаще визуализировалась при нативном исследовании (92,6%). При внутривенном контрастировании в обеих группах аденокарциномы ПЖ в большинстве наблюдений были видны как очаги пониженной плотности («гиподенсные» образования), располагающиеся на фоне накапливающей контрастное вещество неизмененной паренхимы органа. Лишь в одном наблюдении аденокарцинома головки ПЖ выявлялась как очаг повышенного накопления контрастного вещества («гиперденсная» зона) с нечеткими контурами. При оценке денситометрических показателей в 1-й группе отмечено более интенсивное накопление контрастного средства опухолью во все фазы контрастного усиления (статистически значимые различия по сравнению со 2-й группой).
Признаки панкреатической и билиарной гипертензии встречались с приблизительно равной частотой в обеих группах. В 1-й группе достоверно чаще выявлялась неизмененная парапанкреатическая клетчатка (61,3%), в то время как в группе с нерезектабельными опухолями инфильтрация клетчатки выявлена почти у половины больных (45,7%). Также в группе больных с нерезектабельными опухолями достоверно чаще определялись увеличенные лимфатические узлы (38,3%), метастазы в печень (42%) и инвазия в смежные органы (42%).
По всем этим признакам можно говорить о наличии опухоли ПЖ и о ее операбельности, но нельзя судить о резектабельности рака. В группе больных с нерезектабельными опухолями достоверно чаще определялся тип 5 контакта опухоль-сосуд (у 30% больных хирургически значимые сосуды были охвачены опухолью более чем на >50% своей окружности). В группе с резектабельным раком наиболее часто определялся тесный контакт опухоли и стенки сосуда (тип 1 – жировая прослойка дифференцировалась фрагментарно) – 13 (14%) больных.
Для оптимизации протокола КТ-исследования больных раком ПЖ и достоверности нашего анализа все протоколы исследования были проанализированы «двойным слепым» методом двумя рентгенологами (первый – врач отделения лучевой диагностики, м.н.с. с опытом работы 4 года, второй – врач отделения лучевой диагностики, профессор с опытом работы 27 лет). На основании описания в протоколе каждый врач-рентгенолог независимо друг от друга давал свое заключение о наличии/отсутствии опухоли ПЖ, о резектабельности и операбельности опухолевого процесса. Полученные результаты сравнивали с интраоперационными данными и протоколами патоморфологического исследования. Все случаи расхождения диагноза (между рентгенологом 1 и рентгенологом 2), особенно в группе с «погранично-резектабельным» раком, были проанализированы отдельно для выявления недостатков стандартного протокола обследования и определения причины ошибочного дооперационного стадирования.
При анализе 174 протоколов КТ-исследования двумя рентгенологами отдельно друг от друга совпадение диагнозов получено только в 155 (89%) случаях из 174 (табл. 1). Таким образом, в 19 случаях, просматривая одни и те же протоколы исследования, врачи дали различные заключения о резектабельности и операбельности опухоли.
Таким образом, в 19 случаях, просматривая одни и те же протоколы исследования, врачи дали различные заключения о резектабельности и операбельности опухоли.
При анализе КТ-протоколов и заключений мы столкнулись со следующими проблемами.
1. Неинформативный протокол: «опухоль распространяется на окружающие структуры…», «образование контактирует с магистральными сосудами…», «опухоль прилежит к верхней брыжеечной артерии…».
На основании такого описания практически невозможно достоверно оценить реальную распространенность опухолевого процесса, предположить степень инвазии в сосуд или судить о резектабельности рака без повторного просмотра изображений. Если пациент пришел амбулаторно, то для адекватного стадирования опухоли и для планирования тактики ведения больного назначается повторное исследование, поэтому диагностический процесс удлиняется, а пациент получает лишнюю лучевую нагрузку.
В связи с этим мы считаем важным введение единой системы описания протокола МСКТ-исследования у пациентов с подозрением на рак ПЖ. В протоколе необходимо детально описывать соотношение опухоли и сосуда с указанием степени контакта (в градусах, процентах окружности и т.д.), с измерением протяженности поражения сосуда, а также характеристикой контура сосуда, ширины просвета и наличия контрастирования сосуда при контрастном усилении.
2. Неинформативное заключение: «образование поджелудочной железы…», «изменения поджелудочной железы…», «нельзя исключить наличие опухоли…».
При отсутствии детального описания патологических изменений в протоколе и возможности просмотра изображений самого исследования практически невозможно определить, какое заболевание подразумевал врач, делавший описание. Безусловно, бывают ситуации, в которых тяжело достоверно дифференцировать рак ПЖ от хронического панкреатита или иного заболевания. Мы считаем что предпочтительнее постановка более конкретного диагноза в заключении с описанием наиболее вероятного морфологического типа опухоли (возможно с наличием дифференциального ряда, но с понятной последовательностью предполагаемых диагнозов, а главное, с оценкой вероятной злокачественности патологического процесса). Это также внесет ощутимый вклад в научные исследования: при определении точности, чувствительности и специфичности метода, при сравнении этих показателей с другими методами визуализации и для проведения межцентровых исследований.
Согласно данным зарубежных авторов, КТ-признаки инвазии артерий и вен различаются. Для повышения точности диагностики сосудистой инфильтрации и правильной оценки резектабельности опухоли очень важно обращать внимание на эти различия и уметь правильно интерпретировать данные КТ [8, 9]. Главная причина различия КТ-признаков сосудистой инвазии артерий и вен заключается в том, что стенки вен тоньше и податливее стенок артерий. Когда опухоль окружает вену, ее стенки становятся неровными и калибр вены сужается. Скорость тока крови по венам низкая, опухоль зачастую пенетрирует стенку, обусловливая венозный тромбоз, следствием которого является окклюзия вены. У артериальных сосудов, наоборот, стенки толще и более упругие, калибр артерий меньше, поэтому, даже когда артерии располагаются в структуре опухоли, калибр их зачастую не меняется и при контрастном усилении просвет сосудов остается равномерным.
Таким образом, к критериям инвазии артерии относится окружение сосуда опухолью более чем на 50% его диаметра (тип 5) в сочетании с неровностью стенки или уменьшением калибра артерии [11, 14]. Чувствительность и специфичность данных критериев – соответственно 79 и 99%, что выше, чем в нашем исследовании, в котором критерии инвазии были одинаковыми как для вен, так и для артерий.
Средняя точность КТ в определении распространения опухоли на магистральные сосуды равна 87,8% (по данным литературы, от 70 до 95%) [2, 7, 11]. В целом при оценке инвазии артериального русла КТ показала большую точность (91,2%) и специфичность (96,5%) по сравнению с поражениями венозного русла – соответственно 83,8 и 90,9% (табл. 2). Показатели чувствительности практически одинаковые: для венозного русла (39,6%) и артериального (38,5%).
Показатели чувствительности практически одинаковые: для венозного русла (39,6%) и артериального (38,5%).
При оценке операбельности опухоли поджелудочной железы точность КТ в выявлении лимфогенного метастазирования рака ПЖ сравнительно низкая (66,4%), что соответствует данным литературы. Точность КТ (МСКТ) в выявлении метастазов в печень несколько выше, чем по приводимым в литературе данным (от 61 до 81%) [3, 4, 12] и составляет 87,5%. Однако при этом в нашей работе выявлено 6 ложноположительных и 15 ложноотрицательных результатов. Ограничением КТ остается определение мелких метастазов в печень (<15 мм). Мы не выявили взаимосвязи между степенью дифференцировки опухоли и наличием метастатического поражения печени и лимфатических узлов.
Чтобы определить место КТ в диагностическом алгоритме обследования пациентов с подозрением на рак ПЖ, мы провели сравнительный анализ результатов этого и других методов обследования ПЖ (МРТ, УЗИ, эндо-УЗИ). Самая высокая точность в диагностике рака ПЖ отмечена при КТ (85,63%), на втором месте по точности ультразвуковая диагностика (82,4%), на третьем месте эндо-УЗИ (78%), немного ниже показатель точности МРТ (75%).
На основании данных информативности различных методов диагностики рака ПЖ нами предложен алгоритм инструментального обследования пациента с подозрением на рак ПЖ, предусматривающий рациональное сочетание и последовательность проведения методов инструментального исследования (см. схему). Схема 1. Алгоритм инструментального обследования больного при подозрении на рак ПЖ. Примечание. БКУ -болюсное контрастное усиление; ЧС – чревный ствол; ВБА – верхняя брыжеечная артерия; ОПА – общая печеночная артерия.
Схема 1. Алгоритм инструментального обследования больного при подозрении на рак ПЖ. Примечание. БКУ -болюсное контрастное усиление; ЧС – чревный ствол; ВБА – верхняя брыжеечная артерия; ОПА – общая печеночная артерия.
Таким образом, центральную роль в алгоритме инструментального обследования пациента с подозрением на рак поджелудочной железы (ПЖ) занимает МСКТ как на первой ступени в диагностике больного с подозрением на рак ПЖ, так и при последующем ведении больного с верифицированным раком ПЖ, даже при смене тактики лечения от радикальной к паллиативной. В случае сомнительной резектабельности уточняющую диагностику обеспечивает УЗИ. Окончательная оценка вовлечения сосудов устанавливается после использования интраоперационного УЗИ.
МСКТ с болюсным контрастированием является высокоинформативным неинвазивным методом оценки резектабельности опухолей ПЖ. Общая точность составила 87,8%. МСКТ является высокоспецифичным методом выявления вторичного поражения печени и поражения лимфатических узлов, однако чувствительность остается сравнительно низкой. Точность КТ (МСКТ) в выявлении метастазов в печень составила 87,5%, в выявлении лимфогенного метастазирования – 66,4%.
Источник
