Лекарственное лечение опухолей поджелудочной железы
1 октября 2019 г.
Просмотров: 8961
Рак поджелудочной железы относится к онкологическим заболеваниям, с которыми сложно бороться, и которые характеризуются относительно низкой выживаемостью. В течение 5 лет с момента установления диагноза в живых остаются лишь 9% больных. Рак поджелудочной железы нередко диагностируют в запущенной стадии, потому что не существует эффективного рекомендованного скрининга, злокачественная опухоль может долго не вызывать симптомов.
Тем не менее, пациенту можно помочь, даже если заболевание диагностировано на поздней стадии. В случаях, когда невозможно добиться ремиссии, врачи могут продлить жизнь пациента и избавить его от мучительных симптомов. Эффективное лечение можно получить в клинике Медицина 24/7.
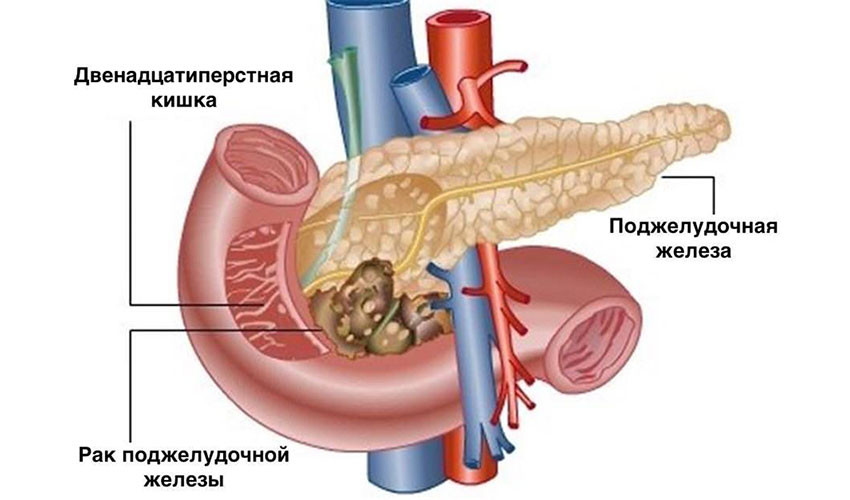
Хирургическое лечение
Хирургическое удаление опухоли — самый эффективный метод лечения рака поджелудочной железы. Это единственная реальная возможность достичь ремиссии. К сожалению, на момент постановки диагноза только у одного из пяти пациентов опухоль не успела распространиться за пределы поджелудочной железы, и лишь у некоторых из них рак можно полностью удалить. Обычно это узлы в головке органа: через неё проходит желчный проток, при его сдавлении развивается механическая желтуха, и эта симптоматика помогает рано диагностировать опухоль.
Операцию проводят, если хирург уверен, что он сможет удалить рак полностью. Циторедуктивные вмешательства, направленные на частичное удаление как можно большего количества опухолевой ткани, не проводятся, так как нет доказательств того, что они помогают продлевать жизнь пациентов.
При раке головки поджелудочной железы чаще всего выполняют операцию Уиппла. Во время нее удаляют головку органа, иногда вместе с телом, и часть окружающих органов: тонкой кишки, желчного протока, ближайшие лимфатические узлы, желчный пузырь, иногда часть желудка.
Операция Уиппла — сложное вмешательство, оно сопровождается риском тяжелых осложнений. Восстановительный период может продолжаться от нескольких недель до нескольких месяцев. Иногда противопоказанием к такой операции становится плохое общее здоровье пациента. Статистика показывает, что смертность от осложнений операции Уиппла в неспециализированных клиниках составляет около 15%, а в специализированных медицинских центрах — 5%.
При резектабельном раке хвоста поджелудочной железы проводят дистальную панкреатэктомию: удаляют хвост поджелудочной железы, иногда вместе с телом, и селезенку.
В редких случаях встречаются ситуации, когда злокачественная опухоль распространилась по всей поджелудочной железе, но все еще является операбельной. При этом может быть выполнена тотальная панкреатэктомия: поджелудочную железу удаляют полностью, вместе с ней — желчный пузырь, часть желудка и тонкой кишки.

Наш эксперт в этой сфере:
Главный хирург, онколог, эндоскопист
Позвонить врачу
Паллиативные операции
Во время паллиативных операций не удаляют рак, их цель — избавить больного от симптомов, вызванных злокачественной опухолью. При раке головки поджелудочной железы нередко развивается механическая желтуха — состояние, вызванное сдавлением желчного протока и нарушением оттока желчи. У больного окрашиваются в желтый цвет кожа, слизистые оболочки и белки глаз, беспокоит кожный зуд, ухудшается общее состояние, прогноз.
С этим осложнением можно справиться тремя способами:
- Дренирование. Во время эндоскопической ретроградной холангиопанкреатографии (РХПГ) или чрескожной чреспеченочной холангиографии в желчные протоки устанавливают дренажную трубку. По ней желчь может оттекать наружу, в просвет двенадцатиперстной кишки или сразу в обоих направлениях. Это достаточно эффективно, но не очень удобно: дренажная трубка постоянно мешается, может случайно сместиться, выпасть.
- Стентирование — более современное решение. Эндоскопически, с помощью катетера, заведенного в желчные протоки из двенадцатиперстной кишки, в заблокированном участке устанавливают стент — трубку с сетчатой стенкой из полимера или металла. Он расширяет просвет протока и обеспечивает свободный отток желчи. Стентирование — быстрая и относительно безопасная процедура, ее выполняют без разрезов.
- Шунтирование — операция, во время которой хирург создает обходной путь для оттока желчи. По сравнению со стентированием, хирургическое вмешательство несет более высокий риск осложнений, его могут перенести не все больные. Но иногда оно позволяет более эффективно, надолго восстановить отток желчи. Во время операции можно перерезать нервы, из-за которых беспокоят мучительные боли.
Насколько эффективна химиотерапия при раке поджелудочной железы?
Химиопрепараты довольно часто применяют при злокачественных опухолях поджелудочной железы. Они могут быть назначены с разными целями:
- Адъювантная химиотерапия проводится до операции, чтобы уменьшить объем опухоли.
- Неоадъювантная химиотерапия проводится после операции, чтобы снизить риск рецидива.
- Химиотерапия как основной метод лечения применяется при неоперабельных опухолях. Цель лечения в таком случае — не достичь ремиссии, а как можно дольше держать болезнь под контролем.
Чаще всего применяют такие химиопрепараты, как гемцитабин (Гемзар),оксалиплатин (Элоксатин),иринотекан (Камптозар),5-фторурацил, цисплатин, капецитабин (Кселода). Обычно назначают комбинации из двух препаратов с разными механизмами действия, это помогает повысить эффективность лечения. Ослабленным пациентам назначают только один препарат из-за риска серьезных побочных эффектов.
Эффективность лучевой терапии
Лучевую терапию при раке поджелудочной железы зачастую применяют вместе с химиопрепаратами. Такое лечение называется химиолучевой терапией. Ее назначают после операции, при неоперабельном раке.
Если опухоль находится в пограничном состоянии между резектабельной и нерезектабельной, после курса неоадъювантной лучевой терапии ее размеры могут уменьшиться так, что ее получится удалить хирургическим путем.
Также лучевую терапию при раке поджелудочной железы применяют в качестве симптоматического лечения, например, если беспокоят мучительные боли, и пациенту противопоказано хирургическое вмешательство.
Таргетная терапия
Принципиальное отличие таргетных препаратов от традиционных химиопрепаратов в том, что они не атакуют все подряд быстро размножающиеся клетки, а действуют более целенаправленно. Каждый таргетный препарат имеет определенную молекулу-мишень, которая помогает раковым клеткам быстро размножаться, сохранять жизнеспособность, «маскироваться» от иммунной системы. Благодаря этим особенностям, таргетная терапия может быть эффективна, когда химиопрепараты не помогают, и вызывает менее серьезные побочные эффекты.
На поверхности раковых клеток в поджелудочной железе нередко увеличено количество молекул белка-рецептора EGFR. Активируясь, он заставляет клетки быстро размножаться. Его можно заблокировать с помощью таргетного препарата эрлотиниб (Тарцева). Его часто назначают в сочетании с химиопрепаратом гемцитабином. Эффективность этой комбинации различается у разных онкологических больных.

Помогает ли иммунотерапия при раке поджелудочной железы?
Иммунная система человека должна не только атаковать чужеродные агенты, но и знать, когда пора остановиться, чтобы не навредить собственным тканям организма. Для этого в ней есть специальные сигнальные молекулы, подавляющие активность иммунных клеток. При раке эти молекулы начинают мешать. Они не дают иммунитету эффективно распознавать и уничтожать опухолевые клетки. Существуют препараты, которые могут заблокировать эти молекулы, они называются ингибиторами контрольных точек.
При раке поджелудочной железы ингибиторы контрольных точек могут быть полезны для пациентов, у которых выявлены определенные генетические отклонения: высокий уровень микросателлитной нестабильности, мутации в генах восстановления несоответствия (MMR).
В клинике Медицина 24/7 при многих типах рака можно пройти молекулярно-генетическое исследование, которое помогает выявить мишени для лекарственных препаратов, имеющиеся в раковых клетках пациента, и назначить оптимальную, персонализированную терапию.
Иммунотерапия при раке поджелудочной железе может помочь в следующих случаях:
- Рост опухоли на фоне химиотерапии.
- Неоперабельный рак.
- Рецидив после проведенного лечения.
- Рак поджелудочной железы с метастазами.
В мировой онкологической практике применяют иммунопрепарат пембролизумаб (Кейтруда). Он блокирует белок PD-1, который находится на поверхности T-клеток. Лекарство вводят внутривенно через каждые 2–3 недели.
Обычно эффективное лечение при раке поджелудочной железы подбирает консилиум врачей, в зависимости от типа, стадии опухоли, общего состояния здоровья пациента и других факторов. Даже если рак неоперабелен, и ремиссии достичь не удастся, пациенту все еще можно помочь. В клинике Медицина 24/7 доступны наиболее современные виды лечения. Запишитесь на консультацию к нашему специалисту.
Материал подготовлен врачом-онкологом, хирургом клиники «Медицина 24/7» Рябовым Константином Юрьевичем.
Источник
 12.07.2019
12.07.2019
Практические рекомендации по лекарственному лечению нейроэндокринных опухолей желудочно-кишечного тракта и поджелудочной железы
Алгоритм выбора лечения нейроэндокринных опухолей (НЭО) ЖКТ и поджелудочной железы (ПЖ) зависит от типа и распространённости неоплазии и ориентирован на рекомендации ENETS 2016 г. и классификацию ВОЗ 2010 г. для НЭО ЖКТ и 2017 г. для НЭО П.
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
1.1. По степени злокачественности
Алгоритм выбора лечения нейроэндокринных опухолей (НЭО) ЖКТ и поджелудочной железы (ПЖ) зависит от типа и распространённости неоплазии и ориентирован на рекомендации ENETS 2016 г. и классификацию ВОЗ 2010 г. для НЭО ЖКТ (табл. 1) и 2017 г. для НЭО ПЖ (табл. 2).
В настоящее время выделяют две группы НЭО: высокодифференцированные и низкодифференцированные, последние обозначаются как «нейроэндокринный рак» (НЭР). НЭО ЖКТ разделяют на НЭО G1, НЭО G2 и НЭР G3. В группу G1, G2 входят высокодифференцированные НЭО ЖКТ, а в группу G3 —низкодифференцированные НЭР.
Таблица 1. Классификации нейроэндокринных опухолей желудочно-кишечного тракта (ВОЗ, 2010 г.)
Гистологический подтип | Митотический индекс (количество мито- | Индекс Ki-67, %2 |
Нейроэндокринная опухоль G1 (карциноид) | <2 | <2 |
Нейроэндокринная опухоль, G2 | 2-20 | 3-20 |
Нейроэндокринный рак, G3 • мелкоклеточный рак • крупноклеточный рак | >20 | >20 |
Смешанная аденонейроэндокринная карцинома | ||
Гиперпластические и предопухолевые процессы | ||
1 Площадь поля зрения при большом увеличении (*40) равна 2 мм2; для определения данного показателя оцениваются не менее 50 полей в областях наибольшей митотической плотности с последующим пересчётом среднего значения на 10 полей зрения;
2 Используются антитела MIB-1; рассчитывается % окрашенных клеток при оценке 500-2000 опухолевых клеток в областях наибольшего ядерного мечения.
Для НЭО панкреатической локализации впервые выделена группа G3 (высокодифференцированные НЭО, демонстрирующие повышенную пролиферативную активность) (табл. 2). НЭР ЖКТ и ПЖ подразделяют на мелкоклеточный и крупноклеточный варианты.
Таблица 2. Классификация нейроэндокринных опухолей поджелудочной железы (ВОЗ, 2017 г.)
Митотический индекс (количество митозов | Индекс Ki-67, %2 | |
Высокодифференцированные нейроэндокринные опухоли | ||
НЭО G1 (карциноид) | <2 | <2 |
НЭО G2 | 2-20 | 3-20 |
НЭО G3 | >20 | >20 |
Низкодифференцированные нейроэндокринные опухоли | ||
Нейроэндокринный рак G3 • мелкоклеточный рак • крупноклеточный рак | >20 | |
Смешанные нейроэндокринные/не нейроэндокринные неоплазии | ||
1 Площадь поля зрения при большом увеличении (*40) равна 2 мм2; для определения данного показателя оцениваются не менее 50 полей в областях наибольшей митотической плотности с последующим пересчётом среднего значения на 10 полей зрения
2 Используются антитела MIB-1; рассчитывается % окрашенных клеток при оценке 500-2000 опухолевых клеток в областях наибольшего ядерного мечения
1.2. Стадирование по системе TNM
Определение стадии НЭО осуществляется в соответствии с классификацией TNM для органа, в котором она возникла.
В настоящее время в России используется 7-е издание, а с 2019 г. планируется переход на 8-е издание
классификации TNM. В 7-ю редакцию руководства по определению стадий злокачественных опухолей AJCC/UICC (2009 г.) НЭО включены впервые и для большинства локализаций содержат особые, специфичные только для них критерии (НЭО желудка, тонкой кишки, толстой кишки, аппендикса).
В настоящее время для НЭО ПЖ в классификацию ВОЗ 2017 г. включены критерии 8-й редакции TNM классификации AJCC/UICC (2016 г.).
Классификация TNM для НЭР ПЖ соответствует принципам стадирования протоковой аденокарциномы ПЖ.
2. ДИАГНОСТИКА
Диагноз НЭО ЖКТ и ПЖ основывается на данных осмотра, результатах инструментальных методов обследования и патоморфологическом заключении.
Первичное обследование должно быть проведено до всех видов лечебных воздействий и включает в себя:
• сбор анамнеза и осмотр; осмотр включает пальпацию лимфоузлов регионарных зон, а также выявление симптомов, подозрительных в отношении отдалённых метастазов или наличия карциноидного синдрома;
• общий анализ крови с подсчётом лейкоцитарной формулы и количества тромбоцитов;
• биохимический анализ крови с определением показателей функции печени, почек, кальция, глюкозы;
• УЗИ органов брюшной полости и малого таза, периферических лимфоузлов;
• R-графию органов грудной клетки;
• ЭКГ, ЭхоКГ;
• КТ/МРТ органов брюшной полости и малого таза с в/в контрастированием;
• КТ органов грудной клетки — по показаниям;
• радиоизотопное исследование скелета +R-графию и/или КТ/МРТ зон накопления РФП — по показаниям;
• биопсию опухоли с патоморфологическим исследованием опухолевой ткани;
• ИГХ исследование с определением в опухолевой ткани экспрессии хромогранина А, синаптофизина, Ki67, рецепторов соматостатина 2 и 5 типа — по показаниям;
• в случае длительного течения заболевания в периоды доказанного прогрессирования рекомендуется повторная биопсия для определения степени злокачественности;
• биохимические маркёры: кровь — хромогранин А, серотонин, панкреатический полипептид (при НЭО ПЖ, ЖКТ и метастазах НЭО не выявленной первичной локализации); гастрин, глюкагон, инсулин, вазоактивный интестинальный пептид, соматостатин, кальцитонин, АКТГ, кортизол — по показаниям; при карциноидном синдроме — 5-ГИУК в суточной моче;ежегодно — NTproBNP
• сцинтиграфия с 111In (октреоскан) — по показаниям;
• КТ, МРТ головного мозга — по показаниям;
• ПЭТ/КТ — по показаниям (для G2, G3);
• ПЭТ/КТ с 68Ga — по показаниям (для G1, G2);
• консультацию медицинского генетика — по показаниям (для больных с синдромом МЭН).
3. ЛЕЧЕНИЕ
3.1. Лекарственное лечение
3.1.1. Гормонотерапия (аналоги соматостатина)
3.1.1.1. Гормонотерапия высокодифференцированных нейроэндокринных опухолей (Gl, G2)
Аналоги соматостатина пролонгированного действия (октреотид и ланреотид) как самостоятельное лечение применяются при высокодифференцированных НЭО ЖКТ и ПЖ.
Октреотид 30мг в/м 1 раз в 28 дней, ланреотид — 120 мг пк 1 раз в 28 дней. Возможно назначение аналогов соматостатина в комбинации с ИФНа, цитостатиками, таргетными препаратами для контроля симптомов карциноидного синдрома в дозе 20 мг 1 раз в 28 дней. При необходимости возможно увеличение дозы октреотида до 60мг 1 раз в 28 дней или уменьшение интервалов между введениями аналогов соматостатина до 1 раза в 14-21 день (табл. 3). Данное лечение проводится до прогрессирования или непереносимой токсичности.
Имеются ограниченные данные по применению аналогов соматостатина во время беременности. При необходимости их использования при беременности решение должно приниматься мультидисциплинарной комиссией с участием онколога, эндокринолога и гинеколога.
Таблица 3. Рекомендуемые варианты гормонотерапии высокодифференцированных нейроэндокринных опухолей
Препарат | Режим применения |
Октреотид | 300 мкг/сут. п/к в течение 2 нед., далее — переход на депо формы (в соответствии |
Октреотид пролонгированный | • 30 мг в/м 1 раз в 28 дней в качестве противоопухолевого лечения • 20 мг в/м 1 раз в 28 дней для контроля карциноидного синдрома |
Ланреотид | 120 мг п/к 1 раз в 28 дней |
3.1.1.2. Гормонотерапия нейроэндокринного рака (G3)
Пролонгированный октреотид применяется в комбинации с цитостатиками для контроля симптомов карциноидного синдрома в дозе 20 мг в/м 1 раз в 28 дней.
3.1.2. Таргетная терапия
З.1.2.1. Таргетная терапия высокодифференцированных нейроэндокринных опухолей (G1, G2)
Эверолимус является стандартом лечения высокодифференцированных НЭО ЖКТ и ПЖ.
Препарат может использоваться в качестве антипролиферативной терапии во II-III линии после лечения аналогами соматостатина у больных с диссеминированным процессом, а также в I линии — при отсутствии рецепторов к соматостатину или невозможности проведения ХТ; применяется в дозе 10 мг/сут. внутрь ежедневно до прогрессирования или неприемлемой токсичности; при развитии симптомов токсичности доза может быть снижена до 5 мг/сут.
Сунитиниб зарегистрирован только для лечения НЭО ПЖ и рекомендуется во II линии после лечения аналогами соматостатина или в I линии лечения при отсутствии рецепторов к соматостатину; применяется в дозе 37,5 мг/сут.(используются таблетки 25 мг и 12,5 мг) внутрь ежедневно до прогрессирования или неприемлемой токсичности. При развитии симптомов токсичности доза может быть уменьшена до 25 мг/сут.
Оптимальная последовательность назначения таргетных препаратов при НЭО ПЖ чётко не определена. В случае прогрессирования на одном из таргетных препаратов рекомендуется использование другого таргетного препарата.
Рекомендуемые режимы таргетной терапии НЭО G1, G2 представлены в табл. 4.
Таблица 4. Рекомендуемые режимы таргетной терапии высокодифференцированных нейроэндокринных опухолей (G1, G2)
Препарат | Режим применения |
Эверолимус | 10 мг/сут. внутрь ежедневно до прогрессирования или |
Сунитиниб (только для больных с НЭО ПЖ) | 37,5 мг/сут. внутрь ежедневно до прогрессирования или |
3.1.2.2. Таргетная терапия нейроэндокринного рака (G3)
Применение таргетной терапии при НЭР (G3) не рекомендуется.
3.1.3. Иммунотерапия
3.1.3.1. Иммунотерапия высокодифференцированных нейроэндокринных опухолей (G1, G2)
ИФНа является терапией II линии лечения высокодифференцированных НЭО и рекомендуется как дополнение к терапии аналогами соматостатина
Кроме того, ИФНа может использоваться в качестве терапии I линии при отсутствии экспрессии рецепторов соматостатина. Рекомендуемая доза ИФНа составляет 3 млн. МЕ п/к 3-5 раз в нед. до прогрессирования или непереносимой токсичности. При непереносимости стандартного режима введения может быть использован пегилированный ИФНа (50-180 мкг/нед. п/к).
3.I.3.2.Иммунотерапия нейроэндокринного рака (G3)
Рекомендуется использовать ИФНа как дополнение терапии аналогами соматостатина при недостаточном контроле симптомов функционирующих опухолей (табл. 5).
Таблица 5. Рекомендуемый режим иммунотерапии нейроэндокринных опухолей
Препарат | Режим применения |
ИФНа | 3 млн. МЕ п/к 3-5 раз в нед. до прогрессирования или непереносимой токсичности |
3.1.4. Химиотерапия
3.1.4.1. Химиотерапия высокодифференцированных нейроэндокринных опухолей (G1, G2)
Применение ХТ при НЭО ЖКТ и ПЖ G1 в I линии не рекомендуется, за исключением случаев отсутствия эффекта от предшествующего лечения (ГТ,иммунотерапии, таргетной терапии) или при быстром прогрессировании.
При НЭО G2 применение ХТ в 1 линии ± аналоги соматостатина рекомендовано при значительной массе опухоли и наличии карциноидного синдрома. Рекомендуется использовать режимы, не содержащие цисплатин и карбоплатин (табл. 6).
3.1.4.2.Химиотерапия нейроэндокринного рака (G3)
Химиотерапия при НЭР (G3) является основным методом лечения (табл. 6).
Таблица 6. Рекомендуемые режимы химиотерапии нейроэндокринного рака (G3)
ЕР | Этопозид 100 мг/м2 в/в в 1-3-й дни + цисплатин 75 мг/м2 в/в в 1-й день 1 раз |
ЕС | Этопозид 100 мг/м2 в/в в 1-3-й дни + карбоплатин AUC 5 в/в в 1-й день 1 раз в 3 нед., |
ТЕМСАР | Темозоломид 150 мг/м2 внутрь 10-14-й дни + капецитабин 2000 мг/м2 внутрь в 1-14-й |
XELOX | Оксалиплатин 130 мг/м2 в/в в 1-й день + капецитабин 2000 мг/м2 внутрь в 1-14-й |
GEMOX | Оксалиплатин 100 мг/м2 в/в в 1-й день + гемцитабин 1000 мг/м2 в/в в 1-й день 1 раз |
FOLFOX | Оксалиплатин 85 мг/м2 в/в в 1-й день + кальция фолинат 400 мг/м2 в/в в 1-й день |
FOLFIRI | Иринотекан 180 мг/м2 в/в в 1-й день + кальция фолинат 400 мг/м2 в/в в 1-й день |
Эпирубицин | Эпирубицин 25 мг/м2 в/в в 1-3-й дни + дакарбазин 200 мг/м2 в/в в 1-3-й дни +5-фто- |
Темозоломид | Темозоломид 150-200 мг/м2/сут. внутрь в 1-5-й дни 1 раз в 4 нед., 6 циклов; при от- |
3.2. Локальное лечение
3.2.1. Хирургическое
При неоперабельных НЭО G1 и G2 хирургический метод используется для уменьшения опухолевой массы (циторедуктивные операции), что особенно актуально при гормонопродуцирующих опухолях и может использоваться последовательно или совместно с лекарственной терапией. К другим циторедуктивным методам относятся РЧА, эмболизация и химиоэмболизация метастазов в печени.
У большинства больных удаётся достичь значительного уменьшения проявлений карциноидного синдрома. При операбельном процессе рекомендуется хирургическое лечение. Однозначных рекомендаций относительно нео-и адъювантного лечения при НЕО G1-2 не существует. При G1 неоадъювантное лечение не проводится, при G2 возможно у отдельных больных. Факторами риска являются метастазы в лимфатических узлах, а также повышение биохимических маркёров.
3.2.2. Лучевое
Дистанционная ЛТ проводится с паллиативной (в т.ч. обезболивающей) целью при НЭО любой степени дифференцировки.
Рекомендуемые алгоритмы лечения НЭО ЖКТ и ПЖ представлены на рис. 1 и 2 соответственно.
4. НАБЛЮДЕНИЕ
Задачей наблюдения является раннее выявление прогрессирования заболевания с целью своевременного начала лекарственной терапии или проведения хирургического лечения при наличии показаний.
4.1. Алгоритм наблюдения за больными после операции
• 1-2-й годы — 1 раз в 3 мес.
• 3-5 годы — 1 раз в 6 мес.
• После 5 лет — 1 раз в год.
4.2. Объём обследования на этапе наблюдения и во время лечения
• Сбор анамнеза и осмотр; осмотр включает пальпацию лимфоузлов регионарных зон, а также выявление симптомов, подозрительных в отношении отдалённых метастазов;
• общий анализ крови с подсчётом лейкоцитарной формулы и количества тромбоцитов;
• биохимический анализ крови с определением показателей функции печени и почек, а также уровня кальция и глюкозы;
• УЗИ органов брюшной полости и малого таза, периферических лимфоузлов;
• R-графия органов грудной клетки;
• ЭКГ, ЭхоКГ 1 раз в 6 мес.;
• КТ/МРТ органов брюшной полости и малого таза с в/в контрастированием;
• КТ органов грудной клетки — по показаниям;
• радиоизотопное исследование скелета + R-графия и/или КТ/МРТ зон накопления РФП — по показаниям;
Рисунок 1. Рекомендуемый алгоритм лечения нейроэндокринных опухолей желудочно-кишечного тракта.
Рисунок 2. Рекомендуемый алгоритм лечения нейроэндокринных опухолей поджелудочной железы.
• биохимические маркёры: кровь — хромогранин А, серотонин, панкреатический полипептид (при НЭО ПЖ, ЖКТ и метастазах НЭО не выявленной первичной локализации); гастрин, глюкагон, инсулин, вазоактивный
интестинальный пептид, соматостатин, кальцитонин, АКТГ, кортизол — по показаниям; при карциноидном синдроме — 5-ГИУК в суточной моче; ежегодно — NTproBNP; при карциноидной болезни сердца — NTproBNP
каждые 6 мес.;
• сцинтиграфия с 1111п(октреоскан) — по показаниям;
• КТ, МРТ головного мозга — по показаниям;
• ПЭТ/КТ — по показаниям (для G2 и G3);
• ПЭТ/КТ с 68Ga — по показаниям (для G1 и G2).
Коллектив авторов: Орел Н.Ф., Горбунова В.А., Делекторская В. В., Емельянова Г. С., Любимова Н. В., Маркович А.А., Орлова Р. В., Трифанов В. С.
Теги: поджелудочная железа
234567
Начало активности (дата): 12.07.2019 12:59:00
234567
Кем создан (ID): 989
234567
Ключевые слова:
нейроэндокринные опухоли, поджелудочная железа, желудочно-кишеч- ный тракт, иммунотерапия, гормонотерапия, химиотерапия, аналоги соматостатина, рецепторы соматостатина
12354567899
Источник
