Клетки островков лангерганса поджелудочной железы
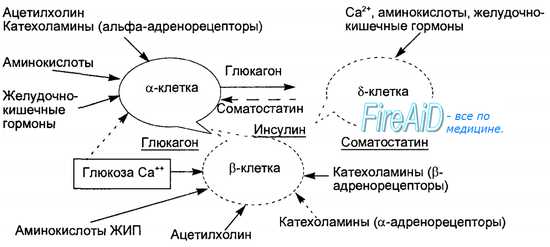
Оглавление темы “Гормон околощитовидных желез. Гормоны эпифиза. Гормоны поджелудочной железы. Гормоны половых желез. Гормоны тимуса.”: Гормоны поджелудочной железы. Островки Лангерганса. Соматостатин. Амилин. Регуляторные функции гормонов поджелудочной железы.Эндокринную функцию в поджелудочной железе выполняют скопления клеток эпителиального происхождения, получившие название островков Лангерганса и составляющие всего 1 —2 % массы поджелудочной железы — экзокринного органа, образующего панкреатический пищеварительный сок. Количество островков в железе взрослого человека очень велико и составляет от 200 тысяч до полутора миллионов. В островках различают несколько типов клеток, продуцирующих гормоны: альфа-клетки образуют глюкагон, бета-клетки — инсулин, дельта-клетки — соматостатин, джи-клетки — гастрин и РР- или F-клетки — панкреатический полипептид. Помимо инсулина в бета-клетках синтезируется гормон амилин, обладающий противоположными инсулину эффектами. Кровоснабжение островков более интенсивно, чем основной паренхимы железы. Иннервация осуществляется постганлионарными симпатическими и парасимпатическими нервами, причем среди клеток островков расположены нервные клетки, образующие нейроинсулярные комплексы.
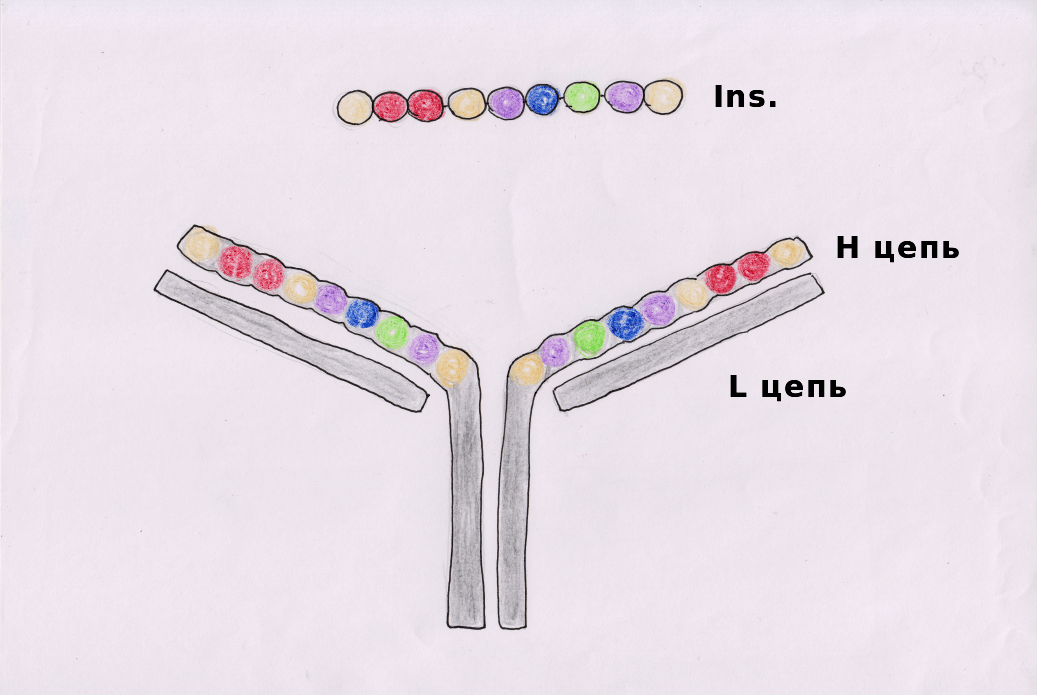
Инсулин синтезируется в эндоплазматическом ретикулуме бета-клеток вначале в виде пре-проинсулина, затем от него отщепляется 23-аминокис-лотная цепь и остающаяся молекула носит название проинсулина. В комплексе Гольджи проинсулин упаковывается в гранулы, в них осуществляется расщепление проинсулина на инсулин и соединительный пептид (С-пептид). В гранулах инсулин депонируется в виде полимера и частично в комплексе с цинком. Количество депонированного в гранулах инсулина почти в 10 раз превышает суточную потребность в гормоне. Секреция инсулина происходит путем экзоцитоза гранул, при этом в кровь поступает эквимолярное количество инсулина и С-пептида. Определение содержания последнего в крови является важным диагностическим тестом оценки секреторной способности (3-клеток. Секреция инсулина является кальцийзависимым процессом. Под влиянием стимула — повышенного уровня глюкозы в крови — мембрана бета-клеток деполяризуется, ионы кальция входят в клетки, что запускает процесс сокращения внутриклеточной микротубулярной системы и перемещение гранул к плазматической мембране с последующим их экзоцитозом. Секреторная функция разных клеток островков взаимосвязана, зависит от эффектов образуемых ими гормонов, в связи с чем островки рассматриваются как своеобразный «мини-орган» (рис. 6.21). Выделяют два вида секреции инсулина: базальную и стимулированную. Базальная секреция инсулина осуществляется постоянно, даже при голодании и уровне глюкозы крови ниже 4 ммоль/л. Стимулированная секреция инсулина представляет собой ответ бета-клеток островков на повышенный уровень D-глюкозы в притекающей к бета-клеткам крови. Под влиянием глюкозы активируется энергетический рецептор бета-клеток, что увеличивает транспорт в клетку ионов кальция, активирует аденилатциклазу и пул (фонд) цАМФ. Через эти посредники глюкоза стимулирует выброс инсулина в кровь из специфических секреторных гранул. Усиливает ответ бета-клеток на действие глюкозы гормон двенадцатиперстной кишки — желудочный ингибиторный пептид (ЖИП). В регуляции секреции инсулина определенную роль играет и вегетативная нервная система. Блуждающий нерв и ацетилхолин стимулируют секрецию инсулина, а симпатические нервы и норадреналин через альфа-адренорецепторы подавляют секрецию инсулина и стимулируют выброс глюкагона. Специфическим ингибитором продукции инсулина является гормон дельта-клеток островков — соматостатин. Этот гормон образуется и в кишечнике, где тормозит всасывание глюкозы и тем самым уменьшает ответную реакцию бета-клеток на глюкозный стимул. Образование в поджелудочной железе и кишечнике пептидов, аналогичных мосговым, например сомато-статина, подтверждает существование в организме единой APUD-системы. Секреция глюкагона стимулируется снижением уровня глюкозы в крови, гормонами желудочно-кишечного тракта (ЖИП гастрин, секретин, холе-цистокинин-панкреозимин) и при уменьшении в крови ионов Са2+. Подавляют секрецию глюкагона инсулин, соматостатин, глюкоза крови и Са2+. В эндокринных клетках кишечника образуется глюкагоноподобный пептид-1, стимулирующий всасывание глюкозы и секрецию инсулина после приема пищи. Клетки желудочно-кишечного тракта, продуцирующие гормоны, являются своеобразными «приборами раннего оповещения» клеток панкреатических островков о поступлении пищевых веществ в организм, требующих для утилизации и распределения участия панкреатических гормонов. Эта функциональная взаимосвязь нашла отражение в термине «гастро-энтеро-панкреатическая система». – Также рекомендуем “Инсулин. Физиологические эффекты инсулина. Схема транспорта глюкозы через клеточные мембраны. Основные эффекты инсулина.” |
Источник
Эндокринная часть поджелудочной железы. Регенерация поджелудочной железы.
Островки состоят из эпителиальных клеток — панкреатических эндокриноцитов, или инсулоцитов. Величина островков, их форма и число входящих в состав клеток очень различны. Общее количество островков в поджелудочной железе достигает 1-2 млн. Средний размер островка 0,1-0,3 мм. Общий объем эндокринной части составляет около 3% всего объема железы. Островки пронизаны кровеносными капиллярами, окруженными перикапиллярным пространством. Эндотелий капилляров имеет фенестры, облегчающие поступление гормонов от инсулоцитов в кровь через перикапиллярное пространство.
В островковом эпителии различают 5 видов клеток: А-клетки, В-клетки, D-клетки, ВИП-клетки, РР-клетки.
А-клетки (альфа-клетки, или ацидофильные инсулоциты) — это крупные округлые клетки с бледным крупным ядром и цитоплазмой, содержащей ацидофильные гранулы. Гранулы обладают и аргирофилией. В состав этих гранул входит гормон глюкагон, расщепляющий гликоген и повышающий содержание сахара в крови.
А-клетки рассеяны по всему островку, образуя нередко небольшие скопления в центральной части. Они составляют около 20-25% от всех инсулоцитов.
В-клетки (бета-клетки, или базофильные инсулоциты) имеют кубическую или призматическую форму, крупное темное, богатое гетерохроматином ядро. Доля В-клеток достигает 70-75% от общего числа инсулоцитов. В цитоплазме В-клеток накапливаются осмиофильные гранулы, содержащие гормон инсулин. Инсулин регулирует синтез гликогена из глюкозы. При недостатке продукции инсулина глюкоза не превращается в гликоген, содержание ее в крови повышается и создаются условия для развития заболевания, называемого сахарным диабетом.
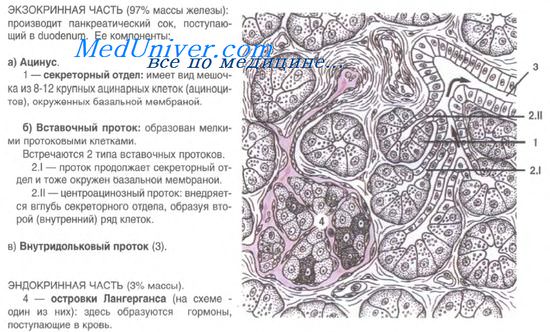
D-клетки (дельта-клетки, или дендритические инсулоциты) составляют 5-10% среди всех островковых клеток. Форма их иногда звездчатая с отростками. В цитоплазме определяются гранулы средних размеров и плотности. В гранулах накапливается гормон соматостатин. Он тормозит секрецию инсулина и глюкагона, снижает продукцию ряда гормонов желудочно-кишечного тракта — гастрина, секретина, энтероглюкагона, холецистокинина и др., подавляет секрецию соматотропного гормона в гипофизе.
ВИП-клетки (аргирофильные клетки) встречаются в островках в небольшом количестве. В цитоплазме выявляются плотные аргирофильные гранулы, содержащие вазоактиеный интестиналъный полипептид. Он обладает выраженным сосудорасширяющим дейтвием, снижает кровяное давление, угнетает секрецию соляной кислоты в желудке, стимулирует выделение глюкагона и инсулина.
РР-клетки — полигональной формы инсулоциты, расположенные преимущественно по периферии островка. Количество их — 2-5% от общего числа клеток островка. В цитоплазме РР-клеток выявляются мелкие гранулы, содержащие панкреатический полипептид. Основная роль панкреатического полипептида в организме — регуляция скорости и количества экзокринной секреции поджелудочной железы и желчи в печени. Таков клеточный состав островкового эпителия, представляющего собой мозаику дивергентно развивающихся клеточных дифферонов.
В дольках поджелудочной железы встречаются еще ацинозно-инсулярные клетки, в цитоплазме которых одновременно содержатся гранулы, характерные как для ацинозных, так и для островковых клеток.
Ткани поджелудочной железы иннервируют блуждающий и симпатический нервы. В интрамуральных вегетативных ганглиях находятся холинергические и пептидергические нейроны, волокна которых заканчиваются на клетках ацинусов и островков. Между нервными клетками ганглиев и островковыми клетками устанавливается тесная связь с образованием нейроинсулярных комплексов.
С возрастом в поджелудочной железе постепенно уменьшается количество островков. В островках наблюдаются закономерные возрастные изменения клеточных взаимоотношений, заключающиеся в быстрой смене после рождения преобладания А-клеток над В-клетками на преобладание В-клеток над А-клетками у взрослых. Затем происходит постепенное увеличение количества А-клеток, которое наряду с одновременным, хотя и незначительным, уменьшением числа В-клеток приводит нередко в пожилом и особенно старческом возрасте вновь к преобладанию А-клеток над В-клетками.
Регенерация поджелудочной железы. В эмбриогенезе островки растут благодаря пролиферации исходных клеток-предшественниц и их дивергентной дифференцировке в соответствующие клеточные диффероны. У взрослых физиологическая регенерация ацинозных и островковых клеток происходит в основном путем внутриклеточного обновления органелл. Митотическая активность клеток в связи с высокой специализацией низкая. После резекции части или повреждения органа наблюдается некоторое повышение уровня пролиферативной активности клеток ацинусов, протоков и островков, последующее образование новых ацинусов. Однако ведущей формой регенерации экзокринной части железы является регенерационная гипертрофия.
Восстановительные процессы в эндокринной части железы происходят за счет пролиферативной активности инсулоцитов и клеток эпителия протоков путем ацино-инсулярной трансформации.
– Также рекомендуем “Печень. Развитие печени. Строение печени.”
Оглавление темы “Строение желудка. Строение кишечника.”:
1. Пищевод. Слизистая пищевода. Строение стенки пищевода.
2. Желудок. Развитие желудка. Строение желудка. Железы желудка.
3. Эпителий желез желудка. Клетки желудка. Гормоны желудка.
4. Тонкая кишка. Развитие тонкой кишки. Строение тонкой кишки.
5. Эпителий тонкой кишки. Клетки тонкой кишки.
6. Толстая кишка. Развитие и строение толстой кишки. Червеобразный отросток.
7. Прямая кишка. Строение прямой кишки. Поджелудочная железа.
8. Эндокринная часть поджелудочной железы. Регенерация поджелудочной железы.
9. Печень. Развитие печени. Строение печени.
10. Гепатоциты. Строение гепатоцитов. Образование желчи.
Источник
Людям, страдающим заболеваниями поджелудочной железы, вовсе не обязательно знать точное строение каждой части органа, однако гистологию и поверхностную анатомию знать полезно.
Некоторым людям подобные знания и вовсе не раз спасали жизнь. Так что такое поджелудочная железа гистология, для чего она необходима и за что отвечает каждая отдельная составляющая органа?

Анатомия и функции железы
Поджелудочная железа состоит из соединительной ткани и заключается в плотную капсулу. Она имеет множество капилляров, необходимых для правильного кровоснабжения, поэтому ее повреждения могут грозить опасными внутренними кровотечениями.
Поджелудочная железа располагается в забрюшной полости туловища человека. Впереди нее находится желудок, который отделяется сальной сумкой, сзади – позвоночник. В задней части железы локализуются лимфоузлы, чревное сплетение и брюшная область аорты. Именно при таком расположении органа нагрузка на него распределяется оптимально.

Форма органа – вытянутая, внешне напоминает запятую. Условно ее разделяют на части:
- Голова (до 35 миллиметров в длину) – располагается около двенадцатиперстной кишки и плотно к ней примыкает.
- Тело (до 25 миллиметров) – локализуется в области первого поясничного позвонка.
- Хвост (до 30 миллиметров).

Таким образом, длина самого органа взрослого человека составляет, как правило, не более 230 миллиметров.
Анатомия органа сложна. Поджелудочная железа является одним из органов эндокринной системы. Ее ткани по типу строения и структуры разделяются на два вида: экзокринную и эндокринную.
Экзокринная часть железы формирует и выделяет ферменты, требующиеся в пищеварении в области двенадцатиперстной кишки. Именно они помогают переварить основные пищевые компоненты в пище. Эндокринная часть осуществляет выработку гормонов и производит обмен веществ.

Несмотря на то, что поджелудочная железа является цельным органов, ее анатомия и гистология значительно отличается от других.
Гистологическое строение поджелудочной
Гистология – научный раздел биологии, который занимается изучением строения и функций составляющих организма, тканей и органов. Поджелудочная железа – единственный орган в организме, который формирует и выделяет как внутренний, так и внешний секрет. Поэтому гистологическое строение поджелудочной железы имеет довольно сложную структуру.

Для того, чтобы проводить полные и подробные исследования тканей используют гистологические препараты. Они представляют собой кусочки тканей, окрашенные специальными составами для изучения под микроскопом.
Экзокринная ткань
Экзокринные ткани поджелудочной железы состоят из ацинусов, формирующих пищеварительные ферменты, и протоков, выводящих их. Ацинусы плотно располагаются друг к другу и соединяются тонким слоем рыхлой ткани, содержащей сосуды. Клетки экзокринной области железы имеют треугольную форму. Ядро клеток – округлое.

Сами ацинусы делятся на две части: базальную и апикальную. Базальная содержит в себе мембраны гранулярной сети. При применении гистологического препарата окрашивание данной части будет довольно равномерным. Апикальная, в свою очередь, принимает кислые оттенки. При помощи гистологического препарата также можно рассмотреть хорошо развитые митохондрии и комплекс Гольджи.
Протоки для выведения ферментов также имеют несколько видов:
- Общий – формируется из, соединяющихся между собой междольковых.
- Вставочные – локализуется в области вставочной части ацинуса. Имеют плоский и кубический эпителий.
- Междольковые – покрыты однослойной оболочкой.
- Межацинозные (внутридольковые).
Именно при помощи оболочек указанных протоков производится секреция бикарбонатов, которая образует щелочную среду в соке поджелудочной железы.
Эндокринная ткань
Эта часть поджелудочной железы образуется из так называемых островков Лангерганса, состоящих из совокупности клеток, которые имеют округлую и овальную форму. Эта ткань отлично снабжается кровью за счет многочисленных капиллярных сетей. Ее клетки плохо окрашиваются при использовании гистологического препарата.

Как правило, выделяются следующие их виды:
- A – вырабатываются на участках периферии и считаются антогонистом инсулина. Они могут закрепляться спиртом и растворяться в воде. Вырабатывают глюкагон.
- B – представляют собой наиболее многочисленную совокупность и располагаются в самом центре островков. Именно они являются источником инсулина, который снижает уровень сахара в крови. Хорошо растворяются в спирте. Плохо окрашиваются препаратом.
- D – формируют и выбрасывают гормон соматостатин, который замедляет синтез клеток А и В. Имеют среднего уровня плотность и размеры, располагаются на периферии.
- D-1 – вырабатывают полипептид и представляют собой наиболее немногочисленную группу клеток. Отвечают за снижение давления, активизируя секрецию железы. Имеют высокую плотность.
- PP-клетки – синтезируют полипептид и усиливают выработку поджелудочного сока. Располагаются также в области периферии.
Гормоны, которые формируются островками Лангерганса, отправляются сразу в кровь, поскольку не имеют протоков. При этом самая большая часть этих участков располагается в «хвосте» поджелудочной железы. Их количество, как правило, со временем изменяется. Так, в период активного роста организма, оно увеличивается, а после двадцати пяти лет постепенно начинает уменьшаться.
Заключение
Для изучения поджелудочной железы гистология играет большую роль. Это необходимо для проведения исследований в области распространенных патологий, таких как панкреатит, а также разработок новых лекарственных средств, хирургических операций и процедур.
Источник
Комикс на конкурс «био/мол/текст»: Сахарный диабет первого типа, также известный как инсулинозависимый диабет, развивается из-за разрушения бета-клеток поджелудочной железы, продуцирующих инсулин — гормон, регулирующий уровень глюкозы в крови человека. В своей статье мы расскажем о том, как недавно открытый лимфоцит, несущий рецепторы как Т-, так и В-клеток, ошибочно подстрекает Т-клетки к атаке на инсулинпродуцирующие клетки.
Давайте познакомимся с героями нашей статьи
Акула — T-клетка.
Кальмар — В-клетка.
Удильщик — APC (антигенпрезентирующая клетка) с HLA I и HLA II (human leukocyte antigen).
Химера — DE-клетка (dual-receptor-expressing cell, «бирецепторная» клетка) с TCR (T-клеточным рецептором) и BCR (В-клеточным рецептором).
Для того чтобы разобраться, что же делает уникальный «бирецепторный» лимфоцит при диабете I типа (СД1), вкратце расскажем о том, как работает иммунная система.

Перед нами грозный хищник тканей организма — антигенпрезентирующая клетка (APC). Она поглощает фагоцитозом непрошенных гостей — патогенов, например, бактерии.
После переваривания она презентирует на специальном белке HLA II (human leucocyte antigen class II) часть белка патогена — антиген. Помимо HLA II существует HLA I. Об их значении и функциях подробнее рассказано в статье «Иммунитет: борьба с чужими и… своими» [1]. APC заплывает в лимфатический фолликул и привлекает туда наивные T-клетки, которые свободно циркулируют по организму.
В норме главная задача Т-лимфоцита — связывание антигена, который не встречается в организме, но попадает в него в течение патологических процессов. Разнообразие T-лимфоцитов очень велико. Оно обусловлено разнообразием Т-клеточных рецепторов, которое получается за счет рекомбинаций нескольких геномных участков и вставки случайных нуклеотидов в ген TCR [2]. Каждая из клеток немного отличается от остальных за счет гипермутабельности короткого фрагмента N-концевого домена рецептора и способна к узнаванию своего потенциального антигена. А значит, есть вероятность того, что APC встретит ту T-клетку, TCR которой будет связываться с антигеном, презентированным на HLA. Однако это также означает, что TCR может подойти и к пептиду, который есть у своих, нормальных клеток организма. Но нет. Такие Т-клетки обычно погибают в тимусе во время процесса, называемого негативной селекцией.
После связывания HLA II с TCR происходит пролиферация нужных T-клеток и выделение цитокинов, которые помогают им дифференцироваться. Для того чтобы эти T-клетки смогли связаться с HLA II, у них есть белок CD4, который «подтверждает» и стабилизирует связывание.

После дифференцировки CD4+ T-клетки выходят из фолликула и исполняют свою роль командира. Они выделяют цитокины, которые привлекают к месту инфекции другие клетки (базофилы, эозинофилы, тучные клетки и т.д.), и активируют макрофаги.
Тем временем наивные В-клетки (В-лимфоциты) ждут в фолликуле, когда приплывет антиген и они получат возможность принять участие в борьбе с патогеном.

Они действуют посредством поверхностных рецепторных молекул — В-клеточных рецепторов. В-клеточные рецепторы создаются с помощью высоко вариабельных генных перестроек. Наивная В-клетка ждет связывания своего BCR с антигеном. Она поглощает и представляет антиген на своем HLA II, и ждет встречи с CD4+ Т-клеткой, которая уже активировалась на тот же антиген. Прелесть рецепторов B-клеток (BCR) заключается в том, что благодаря случайной перестройке генов производится такое большое разнообразие рецепторов поверхности B-клеток, что практически любой чужеродный антиген, попадающий в организм, распознается ими.
T-лимфоцит помогает В-лимфоциту пролиферировать и начать продуцировать антитела, которые будут способны так же, как и В-клеточные рецепторы связывать антигены. Антитела связываются с антигенами на поверхности бактерий, а другим концом (Fc-концом) связываются с рецепторами на макрофагах (морская звезда на рисунке выше), после чего они фагоцитируют бактерию. Помимо этого, антитела на поверхности бактерий активируют систему комплемента, а также мешают бактерии прикрепляться к клеткам организма.
У 90% больных сахарным диабетом первого типа существует особый вариант HLA II (HLA-DQ8): он лучше связывается с антигеном, который несет относительный отрицательный заряд в определенных положениях (позициях 1 и 9). Инсулин считается аутоантигеном при СД1, то есть именно его распознают в качестве чужеродного агента иммунные клетки пациентов.

Обычно любой белок презентируется не целиком: клетки показывают только его наиболее иммуногенную часть. У инсулина такой частью являются аминокислоты 9–23 на В-цепи (B:9–23). Тем не менее презентация B:9–23 с помощью как нормального, так и мутантного (HLA-DQ8) HLA II для CD4+ T-клеток больных СД1 не приводит к их активации.
Недавно было открыто, что кровь людей, больных СД1, в сравнении со здоровой выборкой, оказывается обогащенной химерами Т- и В-клеток (Х-клетками) [3]. Антитела этих клеток имеют схожий с инсулином порядок зарядов аминокислотных остатков. Участки антител имеют лучшее сродство с инсулинспецифичными Т-клетками и активируют их, подстрекая развитие аутоиммунного ответа на инсулинпродуцирующие бета-клетки островков Лангерганса.

К сожалению, на данный момент неизвестно, какова природа возникновения химер Т- и В-клеток. Участие Х-клеток в развитии других заболеваний также остается загадкой.
Авторы предлагают проводить скрининг большего числа субъектов из группы риска и использовать данные об обогащении клонов Х-клеток в качестве прогностического признака. Также необходимо провести более качественный анализ RNA-seq, чтобы определить, являются ли Х-клетки отдельным новым типом клеток или присутствуют в организме в качестве субпопуляции одного из уже известных типов клеток.

Число людей, на которых было сделано это открытие, мало, но если результаты подтвердятся, то это станет захватывающим шагом к лучшему пониманию аутоиммунной природы сахарного диабета первого типа. Будет интересно увидеть будущие результаты этих исследователей.
- Иммунитет: борьба с чужими и… своими;
- Антитело: лучший способ распознать чужого;
- Rizwan Ahmed, Zahra Omidian, Adebola Giwa, Benjamin Cornwell, Neha Majety, et. al.. (2019). A Public BCR Present in a Unique Dual-Receptor-Expressing Lymphocyte from Type 1 Diabetes Patients Encodes a Potent T Cell Autoantigen. Cell. 177, 1583-1599.e16;
- Jan Černý, Ilja Stříž. (2019). Adaptive innate immunity or innate adaptive immunity?. Clin. Sci.. 133, 1549-1565;
- Immunopaedia.org;
- Murphy K. and Weaver C. Janeway’s immunobiology (9th Edition). Garland Science, 2016. — 924 p..
Источник