Изменение островкового аппарата поджелудочной железы
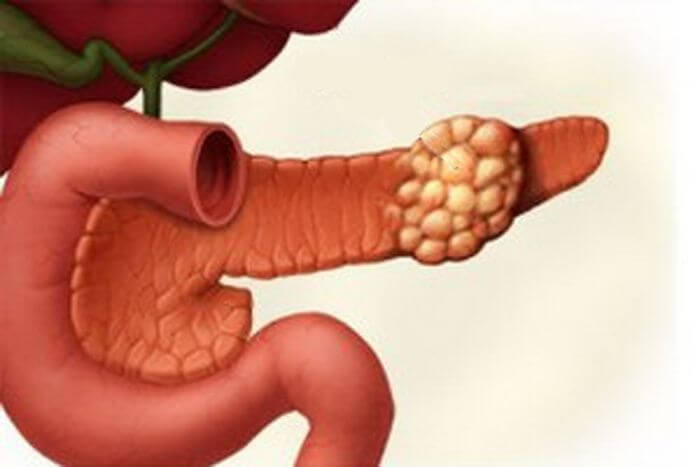
Опухоль поджелудочной железы симптомы и лечение. По своему происхождению новообразования в поджелудочной железе бывают доброкачественными или злокачественными.
Часто их выявляют после инструментального обследования других органов. На УЗИ однозначно вид опухоли не определить. При подозрении на новообразование в поджелудочной железе нужно обратиться к врачу, который назначит дополнительное всестороннее обследование.

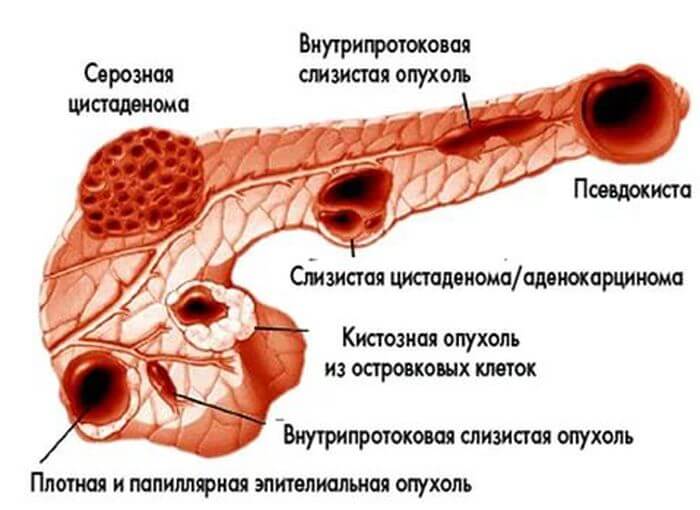
Классификация опухолей
Новообразование в поджелудочной железе разделяются:
По локализации — месту возникновения в структуре железы:
- головка;
- тело;
- хвост;
- островки Лангерганса;
- протоки.
Гистологическому строению определяется, из каких клеток образовалась опухоль:
- эпителиальное происхождение;
- железистой паренхимы;
- из островкового эпителия;
- неэпителиального генеза;
- дизонтогенетические.
Функциональным нарушениям – состояние, связанное с изменением регуляции в организме: гормональной или нервной. Орган остается неповрежденным, но деятельность поджелудочной железы нарушается.
Симптомы
Развитие опухоли до поры протекает без видимых симптомов. Когда она разрастается и возможно прорастает в близлежащие органы: желудок, тогда появляются типичные симптомы, с которыми доктор знаком. По симптомам он назначает всестороннее обследование.
Злокачественная опухоль поджелудочной железы проявляет свои симптомы при значительном разрастании:
Закупорка протоков
Закупорке протоков (обтюрация) – появляется при сдавливании образованием органов, которые нарушают свое функционирование, и проявляется болями, свидетельствующими о том, что новообразование просочилось сквозь нервные окончания. У каждого пациент симптомы проявляются индивидуально и зависят от места возникновения.
Опухоль головки поджелудочной железы провоцирует боль в правом подреберье. Опухоль хвоста поджелудочной железы вызывает дискомфорт и боль в левом подреберье. Если образованием охвачено тело поджелудочной железы, то боль проявляется вкруговую, опоясывающая.
Боль сильно увеличивается при несоблюдении диеты, а также лежа на спине. Сдавливание органов приводит к закупорке желчных протоков, проявляющееся в оттоке желчи из печени в кишечник. Результатом становится механическая желтуха. У нее свои симптомы:
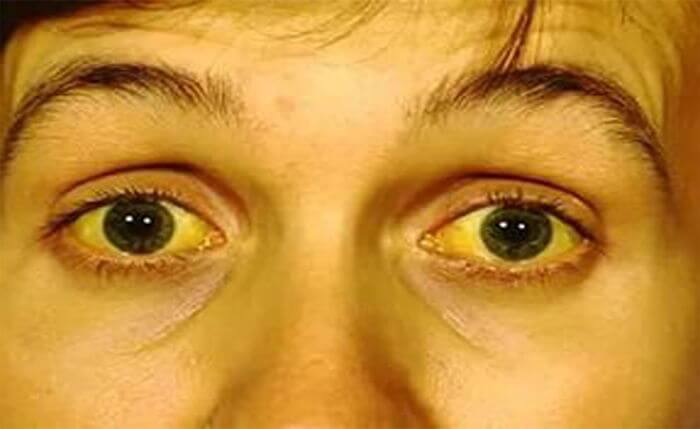
- желтушное окрашивание кожи, склер или слизистых оболочек;
- обесцвечивание стула;
- потемнение мочи;
- изменение размера печени и желчного пузыря в сторону увеличения;
- возникновение кожного зуда.
Рак поражает близлежащие органы, из которых может, в любой момент открыться кровотечение.
Интоксикация
Интоксикация организма. Ее признаки часто путают с признаками заболеваний и отклонений в ЖКТ. Симптомы похожи, но действие на организм интоксикации значительно тяжелее:
- резкое снижение веса;
- потеря аппетита;
- вялость, немощь, апатия;
- повышение температуры.
Доброкачественная опухоль поджелудочной железы позволяет классифицировать симптоматику 2 видов:
Ранняя стадия имеет бессимптомное течение, и приобретает их в процессе роста:
- боли вверху живота, подреберьях, правом или левом, отдающая в спину, усиливающаяся по ночам;
- дискомфорт и боль после приема пищи;
- постепенная потеря веса;
- тошнота, снижение аппетита, немощь и потеря трудоспособности.
Поздняя стадия – проявляется симптомами, как и при злокачественной опухоли. Помимо перечисленных выше, симптомов вызывает страх и нервные расстройства, повышает потоотделение. Симптомы могут возникать постепенно или внезапно. И они отличаются, завися от типа доброкачественного образования.
Риски возникновения
Точной причины появления раковых клеток нет. Но опухолевый процесс имеет свои факторы риска, о которых многие знают. Среди них:
- Вредные привычки: алкоголь, курение.
- Генная предрасположенность.
- Неправильное питание.
- Панкреатит.
- Неблагоприятная экологическая обстановка.
Диагностика
Всесторонне обследование пациента, используя различные методы исследования, позволит выяснить тяжесть опухоли: очаги, размеры, действие на соседние органы, метастазирование.
Обследование поможет определиться с методикой лечения:
- УЗИ. Позволяет увидеть новообразование, очаг его распространения.
- Компьютерная томография с введением контрастного вещества выявит не только очаги опухоли, но и метастазы, если они есть.
- Рентгенологические методы: А) Рентгенография определяет последствия прорастания опухоли на желудок и двенадцатиперстную кишку, сдавливание органов, диффузия слизистых оболочек, снижение моторики. В) Релаксационная дуоденография определяет локализацию опухоли и последствия ее разрастания. С) Ирригография выявляет дефекты в поперечно-ободочной кишке в результате прорастания опухоли.
- Эндоскопическая ретроградная холангиопанкреатография позволяет осмотреть желчную и панкреатическую системы с целью выявления их поражений. Взять материал для биопсии из неблагополучных очагов.
- Эндоскопический ультразвук. За счет технического оснащения: эндоскоп, видеокамера, ультразвуковой датчик, возможно, исследовать новообразование, введя инструменты через кишку. Такое исследование позволяет выявить новообразование на ранних стадиях.
- Рентгенохирургическая диагностика с контрастом позволяет выявить причины механической желтухи и смещение артерий.
- Радионуклидное исследование позволяет выявить закупорку общего с поджелудочной железой желчного протока.
- Нашумевший спорный тестер Джека Андраки, основан на анализе крови или мочи, используя специальную бумагу.
Главное в диагностике — установка медицинского диагноза на основании интерпретация полученных результатов исследования и анализов, формирование экспертного заключения.
Лечение
Необходимое лечение подбирается доктором на основании диагностики и анализов.
Хирургическая терапия всегда показана при обнаружении доброкачественного образования. Исследование гистологии со срезов образования позволит точно установить была ли она доброкачественной. Основные операции по удалению новообразований:
- Резекция состоит в удалении части поджелудочной железы, чаще в ее хвосте.
- Удаление непосредственно образования способом вылущивания. Выполняются для опухолей, которые продуцируют гормоны: доброкачественная инсулома.
- Панкреатодуоденальная резекция производится в случае размещения образования на головке железы. Оно удаляется вместе с 12-перстной кишкой.
- Селективная артериальная эмболизация закупоривает сосуд, на котором растет образование с целью отключить подпитку кровоснабжением. Используется при гемангиоме.
Химиотерапия
Химиотерапия призвана лечить злокачественное образование при помощи токсинов и ядов, которые называются химиопрепаратом. Она бывает: предоперационной, послеоперационной, профилактической, лечебной.
Поскольку раковые клетки бесконечно делятся, то химиотерапия циклично повторяется в расчете с клеточным циклом деления. Процедура состоит из капельного введения препарат или приёмом таблеток.
Наружная радиотерапия, являющаяся разновидностью терапии лучевой. Суть излечения — бомбардирование зоны новообразования излучением от медицинского ускорителя в виде пучка элементарных частиц. Проводится сеансами через фиксированный промежуток времени. Показания к применению:
- Сокращение размера опухоли на поджелудочной железе перед хирургическим вмешательством.
- Локально-возникшем раке поджелудочной железы.
- Уменьшение страданий при метастазах.
- Предотвращение рецидивов рака после хирургической операции.
Симптоматическая терапия направлена на снятие болей и облегчения страданий умирающего пациента: гормональная терапия – это лечение с помощью применения гормонов, способных тормозить рост рака. Продлевает продолжительность жизни.
Виротерапия применяет онкотропные или онколитические вирусы в терапевтических целях, мобилизуя против злокачественных клеток естественные защитные силы иммунной системы организма.
Нанонож как необратимая электропорация, разрушающая раковые клетки путем воздействия на них электрическим полем большой интенсивности локализовано. Для этого применяется специальный аппарат — нанонож.
В настоящее время слывет одним из самых результативных способов уничтожения опухоли в поджелудочной железе. Факт возможности повторения процедуры важное обстоятельство для повторного проведения при рецидивах или неоперабельном раке.
Шансы на выздоровление или жизнь после оперативного лечения
Сама операция на поджелудочной железе мало опасна. Прогноз оптимистичней при ранних сроках выполнения операции. Полностью выздоравливают пациенты с доброкачественными опухолями: глюкагономы, инсуломы, гастриномы и их разновидности
Рак поджелудочной железы имеет печальную статистику:
- На операцию поступают пациенты, у которых отсутствуют множественные метастазы, А это, как правило, лишь 15% больных. Для 85 % предоставляются виды лечения, направленные на продление жизни.
- Смертность на операционном столе у одного пациента из 6.
- Продолжительность жизни до 5 лет у каждого десятого больного после хирургического вмешательства, у остальных меньше.
После оперативного лечения возможны осложнения в функционировании организма. Любая операция влечет приспособление организма к потере органа или его части. Если орган жизненно важен, то адаптация проходит тяжелее. У пациентов после удаления опухоли поджелудочной железы, симптомы и лечение влекут 2 проблемы: сбои при пищеварении, снижение инсулина в организме.
Решаются проблемы дефицита путем назначения медикаментозных препаратов. При сопутствующих удалениях частей близлежащих органов: желудка, селезенки, двенадцатиперстной кишки врач посоветует надлежащую терапию и диету.
Профилактика
Поскольку ученые неутомимо работают над вопросом изучения причин, дающих толчок развитию рака, а ответа на них нет со 100 % достоверностью, поэтому руководства во избежание заболевания нет.
Лучший способ профилактики исключить знакомые всем факторы риска. Быть внимательным к себе при проявлениях болей в месте расположения железы. Не откладывать визит к доктору и хотя бы поверхностное обследование УЗИ.
Опухоль поджелудочной железы симптомы и лечение животрепещущая тема для многих страдающих заболеванием.
Источник
Поджелудочная (панкреатическая) железа относится к органам с двойной секрецией. Внешнесекреторный аппарат железы вырабатывает составные части панкреатического сока, экскретируемо-го в двенадцатиперстную кишку. Около 1,5—2% массы железы приходится на эндокринную ткань (островки Лангерганса) — группы скоплений специальных паренхиматозных клеток. Кровоснабжение поджелудочной железы осуществляется поджелудочно-двенадцатиперстной артерией и ветвями селезеночной артерии, причем кровоснабжение островков Лангерганса существенно обильнее, чем других частей органа. Вены поджелудочной железы впадают в воротную вену через селезеночную или верхнюю брыжеечную вену. Иннервируется железа ветвями блуждающего и симпатического нервов.
В островках Лангерганса имеется несколько видов клеток: β-клетки, расположены ближе к центру островков и составляют до 60—70 % всех клеток; δ-клетки (2—8 %) — предшественники других клеток островков и α-клетки (около 25 %), находятся ближе к периферии островков. Протоплазма α- и β-клеток содержит гранулы, а δ-клетки негранулированы. α-Клетки неаргирофильны и являются местом образования глюкагона; β-клетки образуют инсулин, δ-клетки — соматотропин. РР-клетки, также имеющиеся в железе, расположены по периферии островков и в паренхиме возле протоков малого и среднего диаметра. Они секретируют панкреатический полипептид. В островках выявлено некоторое количество клеток — продуцентов вазоактивного интерстициального пептида (ВИП) и гастроинтерстициального пептида (ГИП).
Инсулин — низкомолекулярный белок с молекулярной массой около 6000 Д. В его состав входит 16 аминокислот и 51 аминокислотный остаток. В настоящее время синтезирован искусственным путем. Он образуется из проинсулина под влиянием протеаз; его активность составляет около 5 % активности инсулина. Считается, что биологический эффект инсулина связан с его способностью соединяться со специфическими рецепторами цитоплазматических мембран клеток, после чего передается сигнал на систему цАМФ через фермент аденилатциклазу оболочки клетки цАМФ, который регулирует синтез белка и утилизацию глюкозы при участии Са++ и Мg++.
С кровью инсулин поступает в печень, где около половины его инактивируется под воздействием инсулиназы, а остальная часть связывается с белками, частично оставаясь свободной.
Из печени инсулин поступает в кровь в свободном и связанном с белками состоянии. Это соотношение регулируется уровнем гликемии. При понижении сахара в крови преобладает белковосвязанная фракция, а при гипергликемии — свободный инсулин, который действует на инсулиночувствительные субстанции, а связанная фракция — только на жировую ткань, в которой имеются пептидазы, освобождающие инсулин из связанного состояния. Период полураспада инсулина — около 30 мин. Инсулин кроме печени инактивируется в жировой ткани, мышцах, почках, плаценте.
Основным биостимулятором синтеза инсулина является глюкоза, под влиянием которой в поджелудочной железе синтез инсулина повышается, а с уменьшением ее — снижается.
Стимуляторами освобождения и секреции инсулина являются также СТГ, АКТЕ, глюкокортикоиды, глюкагон, секретин, аргинин, лейцин, гастрин, бомбезин, панкреозимин, желудочный ингибитор — полипептид, нейротензин, β-адреностимуляторы, сульфаниламиды, соматостатин.
Соматостатин — 14-членный пептид, обнаружен в гипоталамусе, образуется также в δ-клетках островков Лангерганса, клетках щитовидной железы, желудка и лимфоидных органов. Он подавляет секрецию ТТГ, СТГ, АКТГ, гастрина, секретина, мотилина, ренина, вазоактивного желудочного пептида (ВЖП), панкреатических ферментов, желудочного сока; снижает перистальтику кишечника, сократимость мочевого пузыря, абсорбцию ксилозы. Под его влиянием уменьшается освобождение ацетилхолина из нервных окончаний и электровозбудимость нервов. Является ингибитором секреции инсулина и глюкагона. Парасимпатическая стимуляция увеличивает секрецию инсулина, а симпатическая — уменьшает. Важную роль в секреции инсулина играют холинэргитические волокна блуждающего нерва.
Инсулинстимулирует перенос Сахаров через мембрану клеток жировой, мышечной, почечной тканей; усиливает фосфорилирование, окисление и превращение глюкозы в гликоген и жиры; способствует превращению жирных кислот в триглицириды жировой ткани; стимулирует синтез липидов; ингибирует липолиз и активность глюкозо-6-фосфатазы; стимулирует образование макроэргических связей, транспорт аминокислот через цитоплазматические мембраны; ослабляет глюкогенолиз из белка; способствует его синтезу из аминокислот. Все ткани, кроме нервной, сетчатки, почечной и эритроцитов, чувствительны к инсулину.
Глюкагонявляется антагонистом инсулина. Это полипептид, состоящий из 29 аминокислотных остатков с молекулярной массой 3485 Д. Он усиливает распад гликогена в печени и тормозит его синтез; усиливает липолиз, гликонеогенез, биосинтез глюкозы из аминокислот; способствует снижению кальциемии и фосфатемии, выходу калия из печени, отчего наступает значительная, но скоротечная гиперкалиемия, сменяющаяся затем гипокалиемией, которая обусловлена гиперкалийурией и усилением депонирования калия клетками.
Секреция глюкагона снижается при гипергликемии, повышении в крови свободных жирных кислот и под влиянием соматостатина.
Глюкагон тормозит агрегацию тромбоцитов, способствует увеличению минутного объема кровотока. Под его влиянием увеличивается образование СТГ, инсулина, катехоламинов, кальцитонинов, выделение воды и электролитов с мочой, а секреция панк-реозимина, гастрина, панкреатических ферментов снижается.
Кроме панкреатического глюкагона известен также кишечный глкжагон, секретируемый α-клетками слизистой оболочки желудка и кишечника. Он усиливает липолиз, гликогенолиз, стимулирует секрецию инсулина. Секреция кишечного глюкагона повышается при поступлении в кишечник пищи и соединений кальция.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
И УГЛЕВОДНЫЙ ОБМЕН
Углеводы являются основным энергетическим материалом, реализующимся при распаде глюкозы в цикле Кребса (аэробном цикле трикарбоновых кислот) на Н2О и СО2. Образование гликогена из моно- и дисахаридов, гексоз и пентоз происходит под влиянием инсулина, а основное количество углеводов у жвачных расщепляется в преджелудках под воздействием микрофлоры до ЛЖК, а у моногастричных — в тонком кишечнике под влиянием ферментов поджелудочной железы (мальтазы, амилазы, лактазы) до моносахаридов. Более 85 % моносахаридов переходят в глюкозу уже в тонком кишечнике и около 15 % — в печени. В процессах фосфорилирования глюкоза является активным звеном окисления, синтеза гликогена и жира. На первом этапе фосфорилирования образуется гексозомонофосфат:
глюкоза + АТФ -> гексакиназа -> гексозомонофосфат + АДФ.
Особенностью этого превращения является то, что к молекуле глюкозы присоединяется не простая (неорганическая), а обогащенная энергией фосфорная кислота (макроэргическая связь), что делает глюкозу биологически активной, причем активатором гексокиназы в этом процессе является инсулин. Проникая через стенку кишечника и под влиянием фосфатазы дефосфорилируясь, глюкоза поступает в портальное кровообращение, теряя физиологическую активность. В печени она вторично фосфорилируется, образуя глюкозо-6-фосфат (Г-6-Ф), становясь снова физиологически активной под действием инсулина, и образует гликоген. Значение этого цикла в том, что он является единственным источником рибозо-5-фосфата, используемого в синтезе РНК. При окислении глюкозы в пентозном цикле образуется основная часть восстановленного NАДН — никотинамидадениндинуклеотида, необходимого для синтеза жирных кислот. В анаэробном цикле окисляется около 25 % Г-6-Ф, а около 55 % под влиянием глкжозо-6-фосфатазы, освобождаясь от фосфорной кислоты, из печени переходит в общий проток. 9 % из 55 (принятых за 100 %) этой глюкозы превращается в гликоген мышечной ткани, а около 30 % — в жир. Основная часть глюкозы (около 60 %) окисляется в тканях, обеспечивая энергетический баланс организма в анаэробном (с образованием молочной кислоты) и аэробном (с образованием Н2О и СО2) циклах. Молочная кислота в печени и мышцах может ресинтезироваться в гликоген, а образовавшаяся в аэробном гликолизе пировиноградная кислота декарбоксилируется с образованием ацетилкоэнзима А (ацетил-КоА), который необходим в дальнейшем синтезе жирных кислот, кетоновых (ацетоновых) тел, холестерина. В цикле ди- и трикарбоновых кислот в легких, почках, мышцах и частично в печени ацетил-КоА окисляется до Н2О и СО2, а катализатором этого процесса является инсулин. Аэробный гликолиз является наиболее эффективным — в его процессе образуется 36 молекул аденозинтрифосфорной кислоты (АТФ), тогда как в анаэробном только две молекулы АТФ.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
И ЛИПИДНЫЙ ОБМЕН
Основной резерв энергии организма — жиры. Из жировых депо жиры в виде свободных неэстерифицированных жирных кислот (НЭЖК) поступают в кровь, а затем в печень, где диализируются и используются тканями как энергетический материал. НЭЖК доставляют около 50 % тепловой энергии основного обмена.
Триглицериды жировых депо, поступая в кровь, образуют комплексы с α- и β-глобулинами и затем выходят из них в виде α- и β-липопротеидов. В норме жир в печени не задерживается, а откладывается в жировых депо. Этот процесс активируется гепарином, продуцируемым тучными клетками. Нормальными промежуточными продуктами обмена НЭЖК являются ацетоновые (кетоновые) тела, содержание которых в крови здоровых животных составляет в среднем 2—7 мг%. Кетоновые тела образуются в основном в печени. Усиленный кетоногенез (при недостаточности аэробного цикла, энергетическом голодании) — причина ацетонемии, кетоза, являющихся причиной дистрофии внутренних органов (миокарда, почек, печени), яловости, ацетонурии, ацетонолактии, «голодных» кетозов овец и свиней.
Непосредственно участвуют в обмене жиров фосфолипиды, способствующие окислению жира через стадию лецитина. Они же повышают устойчивость холестерина в крови, что препятствует его отложению в стенках сосудов.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
И БЕЛКОВЫЙ ОБМЕН
Более половины белков сыворотки крови (6—8 г%) составляют альбумины. Остальная часть их представлена α1-, α2-, β- и γ-глобулинами.
Альбумины синтезируются в паренхиматозных клетках печени, а глобулины — в ретинулоэндотелиальной системе (РЭС). Все питательные вещества в процессе обмена между кровью и клетками тканей проходят через основное вещество соединительной ткани, важнейшими элементами которой являются коллагеновые и эластические волокна белковой природы. Из этого следует, что любой фактор или состояние, влияющие на обмен белка, оказывают воздействие и на них.
Высокомолекулярные линейные полиэлектролиты соединительной ткани называются кислыми мукополисахаридами, а в соединении с белком — мукопротеидами (мукополисахаридными комплексами). В крови имеются также гликопротеиды — белки с содержанием около 4 % избытка глюкозамина.
Повышение белкового синтеза происходит под влиянием инсулина вследствие усиления переноса аминокислот в цитоплазму, активации ферментов пептидного цикла и усиления утилизации глюкозы (источника энергии макроэргических связей). Наряду с инсулином синтез белка стимулирует соматотропный гормон гипофиза (СТГ). Наоборот, АКТЕ, ТТГ, глюкокортиноиды, гормоны щитовидной железы стимулируют диализ белка до аминокислот.
САХАРНЫЙ ДИАБЕТ
Сахарный диабет представляет собой синдром хронической гипергликемии вследствие генетических и экзогенных факторов на почве абсолютного или относительного дефицита инсулина, сопровождающийся нарушением промежуточного обмена, особенно углеводного. Принято выделять три пути развития инсулинзави-симого сахарного диабета: 1) предрасположенность к аутоиммунному нарушению островков Лангерганса; 2) повышенная чувствительность β-клеток к вирусам и 3) ослабление противовирусного иммунитета. Чаще возникает в критические периоды — максимального роста и продуктивности, гормональной, иммунологической и других видов перестройки.
Сахарный диабет может возникать вторично — при панкреатитах, кистах, опухолях поджелудочной железы, гемохроматозах, особенно при эндокринных нарушениях других желез внутренней секреции, от ятрогенных причин, длительного применения диуретиков (особенно диазидов, кортикостероидов), при нарушениях кормления (длительное кормление турнепсом, брюквой, репой, капустой). Он чаще бывает вследствие относительной внепанкреатической инсулиновой недостаточности, чем абсолютной (панкреатической).
Патогенез инсулинзависимого сахарного диабета связан с деструкцией β-клеток, что приводит к абсолютному недостатку инсулина — «вирусному» или аутоиммунному. Повреждение более 90 % клеток поджелудочной железы приводит к развитию клинических симптомов диабета.
При дефиците инсулина понижается проницаемость для глюкозы цитоплазматических мембран в мышечной и жировой тканях, снижается ее фосфорилирование и окисление глюкозы, переход в спирт, усиливается гликонеогенез из белка и выделение углеводов из печени в кровь. Это приводит к неполной утилизации углеводов тканями — гипергликемии. В крови повышается содержание молочной кислоты — продукта анаэробного гликолиза. Возникает глюкозурия, полидипсия, ацетонемия, гипергликемия, что приводит к повышению осмотического давления крови и нарушению функций ЦНС. Нарушается липидный обмен (увеличение содержания в крови НЭЖК). Печень подвергается жировой дистрофии. Возрастает холестеринемия. Снижение концентрации фосфолипидов, гиперхолестеринемия, повышение содержания β-липопротеидов при диабете предрасполагают к ангиопатиям, атеросклерозу. Липоидозу способствует уменьшение расщепления триглицеридов в стенке сосудов, нарушается синтез, усиливается распад белков. Содержание альбуминов снижается, α1-, β – и γ-глобулинов повышается, что связано как с недостатком инсулина, так и с недостаточностью гипофиза, надпочечников и половых желез. Это приводит к ретенционной азотемии и гиперазотурии. Нарушение промежуточного обмена приводит к снижению сопротивляемости инфекциям, тяжелым ангиопатиям.
В клинической стадии на передний план выступают полидипсия, полифагия, сухость слизистых ротовой полости, полиурия, ацетонурия, ацетонолактия, ацидоз, общая слабость, снижение и утрата продуктивных показателей, зудливость, сухость кожи, остеопороз, костно-суставная патология, изменения ЭКГ, протеинурия, ретинопатия, возможны гангрена конечностей, хвоста, нарушение пищеварения, признаки нарушения функций ЦНС, гипергликемическая кома.
Для диагностики редких форм сахарного диабета применяют исследование «сахарной кривой» — динамики уровня сахара в крови после сахарной нагрузки. Чем медленнее возвращается уровень гликемии к исходному показателю (до сахарной нагрузки), тем сильнее выражен сахарный диабет.
Источник
