Избыточный инсулин поджелудочной железы

Эндокринолог Елена Шведкина о редкой патологии поджелудочной железы опухолевой природы
Синдром Харриса — это спонтанные приступы гипогликемии, вызванные повышенной нерегулируемой секрецией инсулина. В литературе встречаем синонимы: органический гиперинсулинизм, гипогликемический синдром, инсулинома, эндогенный гиперинсулинизм и гипогликемическая болезнь. Синдром впервые описал в 1924 г. американский врач Сил Харрис Harris Seale (1870–1957) [1]. В этом же году параллельно с ним это сделал отечественный хирург Владимир Оппель, но в медицинских кругах синдрому было присвоено имя Харриса.
Обнаружению и дальнейшему исследованию данной патологии предшествовали несколько важных научных открытий. Первое — открытие Паулем Лангергансом в 1869 г. островков в поджелудочной железе, ответственных за выработку инсулина. Эти островки были названы островками Лангерганса. Второе — революционное исследование, а именно выделение инсулина, проведенное в Канаде Фредериком Бантингом и Чарлзом Бестом в 1922 г., и появление информации о клинических признаках передозировки инсулина.
В дальнейшем была установлена взаимосвязь между избыточным уровнем инсулина и развитием симптомов гипогликемии [2]. Всё это позволило вскоре выявить основную причину развития гиперинсулинизма и гипогликемий — опухоли бета-клеток островка Лангерганса, секретирующие избыточное количество инсулина. Подобные опухоли были названы инсулиномами (от лат. insulin — «пептидный гормон, вырабатываемый бета-клетками островков Лангерганса» и лат. oma — «опухоль», «образование»).
Этиология и патогенез
Развитие синдрома Харриса может быть обусловлено:
- доброкачественной или злокачественной опухолью бета-клеток островка Лангенгарса (инсулиномы)
- диффузным аденоматозом или диффузной гиперплазией островкового аппарата поджелудочной железы [3].
Инсулинома — одна из наиболее часто встречающихся нейроэндокринных опухолей поджелудочной железы. Она составляет почти 80 % от всех известных гормональных новообразований поджелудочной железы. Встречаются инсулиномы нечасто — 2–4 случая на 1 миллион населения в год. Инсулинсекретирующая опухоль описана во всех возрастных группах — от новорожденных до престарелых, тем не менее чаще она проявляется в наиболее трудоспособном возрасте — от 30 до 55 лет. Среди общего числа больных дети составляют около 5 %. У женщин инсулинома встречается в 2 раза чаще, чем у мужчин. У большинства больных инсулинома бывает доброкачественной (80–90 %), у 10–20 % имеет признаки злокачественного роста [1]. Инсулиномы могут быть как спорадическими (обычно одиночными) опухолями, так и множественными (наследственно обусловленными). Чаще инсулиномы локализуются в поджелудочной железе, но в 1–2 % случаев могут развиваться в воротах селезёнки, печени или в стенке двенадцатиперстной кишки [4].
Глюкоза — важнейший источник энергии для жизнедеятельности клеток, в частности клеток мозга. Внутри клеток свободная глюкоза практически отсутствует, накапливаясь в виде гликогена. Глюкоза входит в молекулы нуклеотидов и нуклеиновых кислот. Глюкоза необходима для синтеза некоторых аминокислот, синтеза и окисления липидов, полисахаридов. Концентрация глюкозы в норме в крови человека поддерживается в относительно узких пределах — 2,8–7,8 ммоль/л, вне зависимости от пола и возраста, несмотря на большие различия в питании и физической активности. Это постоянство обеспечивает ткани мозга достаточным количеством глюкозы, единственного метаболического топлива, которое они могут использовать в обычных условиях [5].
Инсулин — анаболический гормон, усиливающий синтез углеводов, белков, жиров и нуклеиновых кислот. Он влияет на углеводный обмен: увеличивает транспорт глюкозы из крови в клетки инсулинзависимых тканей (жировую, мышечную, печеночную), стимулирует синтез гликогена в печени и подавляет его расщепление, а также подавляет синтез глюкозы (гликонеогенез). Закономерно инсулин снижает уровень глюкозы в крови. Гиперинсулинизм вызывает многочисленные нарушения в гомеостазе и прежде всего в функциях центральной нервной системы, поскольку мозг не имеет запасов углеводов, в нем не происходит синтеза глюкозы, а расход ее велик и постоянен (до 20 % от циркулирующей в крови). Гипогликемия также влияет на кардиоваскулярную и гастроинтестинальную деятельность [4]. У здоровых людей угнетение выработки инсулина после всасывания глюкозы в кровь начинается при концентрации 4,2–4 ммоль/л, а при дальнейшем снижении концентрации глюкозы сопровождается выбросом контринсулярных гормонов.
Клинические проявления
Симптомы инсулином обусловлены гипогликемией, которая стимулирует секрецию катехоламинов — адреналина и норадреналина, и влечет за собой дефицит глюкозы в головном мозге, что равносильно снижению потребления кислорода нервными клетками [6].
Клиническая картина включает две группы симптомов — острой и хронической гипогликемии. Период острой гипогликемии развивается в результате срыва механизмов адаптации центральной нервной и эндокринной систем. Основные симптомы этого периода: слабость, потливость, чувство голода, тошнота, рвота, раздражительность, ухудшение зрения, помутнение в глазах, онемение губ и языка, сердцебиение, мышечная дрожь, боли в области сердца, судорожные подергивания мышц и даже настоящие судороги. Недостаток глюкозы в головном мозге (нейрогликопения) обусловливает психическое возбуждение, галлюцинации, бред, ретроградную амнезию, агрессивность, негативизм, дезориентацию в лицах, во времени, в пространстве, болтливость, нецензурность выражений. Происходит как бы выключение коры головного мозга, «буйство подкорки». Далеко зашедшая гипогликемия приводит к развитию гипогликемической комы. Наиболее часто острая гипогликемия развивается рано утром (в связи с ночным периодом голодания), больной или «не может проснуться», или просыпается с трудом, при этом обнаруживается вышеизложенная клиника. Глубокая кома может привести к необратимым изменениям ЦНС (децеребрации) и смерти.
Период хронической гипогликемии (межприступный период) характеризуется симптомами хронического повреждения ЦНС: головные боли, снижение памяти, умственной работоспособности, постоянное чувство голода (больные часто едят, особенно много употребляют углеводов и прибавляют в весе), патологические рефлексы Бабинского, неадекватное поведение [7].
Дифференциальный диагноз
Симптомы гипогликемии отличаются полиморфизмом и неспецифичностью. Наличие нервно-психических нарушений и малая распространённость заболевания часто приводят к диагностическим ошибкам. Как правило, требуется дифдиагностика с такими состояниями, как эпилепсия, кататония, гебефрения, неврастения, истерия, мигрень, психоз, алкогольная болезнь, опухоли головного мозга, нейровегетативная дистония с гипогликемическими состояниями. Однако для синдрома Харриса патогномоничной является триада Уиппла:
- возникновение приступов гипогликемии после длительного голодания или физической нагрузки
- снижение содержания глюкозы крови во время приступа ниже 1,7 ммоль/л у детей до двух лет и ниже 2,2 ммоль/л — старше двух лет
- купирование гипогликемического приступа внутривенным введением глюкозы или пероральным приемом растворов глюкозы [4].
Диагностика
На первом этапе золотой стандарт диагностики синдрома Харриса — не слишком гуманная проба с голоданием в течение 72 часов. Она считается положительной при развитии триады Уиппла. Начало голодания отмечают как время последнего приема пищи. Уровень глюкозы в крови оценивают через 3 часа после последнего приема пищи, затем через каждые 6 часов, а при снижении уровня глюкозы в крови ниже 3,4 ммоль/л интервал между ее исследованиями сокращают до 30–60 мин. Скорость секреции инсулина при инсулиноме не угнетается при снижении уровня глюкозы в крови.
Кроме того, при инсулиноме инсулин/гликемический индекс (отношение уровня инсулина к уровню глюкозы) превышает 1,0, а в норме составляет не более 0,3. Также при инсулиноме резко повышена концентрация С-пептида.
Второй этап диагностики инсулиномы — лоцирование опухоли. Используют УЗИ, компьютерную томографию, магниторезонансную томографию, эндоскопическое УЗИ, сцинтиграфию, ангиографию, интраоперационное УЗИ. Наиболее информативны в диагностике инсулином эндоскопическое ультразвуковое исследование (эндо-УЗИ) и забор крови из печеночных вен после внутриартериальной стимуляции поджелудочной железы кальцием. С помощью современных методов исследования удается на дооперационном этапе у многих пациентов установить локализацию опухоли, ее размер, стадию и темпы прогрессирования, выявить метастазы.
Лечение и прогноз
Лечение инсулиномы в большинстве случаев хирургическое: энуклеация опухоли, дистальная резекция поджелудочной железы при соответствующей локализации. Консервативная терапия проводится в случае нерезектабельной опухоли и ее метастазов, а также при отказе пациента от оперативного лечения. Пятилетняя выживаемость среди радикально прооперированных пациентов — 90 %, при обнаружении метастазов — 20 % [8].
Источники
- Клиническая эндокринология: руководство (3‑е изд.)/Под ред. Н. Т. Старковой. — СПб: Питер, 2002. — 576 с.
- MedUniver
- MedUniver
- Эндокринология. Том 2. Заболевания поджелудочной железы, паращитовидных и половых желез. Под ред. С. Б. Шустова. — СПб: СпецЛит, 2011. — 432 с.
- Балаболкин М. И., Клебанова Е. М., Креминская В. М. Дифференциальная диагностика и лечение эндокринных заболеваний (руководство). М.: «Медицина», 2002. — 751c.
- Dizon A. M. et al. Neuroglycopenic and other symptoms in patients with insulinoma // Am. J. Med. 1999, p. 307.
- Окороков А. Н. Диагностика болезней внутренних органов. Том 2. — М. Мед. лит., 2008–576 с.
- Калинин А. П. и соавт. Инсулинома. Медицинская газета, 2007, № 45, с. 8–9
Источник
Инсулин – это гормон, вырабатываемый поджелудочной железой, который необходим для метаболизма углеводов и, в меньшей степени, жиров. Благодаря инсулину энергия (глюкоза) из пищи переносится из крови в клетки. Таким образом снижается уровень сахара в крови и обеспечивается питание клеток.
Когда уровень инсулина в норме, уровень сахара в крови в норме. Когда инсулин слишком низкий (или не работает должным образом), диагностируется диабет. Когда уровень инсулина высокий, а уровень сахара в норме, мы говорим об инсулинорезистентности.
Диабет 1 типа, диабет 2 типа и инсулинорезистентность – это проблемы со здоровьем, которые связаны с инсулином – гормоном, необходимым для жизни. Он нужен организму в строго определенном количестве. Опасны как дефицит инсулина, так и его чрезмерный избыток.
Какую роль инсулин играет в организме? Когда следует проверять его уровень? Что происходит, когда инсулина слишком мало или слишком много?
Как действует инсулин
Инсулин – это гормон, понижающий уровень сахара в крови. Его образно называют ключом, открывающим клетки энергии из пищи. Источником энергии для организма являются углеводы. Энергия из простых углеводов проникает в кровь практически сразу после еды, сложные углеводы сначала нужно расщепить на простые сахара – глюкозу в процессе пищеварения. Она циркулирует в крови и попадает в клетки только в присутствии инсулина. Без инсулина клетки не могут получать энергию из пищи, даже если в крови много глюкозы.
Механизм действия инсулина
Отсюда взаимосвязь между уровнем сахара и инсулином. Когда этот гормон отсутствует, глюкоза не попадает в клетки, она остается в крови, что приводит к гипергликемии. Состояние диагностируют в лабораторных исследованиях или с помощью глюкометра.
Важно отметить, что инсулин не снижает уровень сахара в крови до нуля, то есть не вся энергия из пищи поступает в клетки. Строго определенное количество сахара остается в крови и является топливом, необходимым для работы мозга. Мозгу постоянно нужна глюкоза, это орган, не зависящий от действия инсулина, он забирает сахар из крови без этого гормона.
Вот почему в крови здорового человека содержится определенное количество сахара, которое в лабораторных условиях дает результат в диапазоне 70-99 мг/дл глюкозы натощак.
Инсулин – это белок. Поэтому его следует принимать в виде подкожной инъекции. Таблеток инсулина не существует, потому что они перевариваются в пищеварительном тракте.
Подкожная инъекция инсулина
Инсулин и глюкагон
Инсулин вырабатывается в ответ на повышение уровня глюкозы в крови. После обильной еды с большим количеством углеводов уровень этого гормона в кровотоке значительно увеличивается. Между приемами пищи и ночью уровень инсулина ниже.
Гормон, противоположный инсулину, – это глюкагон, повышающий уровень сахара в крови. В здоровом организме эти два гормона остаются в равновесии. Глюкагон высвобождается, когда сахар в крови начинает слишком низко падать (например, ночью), а инсулин – когда сахар в крови начинает слишком сильно повышаться.
Благодаря сбалансированной секреции этих двух гормонов, у здорового человека уровень сахара остается нормальным как после обильной еды, так и в результате многочасового голодания.
Инсулин – анаболический или строительный гормон, благодаря которому можно выращивать клетки (неиспользованная глюкоза превращается в жир). Высокий уровень инсулина в организме, типичный для инсулинорезистентности, способствует увеличению избыточного веса.
Когда не хватает инсулина
Отсутствие или тяжелая недостаточность инсулина означает диабет типа 1. Это заболевание диагностируется по заметно повышенному уровню сахара в крови (гипергликемия). Его лечение заключается в восполнении дефицита инсулина. Причина нехватки инсулина у пациентов с диабетом 1 типа – это разрушение иммунной системой бета-клеток поджелудочной железы (аутоиммунное заболевание).
Сегодня на рынке представлено множество препаратов инсулина. Инсулин животного происхождения ушел в прошлое, сегодня применяются так называемый человеческий инсулин и аналог инсулина.
Инсулины различаются не только способом их получения, но и временем действия. В инсулиновой терапии используются инсулины короткого действия, 3-5 часов, которые следует принимать во время еды, и базальные инсулины, действующие в течение 18-24 часов, которые сохраняют нормальный уровень сахара в крови между приемами пищи.
Симптомы нехватки инсулина:
- Очень сильная жажда;
- Отхождение большого количества мочи;
- Похудение – клетки голодают, не могут получать энергию из крови, организм начинает сжигать жир, что приводит к потере веса.
Очень сильная жажда
Похудение
До того как был «изобретен» инсулин, диабет 1 типа считался смертельным заболеванием. Пострадавшие пациенты гибли от крайнего недоедания. Поскольку теперь инсулин производят в лабораториях, и он доступен всем, диабет 1 типа перешел в разряд хронических заболеваний.
Когда слишком много инсулина
Избыток инсулина тоже вреден для организма. Мы имеем дело с высоким уровнем инсулина в крови при:
- сахарном диабете 2 типа;
- резистентности к инсулину.
Инсулинорезистентность – это нарушение обмена веществ, диабет 2 типа – это заболевание, которое возникает в результате инсулинорезистентности, поэтому эти проблемы можно обсуждать вместе. Они отличаются тем, что гликемия нормальна при инсулинорезистентности и повышена при диабете 2 типа.
Инсулинорезистентность
Высокая концентрация инсулина возникает, когда поджелудочная железа вынуждена производить избыточный инсулин. Когда это происходит? Когда клетки организма нечувствительны к инсулину (другими словами – устойчивы к нему). Чтобы преодолеть это сопротивление, поджелудочная железа вырабатывает повышенное количество гормона, что дает побочные эффекты:
- Инсулин стимулирует аппетит;
- Как анаболический гормон, он способствует увеличению веса.
Выработка большого количества инсулина ложится нагрузкой на поджелудочную железу, она перестает быть эффективной в этом процессе. Поэтому на основе инсулинорезистентности развивается диабет 2 типа.
Когда проверяют уровень инсулина?
Уровни инсулина проверяются в трех случаях:
- У пациентов с диабетом 1 типа, как правило, сразу после постановки диагноза, чтобы узнать, секретирует ли поджелудочная железа больше инсулина. Это делается путем выравнивания пептида C.
- У людей с подозрением на инсулинорезистентность с целью подтверждения / исключения низкой чувствительности к инсулину.
- Для подтверждения реактивной гипогликемии (чрезмерное падение уровня глюкозы в крови у людей без диабета).
Поделиться ссылкой:
Источник
В этой статье вы узнаете:
Очень важно знать, как работает организм в норме, чтобы понять те изменения, которые происходят в нем при развитии диабета. Большинство процессов в теле человека контролируются гормонами. Органом, вырабатывающим инсулин, является поджелудочная железа. Гормон синтезируется в особых клетках, которые называются бетта-клетками.

Такие клетки располагаются в железе в виде отдельных обособленных скоплений. Их называют островками Ларгенганса.
Кроме выработки инсулина поджелудочная железа также синтезирует пищеварительные ферменты. Как правило, эта функция железы не изменяется и хорошо выполняется без отклонений только у пациентов с диабетом 1 типа.
При втором типе на состояние поджелудочной влияет не только диабет, но и множество сопутствующих заболеваний (ожирение, желчекаменная болезнь, хронический гастрит и другие), отчего ее функция может измениться самым различным образом.
Почему поджелудочная перестает вырабатывать инсулин?
Иммунная система помогает человеку бороться с вирусами, микробами, уничтожает чужеродные клетки, в том числе и раковые, которые могут образовываться в процессе жизни человека. Происходит постоянное обновление клеток в разных органах: старые гибнут, а новые образуются, замещая их.
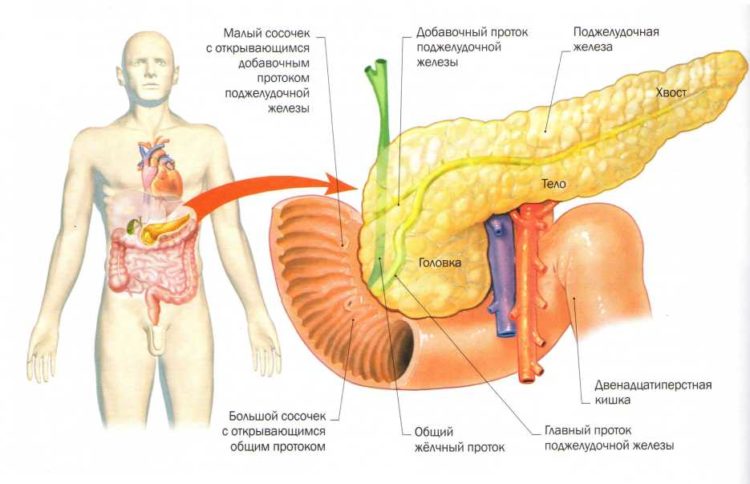 Расположение поджелудочной железы
Расположение поджелудочной железы
Это касается и бетта-клеток поджелудочной железы. Иммунитет в норме хорошо различает «свои» клетки от «чужеродных».
У пациентов с диабетом 1 типа происходит «поломка» в иммунитете, и организм начинает воспринимать собственные клетки как чужие, и убивает их.
Наследственность и действие окружающей среды (чаще всего вирусы) изменяют свойства β-клеток.
Выделяют ряд причин, почему поджелудочная железа не вырабатывает инсулин.
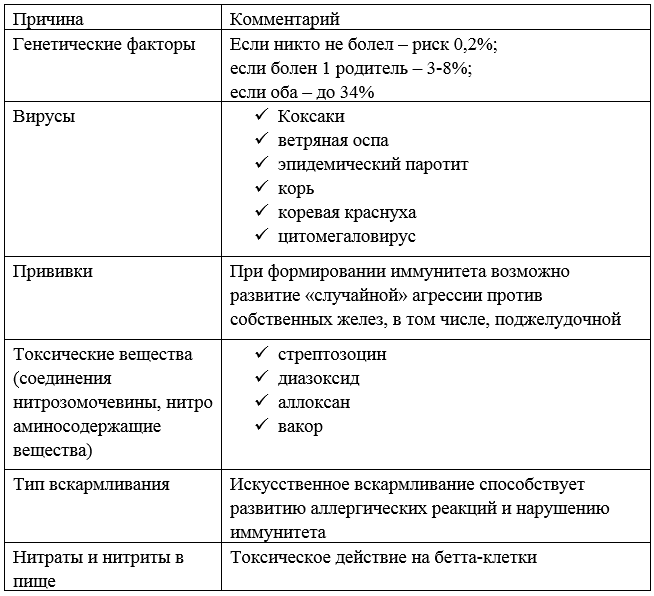 Таблица – Причины, из-за которых может снижаться выработка инсулина
Таблица – Причины, из-за которых может снижаться выработка инсулина
Происходят следующие процессы:
- Выделяются аутоантигены.
- Клетки иммунной системы (макрофаги МФ, дендритные клетки ДК) передают переработанные аутоантигены Т-лимфоцитам, которые, в свою очередь, начинают воспринимать их как чужеродные.
- Часть Т-лимфоцитов, превратившихся в специфические цитотоксические аутоагрессивные лимфоциты (ЦТЛ).
- Развивается воспаление поджелудочной железы и разрушение β-клетки.
Этот процесс длительный и протекает с различной скоростью: от нескольких месяцев у маленьких детей до нескольких лет у взрослых.
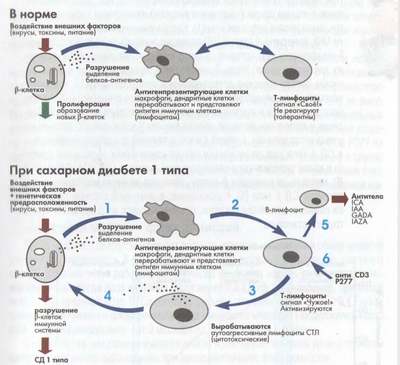 Аутоиммунное разрушение β-клеток
Аутоиммунное разрушение β-клеток
По данным научных исследований, у людей с наследственной предрасположенностью к сахарному диабету 1 типа уже за несколько лет до начала заболевания в крови определяются специфические антитела (IAA, ICA, GADA, IA-2β), которые, не разрушая β-клетку, являются ранними маркерами риска развития СД 1 типа.
К сожалению, в иммунной системе сохраняется память к антигенам β-клеток, поэтому процесс их разрушения очень трудно остановить.
Учёные считают, что при диабете 1 типа бетта-клетки могут восстанавливаться. Даже при гибели 90 % процентов всех бетта-клеток из оставшихся 10 % может произойти восстановление. Однако для этого необходимо остановить «агрессивную» реакцию иммунной системы. Только тогда станет возможным излечение от этой болезни.
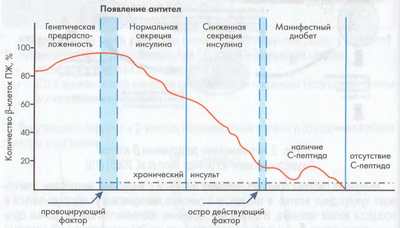 Стадии развития диабета 1 типа
Стадии развития диабета 1 типа
Только введение инсулина может быть настоящим лечением сахарного диабета 1 типа.
Некоторые исследования были направлены на изучение возможности остановить «агрессивное поведение» иммунной системы по отношению к бетта-клеткам путём применения нескольких групп препаратов. Однако достоверных положительных результатов получено не было.
Большую надежду учёные связывают с возможностью применения моноклональных антител, способных изменить агрессивный иммунитет в благоприятную сторону, т. е. снизить аутоиммунную реакцию в поджелудочной железе.
Эти исследования являются очень перспективными, поскольку в случае отсутствия контроля над иммунитетом даже пересадка островков Ларгенганса и применение стволовых клеток будут бессмысленны.
Работа инсулина
Основная функция гормона заключается в том, что он связывается с рецептором на клетке (специальный датчик узнавания). Если узнавание произошло («ключ подошел к замку»), то клетка становится проницаемой для глюкозы.
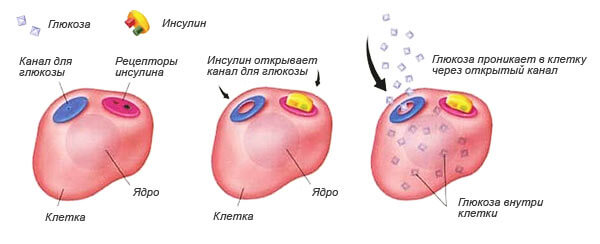 Воздействие инсулина на клетку
Воздействие инсулина на клетку
Выработка инсулина начинается уже тогда, когда мы видим еду и ощущаем ее запах. По мере переваривания пищи, высвобождения из нее глюкозы и попадания ее в кровь, бетта-клетки увеличивают выработку инсулина, поэтому, у здоровых людей уровень сахара крови всегда сохраняется в пределах нормы и не зависит от того, сколько сладкого они съели.
Инсулин отвечает за попадание глюкозы в так называемые «инсулинозависимые ткани»: печень, мышцы, жировая ткань.
Интересный факт: Самые главные органы не нуждаются в инсулине. В «инсулиннезависимые» клетки сахар из крови попадает просто по градиенту концентрации: когда его в клетке меньше, чем в крови, он свободно переходит в клетку. Такими органами являются головной мозг, нервы, сетчатка, почки, надпочечники, кровеносные сосуды и эритроциты.
Такой механизм необходим для того, чтобы в случае недостатка глюкозы крови выработка инсулина останавливалась и сахар поступал бы только в самые важные органы.
Организму необходимо немного инсулина даже в ночное время и в периоды голода, чтобы обеспечить усвоение глюкозы, образующейся в печени. Такой инсулин называют базальным или фоновым.
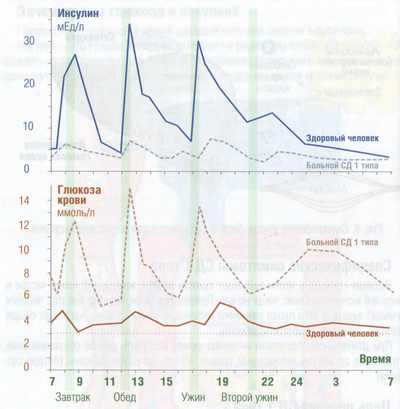 Уровни инсулина и глюкозы в крови
Уровни инсулина и глюкозы в крови
Существует еще болюсный инсулин. Это то количество гормона, которое вырабатывается в ответ на прием пищи.
Помните, необходимо научиться рассчитывать и вводить себе дозу инсулина в зависимости от количества принятой пищи. Поэтому так важно обучение при сахарном диабете 1 типа. Без знаний о своей болезни и правилах поведения адекватное лечение практически невозможно.
Очень важно также оценивать потребность в инсулине. У человека без диабета вырабатывается приблизительно 0,5 ЕД инсулина на кг массы тела каждый день. Для взрослого с массой тела 70 кг получаем 70*0,5=35 ЕД в сутки.
| Период | Доза инсулина |
|---|---|
| Дети до полового созревания | 0,7–1,0 ЕД/кг/день (Обычно ближе к 1 ЕД/кг/день) |
| Период полового созревания | Мальчики – 1,1–1,4 ЕД/кг/день (иногда даже больше) Девочки – 1,0–1,2 ЕД/кг/день |
| Подростки | Девушки – меньше 1 ЕД/кг/день Юноши – примерно 1 ЕД/кг/день |
| Взрослые | 0,7 – 0,8 ЕД/кг/день |
У большинства пациентов через 1–3 года от момента возникновения потребность в инсулине стабилизируется и составляет 0,7–1,0 ЕД/кг.
Чувствительность к инсулину
Чувствительность организма к гормону важна для определения того, насколько конкретная доза инсулина снизит уровень сахара крови. К сожалению, одна и та же доза инсулина не всегда оказывает одинаковый эффект на снижение глюкозы крови.
Определенные факторы повышают чувствительность к инсулину, другие причины – уменьшают.
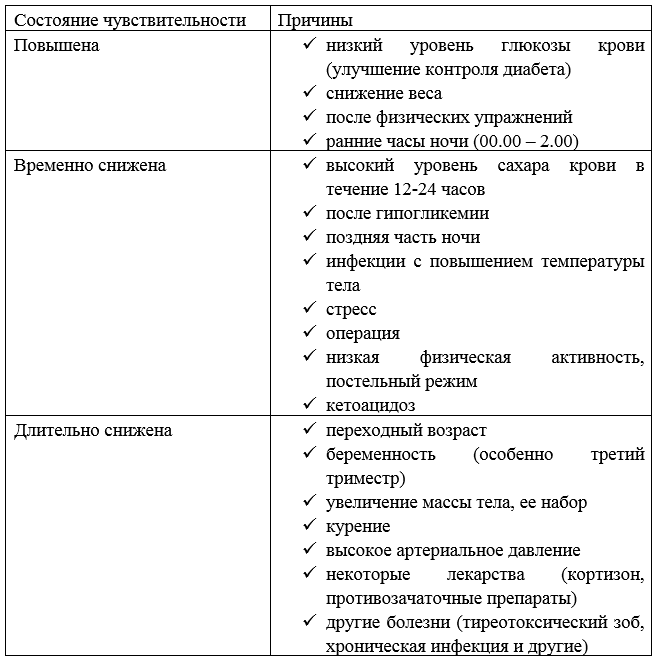 Таблица – Факторы, влияющие на чувствительность к инсулину
Таблица – Факторы, влияющие на чувствительность к инсулину
Инсулинорезистентность означает, что требуется большее количество инсулина, чтобы поучить такой же эффект снижения сахара крови. Другими словами, происходит уменьшение чувствительности к инсулину.
Давно известно, какая железа вырабатывает инсулин. Но что еще, кроме поджелудочной железы, вырабатывает инсулин в организме человека?
В последние годы пристальный интерес вызываю вещества инкретины – это гормоны, секретируемы клетками желудочно-кишечного тракта и стимулирующие действие инсулина.
Наиболее изучены:
- Глюкагоноподобный пептид-1 (ГПП-1);
- Глюкозозависимый инсулиноподобный пептид (ГИП).
Последнее вещество оказывает эффект, сравнимый с действием инсулина.
Основные эффекты инкретинов:
- увеличивают синтез инсулина после еды;
- улучшают потребление глюкозы клетками, что приводит к снижению сахара крови.
Существуют данные, что у пациентов с диабетом данное вещество продолжает синтезироваться в прежних количествах, в то время, как бетта-клетки гибнут. Проблема состоит в том, что инкретины очень быстро распадаются под действием собственных ферментов организма.
Источник
