Инсулинома поджелудочной железы после операции
Резекция поджелудочной железы при инсулиноме. Скрытые инсулиномы.Дистальная резекция поджелудочной железы показана при инсулиномах тела и хвоста больших размеров, инсулиномах, расположенных близко к протоку поджелудочной железы, множественных инсулиномах этой же локализации и при злокачественных инсулиномах. При некоторых инсулиномах хвоста поджелудочной железы по техническим причинам иногда предпочтительнее выполнять резекцию вместо энуклеации, даже если последняя возможна. В исключительных случаях полимикроаденоматоза островков поджелудочной железы или гиперплазии клеток показана резекция тела и хвоста поджелудочной железы. Дистальную резекцию поджелудочной железы необходимо выполнять, насколько это возможно, с использованием техники, позволяющей сохранить селезенку, особенно у молодых людей. Панкреатодуоденальная резекция показана при злокачественных инсулиномах головки и перешейка поджелудочной железы. При доброкачественных инсулиномах головки поджелудочной железы операцию Whipple необходимо выполнять лишь в исключительных случаях.
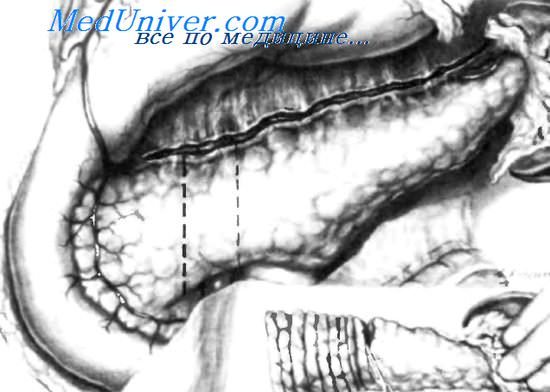
Тотальная панкреатэктомия при лечении инсулиномТотальная панкреатэктомия при гормонсекретирующих инсулиномах бывает показана редко. Для этой операции существует лишь одно серьезное показание: если ранее была произведена дистальная резекция поджелудочной железы, но не были достигнуты желаемые результаты, имеется непереносимость диазоксида или не получены удовлетворительные результаты во время интраоперационного теста с диазоксидом. Тотальная панкреатэктомия переводит этого пациента из состояния гипогликемии (с ее обычными специфическими симптомами) в гипергликемию, переходящую в диабет, который трудно поддается лечению, непредсказуем в своем развитии и очень чувствителен к инсулину, даже в малых дозах и при отклонениях на 2—3 единицы. Несмотря на то, что контроль уровня глюкозы в крови, предложенный McMillan и Shwibe в 1951 г., — достаточно спорная методика, ее используют во многих хирургических центрах с неплохими результатами. Спустя 30 минут после удаления гормонсскретирующей инсулиномы уровень сахара в крови значительно увеличивается. Если такого увеличения не наблюдается, следует предполагать наличие другой инсулиномы. Для мониторинга уровня глюкозы в крови необходимо, чтобы пациент получал во время операции постоянное количество глюкозы, что позволяет сохранять фиксированный уровень гликемии и наблюдать рост уровня гликемии через 30 минут после удаления инсулиномы. Назначение глюкозы во время операции необходимо для предупреждения перехода пациента в состояние гипогликемии, вызванное манипуляциями с инсулиномой или возникшее спонтанно. До удаления инсулиномы кровь забирают каждые 15 минут, а после ее удаления — каждые 5 минут. Для облегчения проведения этих тестов используют автоматические анализаторы. Назначение диазоксида может быть приостановлено за день до операции, таким образом, он не будет воздействовать на секрецию инсулина. Обычно повышение уровня сахара крови до нормального уровня после удаления инсулиномы происходит быстро. У некоторых пациентов удаление инсулиномы все же может привести к значительному и длительному повышению глюкозы крови. Иногда для снижения уровня глюкозы в крови бывает необходимо вводить инсулин, как это наблюдалось у одного нашего пациента, у которого уровень глюкозы крови повысился до 500 мг% и держался семь дней. Скрытыми называют инсулиномы, которые не удается обнаружить во время операции. Около 20—30% инсулином являются скрытыми. Для выявления скрытых инсулином необходимо прибегнуть ко всем описанным выше методам операционной диагностики. Они включают двухпальцевое исследование всей поджелудочной железы и зон вероятного расположения гетеротопической ткани поджелудочной железы, таких как нисходящая часть двенадцатиперстной кишки, антральный отдел желудка, ножка печени и т. д. В дополнение к пальпации, ультрасонографии, эффективность которой доказана, необходимо использовать определение уровня инсулина плазмы в пробах крови, взятых из разных эфферентных вен поджелудочной железы. В некоторых случаях, когда с помощью этой последней методики выявляют увеличение уровня инсулина в каком-либо одном секторе поджелудочной железы, полезно выполнить ультрасонографию этой зоны, пытаясь обнаружить инсулиному и удалить ее методом энуклеации вместо резекции поджелудочной железы. Если выявить инсулиному не удается, можно прибегнуть к прогрессирующей дистальной резекции поджелудочной железы, выполнив серию поперечных срезов поджелудочной железы через каждые 5 мм, с тем чтобы попытаться обнаружить инсулиному путем визуального, пальпаторного или микроскопического исследования. У пациентов, страдающих полимикроаденоматозом островков Langerhans или гиперплазией р-клеток, помочь в диагностике может лишь микроскопическое исследование. Как мы уже показали, в этих случаях мониторинг уровня глюкозы в крови может оказаться очень полезным. Если инсулиному невозможно выявить с помощью двухпальцевой пальпации всей поджелудочной железы, экспресс-метода определения уровня глюкозы в крови из эфферентных вен железы или операционной ультрасоногра-фии, необходимо прибегнуть к прогрессирующей дистальной резекции, применяя последовательное пересечение паренхимы железы через каждые 5 мм, как показано на рисунке, и выполняя визуальное, пальпаторное и микроскопическое исследование полученных срезов. В 30-40% случаев прогрессивная дистальная резекция поджелудочной железы помогает выявить инсулиному. В моей практике использования этой операции отмечен один случай — инсулинома диаметром 3 мм, с высокой гормональной активностью была выявлена с помощью микроскопического исследования. Есть хирурги, не верящие в эту операцию, предпочитающие закрывать брюшную полость и ждать 1-3 года, пока инсулинома увеличится в размерах и можно будет установить ее локализацию при повторной операции. – Вернуться в оглавление раздела “Неотложная хирургия.” Оглавление темы “Опухоли фатерова сосочка. Инсулиномы.”: |
Источник
Консервативная (симптоматическая) терапия
Консервативная терапия при инсулиноме включает купирование и профилактику гипогликемических состояний, воздействие на опухолевый процесс благодаря применению различных гипергликемических средств, а также более частому питанию больного.
Наиболее, простая симптоматическая терапия больных инсулиномами — диета с высоким содержанием углеводов. Имеет значение частое, дробное питание. Для некоторых больных достаточно включение дополнительного приёма пищи перед сном (23 ч), для других — утром, в середине дня или в 15 ч. Предпочтение отдают медленно всасывающимся углеводам (крахмалу, хлебу, картофелю). Во время эпизодов гипогликемии применяют более быстро всасывающиеся углеводы (фруктовые соки с добавлением глюкозы или сахарозы).
Для купирования лёгкого гипогликемического состояния (без потери сознания) больному достаточно съесть примерно 100 г хлеба или выпить раствор сахара (1 ст. ложка на 1/2 стакана воды). Можно употреблять и другие продукты с легкоусвояемыми углеводами: варенье, мёд, конфеты, При тяжёлой гипогликемии с потерей сознания немедленно вводят внутривенно струйно 40—100 мл 40% раствора глюкозы (в зависимости от тяжести состояния). В большинстве случаев проявления гипогликемии быстро исчезают.
При отсутствии эффекта внутривенное введение 50 мл 40% раствора глюкозы повторяют. Если сознание не восстанавливается, переходят на внутривенное капельное введение 5% раствора глюкозы. Подкожно, внутримышечно или внутривенно вводят 1 мл глюкагона, после чего сознание возвращается обычно через 5—20 минут. Для борьбы с тяжёлой гипогликемией используют также гидрокортизон по 150—300 мг внутривенно иди внутримышечно. При отсутствии сознания у больного после устранения гипогликемии продолжают внутривенное капельное введение 5% раствора глюкозы. Таким больным вводят внутримышечно 1—2 мл глюкагона каждые 2 ч, внутривенно капельно 75 мг гидрокортизона или 30 мг преднизолона 4 раза в сутки.
Для профилактики отёка головного мозга при затянувшейся коме внутривенно капельно вводят 15% или 20% раствор маннитола из расчёта 0,5—1 г/кг. Для улучшения метаболизма глюкозы внутримышечно вводят 100 мг кокарбоксилазы и 5 мл 5% раствора аскорбиновой кислоты. Применяют сердечные и сосудистые средства.
К традиционным гипергликемическим средствам относят эпинефрин (адреналин) и норэпинефрин (норадреналин). Однако они, как и глюкагон, дают кратковременный эффект, и парентеральный способ применения большинства из них ограничивает их использование. Гипергликемический эффект глюкокортикоидов проявляется только при применении больших доз препаратов, которые вызывают кушингоидные проявления.
Некоторые авторы отмечают положительное влияние фенитоина (дифенина) в дозе 400 мг/сут, а также диазоксида (гиперстата). Гипергликемический эффект этого недиуретического бензотиазида основан на торможении секреции инсулина опухолевыми клетками. Препарат назначают в дозе 100-600 мг/сут за 3-4 приёма. Препарат благодаря выраженному гипергликемическому действию способен годами поддерживать нормальный уровень глюкозы в крови. Он обладает свойством задерживать воду в организме путём снижения экскреции натрия, что ведёт к развитию отёчного синдрома. Именно поэтому приём диазоксида необходимо сочетать с мочегонными средствами.
Блокаторы медленных кальциевых канатов и в-адреноблокаторы теоретически могут тормозить секрецию инсулина. С целью снижения содержания инсулина и облегчения гипогликемических приступов успешно применяли верапамил и дилтиазем, пропраналол. При доброкачественной инсулиноме может быть достаточно 80 мг пропранолола в день, чтобы минимизировать частоту и тяжесть гипогликемических кризов.
Пролонгированные синтетические аналоги соматостатина (октреотид) эффективно подавляют высвобождение инсулина примерно у половины больных инсулииомой, при этом уровень глюкозы в крови увеличивается значительно, а содержание С-пептида снижается на 50-70%. Октреотид не вызывает нарушения самочувствия больных, его вводят под кожу в дозе 50-100 мкг 2-3 раза в день. У 50% больных со злокачественными инсулиномами отмечают хороший симптоматический эффект октреотида, значительно улучшающий качество жизни больных.
Хирургическое лечение
При установлении диагноза инсулиномы показано максимально более раннее хирургическое лечение для уменьшения гипогликемии и общих нарушений, предотвращения возможного поражения ЦНС, ожирения, которые затрудняют хирургическое вмешательство. Сравнение данных электроэнцефатографических исследований, проведённых до и после операции, показало, что у части больных с большей длительностью заболевания и часто повторяющимися приступами гипогликемии оставались необратимые органические изменения в головном мозге. При ранней диагностике и своевременном хирургическом лечении изменения со стороны ЦНС исчезают, о чем свидетельствуют данные электроэнцефалографических исследований.
При определении показаний к хирургическому лечению исключительное значение имеет определение расположения опухоли. Примерно 30% инсулином менее 1 см в диаметре, 10% — множественные, от 10 до 15% — злокачественные, а 10% больных имеют клеточную островковую гиперплазию или незидиобластоз и вообще не имеют опухоли. В том случае если клиническая и лабораторная диагностика предполагают инсулиному, а при визуализации обнаруживают одиночное образование ПЖ, больным показана операция.
Однако небольшой размер опухоли и её мягкотканный характер нередко затрудняют поиск опухоли во время операции. В 10—20% случаев интраоперационная пальпация не приносит желаемого результата, поэтому в последние годы всё чаще используют интраоперационное УЗИ и ЭУС, что позволяет выполнить простую энуклеацию опухоли. Дополнительно эти методы позволяют определить положение опухоли относительно протока ПЖ и других важных структур. Многие авторы рекомендуют применение интраоперационного УЗИ при всех вмешательствах по поводу инсулиномы.
Знание точного места расположения опухоли определяет возможность направленной хирургической энуклеации или резекции с сохранением максимально возможного объёма неизменённой паренхимы ПЖ и селезёнки, а также ДПК. В настоящее время энуклеация опухоли — оптимальный метод хирургического лечения. Если выявить опухоль на операционном столе не удастся, вмешательство прекращают в «надежде», что скрытая опухоль со временем вырастет, и это позволит выявить её при повторном вмешательстве. В противном случае выполняют так называемую «слепую резекцию» ПЖ (хвоста и тела).
Больным с отдалёнными метастазами также выполняют первичные циторедуктивные вмешательства в объёме энуклеации опухоли ПЖ, гемигепатэктомии или атипичной резекции печени с целью уменьшения массы опухолевой ткани и надеждой на эффективность последующей химиотерапии.
Концентрации глюкозы и инсулина в крови после радикальной операции, как правило, нормализуются. Показатели проб с голоданием, лейцином, толбутамидом и глюкозой в отдалённые сроки после удаления инсулиномы в случае клинического выздоровления носят такой же характер, как у здоровых людей.
В случае возникновения рецидива заболевания в послеоперационном периоде изменение уровня глюкозы и инсулина крови при проведении проб с голоданием, лейцином, толбутамидом будет примерно таким же, как и до операции.
Химиотерапия
У больных со злокачественными метастазирующими опухолями ПЖ успешно применяют химиотерапевтический препарат стрептозоцин — антибиотик широкого спектра действия, вызывающий избирательную деструкцию островковых клеток ПЖ. Действие стрептозоцина связано с торможением синтеза ДНК, к которому особенно чувствительны р-клетки ПЖ. Он поддерживает уровень глюкозы плазмы крови, вызывая также уменьшение размеров опухоли примерно на 50% у больных с функционирующей злокачественной инсулииомой. Менее чем у 50% больных наступает, по мнению некоторых авторов, полная ремиссия, Благоприятная биохимическая динамика возникает примерно у 1/4 больных.
К препарату в той или иной степени чувствительны 60% больных. Лечение стрептозоцином значительно продлевает жизнь больных инсулиномами. Тем не менее избирательность препарата к панкреатическим в-клеткам относительна — он оказывает токсическое действие на почки, печень и гемопоэтическую систему, поэтому необходим мониторинг печёночных проб и содержания белка в моче. Препарат вводят внутривенно капельно в суточной дозе до 2 г (курсовая доза — до 30 г), ежедневно или еженедельно. Побочные эффекты стрептозоцина: гемато-, нефро- и гепатотоксичностъ, тошнота, рвота и диарея.
Комбинация стрептозоцина с фторурацилом обладает преимуществом по сравнению с одним стрептозоцином в отношении благоприятных изменений (60% против 33%), полного улучшения (33% против 12%) и продолжительности жизни у больных с тяжёлыми поражениями злокачественной инсулииомой. Назначают стрептозоцин ежедневно в дозе 0,5 г на 1 м2 поверхности тела в течение 5 дней в сочетании с фторурацилом в дозе 0,4 г на 1 м2 поверхности тела в день в течение пяти последующих дней. Курсы лечения повторяют каждые 6 нед при улучшении или стабильном состоянии опухоли.
При отсутствии чувствительности опухоли к стрептозоцину можно использовать доксорубицин.
Прогноз
В случае своевременного радикального хирургического лечения прогноз при инсулиноме благоприятный. Частота операционной смертности составляет 7—16%, эффективность операции достигает 65—96%.
Рецидивы в зависимости от длительности наблюдения и метода хирургического лечения составляют около 10%. Таким образом, у большинства больных (80—90%) с резектабельными опухолями ПЖ после операции наступает стойкое выздоровление. Катамнестический анализ свидетельствует о высокой эффективности хирургического метода лечения инсулином и относительной редкости рецидивов. При симптоматических гипогликемиях прогноз зависит от основного заболевания и эффективности консервативной терапии.
Маев И.В., Кучерявый Ю.А.
Опубликовал Константин Моканов
Источник
Опухоли, исходящие из 6-клеток поджелудочной железы – инсулиномы, подлежат хирургическому удалению.
Единственным методом лечения этого заболевания является хирургическое лечение.
В случаях развития гипогликемического состояния необходимо вводить глюкозу внутривенно (40%-ный раствор глюкозы) и обеспечить поступление пищи, содержащей легкоусвояемые углеводы. Полноценное, богатое углеводами питание, принимаемое несколько раз в день, может предохранить больного от развития приступа гипогликемии.
Хирургическое лечение. Первая успешная операция удаления инсулиномы была выполнена А. Д. Очкиным в 1949 году.
Показанием к операции служит правильно поставленный диагноз, так как в настоящее время только хирургическое лечение является радикальным. Консервативные мероприятия могут быть допустимы лишь у неоперабильных больных.
Предоперационная подготовка. В предоперационном периоде большое значение имеет питание больных. Больным до операции назначается физиологическая диета, с достаточным содержанием белков, жиров, углеводов и витаминов. Для предупреждения гипогликемических состояний прием пищи назначается каждые 3-4 часа, даже в ночное время. Количество углеводов, принятых в течение суток, увеличивается. При развившемся приступе гипогликемии, если у больного сохранено сознание, и он может принимать пищу, назначается сладкий чай или раствор глюкозы с последующим приемом пищи (манная каша, картофельное пюре). При бессознательном состоянии вводится внутривенно 40%-ный раствор глюкозы в количестве 20-40 мл или больше, пока не купируется состояние гипогликемии.
Применение каких-либо гормональных препаратов нецелесообразно. Накануне операции вечером и в день операции утром назначается очистительная клизма. Накануне операции диета обычная. Ночью (если это необходимо) и утром в 6 часов больной принимает стакан сладкого чая, а перед началом операции внутривенно вводится глюкоза 40 мл 40%-ного раствора. Как в период подготовки к операции, так и во время операции осуществляется постоянный контроль за содержанием сахара в крови.
Обезболивание. Лучшим методом обезболивания является эндотрахеальный наркоз с применением миорелаксантов, обеспечивающий максимальные удобства для хирурга и безопасность для больного.
Премедикация может быть проведена атропином, промедолом, пипольфеном (дипразин) в дозировках, соответствующих возрасту.
Операцию по поводу гипогликемической болезни необходимо назначать в утренние часы, чтобы избежать развития гипогликемического приступа непосредственно перед операцией или в начале ее. Для вводного наркоза применяется 2%-ный раствор тиопентала или гексенала внутривенно, а затем вводится релаксант короткого действия (листенон, миорелаксин) из расчета на 1 кг веса больного -2 мг. После указанной подготовки приступают к интубации. Основной наркоз – закись азота, с добавлением фторатана, азеатропной смеси, промедола. В зависимости от стадии операции применяются миорелаксанты.
Во время операции от анестезиолога требуется непрерывное внимание из-за возможных колебаний уровня сахара в крови. Гипогликемия в начале операции может перейти в гипергликемию в конце ее. Введение больших доз глюкозы во время операции нецелесообразно. Как показали исследования Э. Г. Вейнберга, это может привести к очень высокой гипергликемии в конце операции и после нее. Показания к переливанию крови диктуются кровопотерей во время операции.
Тактика хирурга. Особенностью операций по поводу гипогликемической болезни является невозможность заранее предвидеть объем этой операции. Хирург должен быть готовым выполнить все от простой энуклеации до тотальной панкреатэктомии. О. В. Николаев отдает предпочтение энуклеации опухоли, особенно при расположении ее в головке поджелудочной железы.
При необнаружении инсуломы тактика хирурга затруднена. Показания к «слепой резекции» железы должны быть очень строгими, так как часто такое вмешательство не дает эффекта, а процент осложнений велик.
Хирургическое вмешательство при наличии отдаленных метастазов нецелесообразно.
Необходимо иметь в виду редко встречающиеся дистопированные расположения аденомы поджелудочной железы. Наиболее частая их локализация – стенка желудка, кишки, сальник, ворот селезенки.
Наилучший доступ для ревизии поджелудочной железы дает верхняя поперечная лапаротомия на середине расстояния между мечевидным отростком грудины и пупком; можно использовать и верхнесерединный разрез. Другие разрезы более травматичны, а преимуществ не дают.
В 1952 году О. В. Николаев произвел первую операцию удаления инсуломы из хвоста поджелудочной железы через поясничный разрез, экстраперитонеально. Люмботомию можно произвести через 2-3 недели после лапаротомии, при которой инсулома была обнаружена в хвосте поджелудочной железы. Преимущество экстраперитонеального доступа – это уменьшение осложнений в брюшной полости в послеоперационном периоде, особенно если нет возможности применить препараты – ингибиторы ферментов поджелудочной железы.
Для ревизии поджелудочной железы вскрывается желудочно-ободочная связка. Разделение сращений, часто имеющихся между стенкой желудка и передней поверхностью поджелудочной железы, обычно затруднений не вызывает.
Тщательную ревизию поджелудочной железы принято начинать с хвоста ее, последовательно направляясь к головке. Ощупыванием передней поверхности можно обнаружить только крупные аденомы, расположенные неглубоко, а поэтому для более тщательной ревизии необходимо произвести мобилизацию задней поверхности железы, чтобы можно было захватить ее ткань пальцами с обеих сторон. Для обеспечения этого удобно применить гидравлическую препаровку тканей 0,25%-ным раствором новокаина.
Детальное обследование головки поджелудочной железы становится возможным только после мобилизации ее по Кохеру.
Возможность захвата тканей облегчает удаление инсуломы, фиксируя ее на руке хирурга. Следуя описанной методике, удается обнаружить инсулому менее 1 см в диаметре. Нужно учесть также, что плотность аденом может быть различной.
Удаление обнаруженной аденомы производится путем энуклеации по возможности тупым путем, ложе ушивается кетгутовыми или капроновыми, восьмиобразными швами, через ткань железы, что обеспечивает и гемостаз. Перитонизация проводится за счет капсулы железы или прилежащей брюшной брыжейки. При хорошем гемостазе марлевые тампоны излишни. К месту удаленной аденомы подводится резиновый дренаж, который фиксируется тонким кетгутом к капсуле железы.
Применение дренажа необходимо ввиду возможности повреждения выводных протоков второго и третьего порядка. Дренаж выводится через отдельный разрез брюшной стенки обычно ниже на несколько сантиметров от операционной раны и фиксируется к коже при помощи манжетки, направление дренажа должно быть по возможности прямым.
Для лучшего отграничения сальниковой сумки от брюшной полости отверстие в последней подшивается к париетальной брюшине передней стенки живота 2-3 кетгутовыми швами. На брюшину накладывают обычный кетгутовый шов, апоневроз вместе с мышцами лучше ушивать шелком или чередуя шелковые швы с кетгутовыми из-за опасности эвентрации. Ушивание брюшной стенки наглухо возможно лишь при поверхностном расположении инсуломы.
Дренажная трубка удлиняется и опускается в сосуд с антисептиком для контроля за количеством и качеством отделяемого.
Читать далее Осложнения после операционного удаления инсулиномы
Женский журнал www.BlackPantera.ru:
Римма Алексеева
Источник
