Гормоны поджелудочной железы гипофункция и гиперфункция

Гипофункция и гиперфункция поджелудочной железы относятся к весьма серьёзным заболеваниям, которые, при отсутствии соответствующего лечения, могут привести даже к летальному исходу. Возникновение подобного заболевания связано с дисфункцией нервной системы и гипогликемией (снижение до минимального уровня глюкозы в организме). Для борьбы с данной болезнью необходимо вводить внутривенно глюкозу, которая способна нормализовать состояние пациента и блокировать симптоматику заболевания.

Гипофункция может привести к развитию сахарного диабета. В таком случае больному необходимо вводить инсулин для поддержания нормальной работы органа. Своевременное лечение гипо- и гиперфункции поджелудочной железы поможет справиться с болезнью и повысит шансы на более быстрое выздоровление.
Причины гипофункции
Эндокринная часть поджелудочной железы способна образовывать особую клеточную группу, которую принято называть островками Лангерганса. Скопление эндокринных клеток, продуцирующих гормоны, локализуются в хвосте железы. Благодаря этой группе клеток, поджелудочная железа может вырабатывать три вида гормона:
- глюкагон – повышает уровень глюкозы в крови;
- инсулин – регулирует уровень глюкозы;
- липокаин – регулирует жировой обмен в печени.
Поражение островков Лангерганса может привести к гипофункции поджелудочной железы. Природа этого поражения способна варьироваться.
Симптомы гипофункции
Стоит не забывать о том, что симптомы данного заболевания носят исключительно индивидуальный характер и могут варьироваться в зависимости от состояния пациента. Пониженная функция поджелудочной железы проявляется следующими основными симптомами:
- постоянное ощущение жажды, обезвоживание;
- чувство сухости и дискомфорта во рту;
- часто мочеиспускание (полиурия);
- быстрая и резкая потеря веса;
- чувство тошноты, рвота;
- болезненные ощущения, локализованные в животе;
- быстрая утомляемость и слабость;
- помрачение сознания.
Подобная симптоматика может привести к диабетической коме. Если вы заметили наличие вышеперечисленных симптомов и ухудшение общего состояния, то немедленно обратитесь за помощью к специалисту.
Стоит обратить внимание на то, что высокий уровень глюкозы в крови может привести к разрушению некоторых тканей и сосудов. Иногда эти процессы могут привести к гангрене, слепоте, нарушениям сердечно-сосудистой системы и инсультам. Для того чтобы предотвратить подобные проявления болезни, необходимо отслеживать самочувствие и чаще ходить на врачебные осмотры.
Лечение гипофункции
Анализ мочи, показывающий уровень глюкозы в крови, поможет отследить работу поджелудочной железы. После сдачи анализа необходимо незамедлительно начать лечение. Врач назначает ввод искусственного инсулина внутривенно для поддержания нормального уровня глюкозы в крови.
Причины гиперфункции поджелудочной железы
Выявление основной причины возникновения гиперфункции железы очень важно для последующего лечения. Гиперфункция может возникнуть из-за снижения уровня глюкозы в крови. В ответ на это явление организм начинает резко увеличивать выработку инсулина, который в итоге он не способен нейтрализовать.
Гиперфункция поджелудочной железы распределяется по гендерному аспекту, потому что это заболевании намного чаще наблюдается у женщин, нежели у мужчин. Причиной такого явления становится дифференциация эндокринной системы, а также особые отличительные характеристики организма женщины (заболевание способно прогрессировать с меньшим интервалом времени, но в больших масштабах).
Известно, что гипогликемия является следствием гиперфункции поджелудочной железы.
Для того, чтобы отследить первые симптомы болезни, необходимо особенно внимательно отнестись к:
- рациону питания;
- общему состоянию организма;
- уровню глюкозы в крови.
Как проявляет себя гиперфункции поджелудочной железы?
Симптомы гиперфункции
Симптомы данного заболевания не носят ярко выраженный характер. Именно из-за этого пациентам сложно заметить какие-либо изменения в повседневном ритме жизни, и уж тем более обратиться к врачу. Первоначальные признаки повышения уровня глюкозы больше походят на обычную усталость и нервные переживания. При гиперфункции поджелудочной железы развиваются:
- общая усталость и слабость организма;
- ничем не обоснованная быстрая утомляемость;
- сонливость, упадок сил;
- состояние апатии;
- судороги ног и рук;
- обмороки.
Чем раньше вы правильно отреагируете на симптомы гиперфункции поджелудочной железы, тем быстрее, действеннее и эффективнее пройдёт лечение. Отсутствие своевременного лечения гиперфункции поджелудочной железы приводит к непоправимым последствиям, вплоть до остановки жизнедеятельности организма.
Симптоматика данного заболевания со временем становится более выраженной, пациент начинает испытывать огромный дискомфорт, вследствие чего нарушается привычный для него режим жизни.
Совет: цените и берегите своё здоровье, обязательно посещайте специалистов для плановых осмотров, включающих перечень дополнительных анализов. Это поможет значительно повысить вероятность скорейшего выздоровления.
Заболевания при гиперфункции поджелудочной железы могут быть очень серьезными.
Диагностирование заболевания
Диагностика заболевания заключена в нескольких этапах, что позволяет врачу на каждом из них получить обширные сведения о состоянии конкретного органа и организма в целом. Диагностирование болезни заключается в:
- определении уровня глюкозы;
- определении уровня инсулина;
- определении уровня проинсулина;
- функциональной пробе, которая берется после суточного голодания;
- проведении компьютерной томографии конкретных участков организма пациента.
Как вылечить гиперфункцию поджелудочной железы?

Лечение
Острые приступы болезни, как правило, нейтрализуются, благодаря введению глюкозы внутривенно. Пациент имеет право отказаться от данного способа и начать принимать во время резкого ухудшения состояния любые источники глюкозы. Гиперфункция поджелудочной железы может сопровождаться появлением опухолей в данном органе. В такой ситуации лечение болезни заключается в оперативном вмешательстве и удалении новообразования.
Иногда, благодаря индивидуальным особенностям пациента, подобное оперативное вмешательство строго противопоказано. Тогда пациенту необходимо соблюдать особую диету, принимать специальные лекарственные препараты и четко следовать врачебным предписаниям.
Но не забывайте о том, что подобный консервативный метод лечения считается менее результативным, в отличие от своевременного удаления опухоли.
В заключение
Всё еще считаете, что вылечить данное заболевание очень сложно? Если вашу голову посещают подобные мысли, то победа в борьбе с болезнями поджелудочной железы явно пока что не на вашей стороне. Или вы уже подумываете об оперативном вмешательстве? Это неудивительно, ведь поджелудочная железа является очень важным органом, правильное функционирование которого считается залогом хорошего самочувствия и здоровья в целом. Берегите себя и будьте здоровы!
Внимание, данная статья носит только информативный характер. Не стоит заниматься самолечением, потому подобный подход очень опасен, в особенности, если речь идёт о заболеваниях поджелудочной железы.
Источник
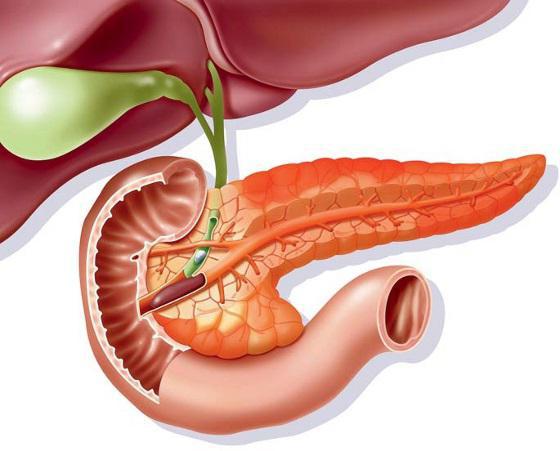
Местоположение, размер и структура поджелудочной железы.
Поджелудочная железа является органом и внешней и внутренней секреции. Эндокринная часть железы представлена отдельными клеточными группами, образующими небольшие островки в массе всей остальной ее ткани.
Эти группы клеток называют островками Лангерганса. Число островков наибольшее в хвостовой части железы. Размер одного островка составляет 0,1-0,3 мм, число их от 200 тыс до 1,8 млн. Некоторые островки отделены от окружающих их тканей тонкой соединительнотканной оболочкой. В островках Лангерганса различают четыре группы клеток: альфа, бета, игрек и гамма. Они неодинаково окрашиваются и выполняют разные функции. Больше всего встречается бета-клеток (70%), примерно 20% от числа всех клеток приходится на альфа-клетки и примерно по 5% составляют игрек и гамма-клетки.
Гормоны поджелудочной железы.
В островках Лангерганса образуются три гормона: инсулин, глюкагон и липокаин.
Значение инсулина было выявлено еще в 1889 году, когда исследователи Меринг и Минковский, удалив у собаки поджелудочную железу, обнаружили в ее моче сахар. Отсюда ими был сделан вывод, что поджелудочная железа регулирует количество сахара в организме. Русский ученый Л.В.Соболев в 1902 году показал, что поджелудочная железа наряду с экзокринной выполняет и эндокринную функцию. Он перевязал выводной проток поджелудочной железы, после чего отмечал гибель клеток, в которых образуется секрет, выделяющийся в двенадцатиперстную кишку, в то время как островковая ткань не подвергалась изменению и нарушения обмена углеводов не отмечалось. В 1921 году ученые Бантиг и Бест выделили из островков гормон, названный ими инсулином (insula – островок).
В настоящее время полностью изучена структура инсулина и он искусственно синтезирован. Молекула инсулина состоит из двух цепей: А и В. Цепь А включает 21 аминокислотный остаток, а цепь В – 13-30. Установлено, что инсулин образуется в бета-клетках. Для его связывания с белком гранул и последующего освобождения необходим цинк. Инсулин стимулирует синтез гликогена в печени, мышцах, тормозит его превращение в сахар и способствует окислению сахара в мышцах. Поэтому после выключения функции островков Лангерганса (есть лекарственные препараты, которые избирательно их повреждают), в крови резко увеличивается содержание сахара, что называется гипергликемией, и он начинает появляться в моче. Наличие сахара в моче называют глюкозурией. При введении инсулина резко уменьшается количество сахара в крови с 80-120 до 30-45 мг%. Уменьшение количества сахара в крови называют гипогликемией.
Глюкагон образуется в альфа-клетках, состоит из 29 аминокислотных остатков и действует противоположно инсулину. Он вызывает гипергликемию и уменьшает содержание гликогена в печени.
Липокаин способствует выходу жиров из печени, окислению их в ней и тормозит превращение углеводов в жиры. Секреция гормонов островками Лангерганса регулируется содержанием сахара в крови. Альфа- и бета-клетки воспринимают изменения концентрации сахара в крови, и по принципу отрицательной обратной связи меняется активность этих клеток. Гипергликемия активирует бета-клетки и тормозит альфа-клетки, а гипогликемия активирует альфа-клетки и тормозит бета-клетки.
Механизм действия гормонов поджелудочной железы.
Считают, что имеется несколько путей воздействия гормонов поджелудочной железы на углеводный обмен. Инсулин способствует проникновению глюкозы через мембрану клетки и ее внутриклеточному накоплению. Кроме того, инсулин индуцирует синтез ферментов, способствующих синтезу гликогена и окислению глюкозы. Глюкагон увеличивает содержание фермента, вызывающего расщепление гликогена.
Гипер- и гипофункция поджелудочной железы.
Гиперфункция поджелудочной железы – очень редкое заболевание. Оно проявляется в гипогликемии и в связанном с этим нарушении деятельности центральной нервной системы, которая чрезвычайно чувствительна к недостатку глюкозы. Возникают слабость, судороги, потеря сознания. Введение глюкозы снимает все эти явления.
При гипофункции поджелудочной железы возникает сахарный диабет. Она характеризуется целым рядом симптомов, возникновение которых связано с увеличением содержания сахара в крови. Количество его может повышаться до 200-500 мг%. При этом в кровь переходит жидкость из тканей, что приводит к их обезвоживанию. Больной постоянно испытывает жажду. Он выпивает около 10 л воды, большая часть которой поступает в кровь и выделяется почками. За сутки у таких больных выделяется от 3 до 12, а в редких случаях до 25 л. Ослабление процессов окисления глюкозы приводит к нарушению обмена жиров. Образуются продукты неполного окисления жиров – кетоновые тела, что приводит к сдвигу реакции крови в кислую сторону – к ацидозу.
Инсулин – эффективное средство лечения диабет. Он дает возможность в течение десятилетий сохранять трудоспособность больных.
Источник
Поджелудочная
железа
состоит из эндокринной и экзокринной
частей. Эндокринная часть составляет
3 % от всей массы железы и представлена
островками Лангерганса. Островки состоят
из α-клеток, которые расположены на
периферии островков и синтезируют
глюкагон и β-клеток (75 %), синтезирующих
инсулин. Кроме них в островках имеются
дельта-клетки, выделяющие соматостатин.
В поджелудочной железе вырабатываются
также гормоноподобные вещества –
липокаин, ваготонин, центропнеин.
Инсулин
состоит
из двух пептидных цепей, в крови находится
в свободной или связанной с белками
форме.
Он стимулирует переход глюкозы из крови
в ткани, повышает проницаемость клеточных
мембран для глюкозы, стимулирует синтез
гликогена в печени и тормозит превращение
гликогена в глюкозу, подавляет образование
углеводов из белков и жиров. Кроме
участия в углеводном обмене он участвует
в жировом, стимулируя образование жира
в жировой ткани и откладывание его в
жировых депо. Участие в белковом обмене
заключается в стимулировании транспорта
аминокислот через клеточные мембраны,
а также в торможении распада белка в
тканях. Основным стимулом для выработки
инсулина является повышение концентрации
глюкозы в крови. Его образование
увеличивается во время пищеварения.
Секрецию инсулина активируют такие
гормоны как: соматотропный,
адренокортикотропный, тиреотропный,
глюкокортикоиды, тироксин и глюкагон,
а также ионы кальция. Адреналин и
норадреналин тормозят секрецию инсулина.
Синтез и секреция инсулина регулируется
также нервной системой. Блуждающие
нервы стимулируют секреторный процесс,
а симпатические – тормозят.
Глюкагон
увеличивает уровень сахара в крови за
счет распада гликогена в печени, повышает
потребление кислорода тканями, усиливает
расщепление жира в жировой ткани.
Регуляция выделения глюкагона
осуществляется главным образом
гуморальным путем, т.е. влияет уровень
глюкозы в крови.
Соматостатин
– влияет на рост и развитие организма,
а также тормозит секрецию глюкагона и
инсулина поджелудочной железой
(следовательно, на обмен веществ).
Центропнеин
– возбуждает дыхательный центр,
регулирует кислородную емкость крови.
Ваготонин
– регулирует тонус парасимпатической
нервной системы, влияет на кислотно-щелочное
равновесие, тормозит действие адреналина,
участвует в регуляции гемопоэза.
Липокаин
– усиливает обмен фосфатидов и окисление
жирных кислот в печени, т.е. участвует
в жировом обмене.
При
недостаточной выработке инсулина
поджелудочной железой в крови повышается
уровень сахара, что приводит к развитию
сахарного диабета. Основные признаки:
жажда, полиурия, булемия (усиленное
потребление пищи).
Надпочечники, их гормоны. Проявление гипо- и гиперфункции.
Надпочечники
– парные образования, расположенные
над почками. Они окружены плотной
соединительной капсулой и состоят из
двух слоев: коркового и мозгового.
Корковый слой состоит из трех зон:
клубочковой, пучковой и сетчатой. Гормоны
коркового слоя
делят на три группы:
1.
Минералокортикоиды.
К этой группе относятся альдостерон,
дезоксикортикостерон, 18-оксикортикостерон,
18-оксидезокси-кортикостерон.
Эти гормоны участвуют в регуляции
минерального обмена. Основным
представителем минералокортикоидов
является альдостерон. Альдостерон
усиливает реабсорбцию ионов натрия и
хлора в дистальных почечных канальцах
и уменьшает обратное всасывание ионов
калия. В результате этого уменьшается
выделение натрия с мочой и увеличивается
выведение калия. В процессе реабсорбции
натрия пассивно возрастает и реабсорбция
воды. За счет задержки воды в организме
увеличивается объем циркулирующей
крови, повышается уровень артериального
давления, уменьшается диурез. Аналогичное
влияние на обмен натрия и калия альдостерон
оказывает в слюнных и потовых железах.
Альдостерон
способствует развитию воспалительной
реакции. Его противовоспалительное
действие связано с усилением экссудации
жидкости из просвета сосудов в ткани и
отечности тканей. При повышенной
продукции альдостерона усиливается
также секреция водородных ионов и
аммония в почечных канальцах, что может
привести к изменению кислотно-основного
состояния – алкалозу.
В
регуляции уровня альдостерона в крови
имеют место несколько механизмов,
основной из них – это
ренин-ангиотензин-альдостероновая
система. В небольшой степени продукцию
альдостерона стимулирует АКТГ
аденогипофиза. Гипонатриемия или
гиперкалиемия по механизму обратной
связи стимулирует выработку альдостерона.
Антагонистом альдостерона является
натрийуретический гормон предсердий.
2.
Глюкокортикоиды.
К глюкокортикоидным гормонам относятся
кортизол,
кортизон, кортикостерон, 11-дезоксикортизол,
11-дегидрокортикостерон.
У человека наиболее важным глюкокортикоидом
является кортизол. Эти гормоны оказывают
влияние на обмен углеводов, белков и
жиров:
Глюкокортикоиды
вызывают повышение содержания глюкозы
в плазме крови (гипергликемия). Этот
эффект обусловлен стимулированием
процессов глюконеогенеза в печени,
т.е. образования глюкозы из аминокислот
и жирных кислот. Глюкокортикоиды
угнетают активность фермента гексокиназы,
что ведет к уменьшению утилизации
глюкозы тканями. Глюкокортикоиды
являются антагонистами инсулина в
регуляции углеводного обмена.Глюкокортикоиды
оказывают катаболическое влияние на
белковый обмен. Вместе с тем они обладают
и выраженным антианаболическим
действием, что проявляется снижением
синтеза особенно мышечных белков, так
как глюкокортикоиды угнетают транспорт
аминокислот из плазмы крови в мышечные
клетки. В результате снижается мышечная
масса, может развиться остеопороз,
уменьшается скорость заживления ран.Действие
глюкокортикоидов на жировой обмен
заключается в активации липолиза, что
приводит к увеличению концентрации
жирных кислот в плазме крови.Глюкокортикоиды
угнетают все компоненты воспалительной
реакции: уменьшают проницаемость
капилляров, тормозят экссудацию и
снижают отечность тканей, стабилизируют
мембраны лизосом, что предотвращает
выброс протеолитических ферментов,
способствующих развитию воспалительной
реакции, угнетают фагоцитоз в очаге
воспаления. Глюкокортикоиды уменьшают
лихорадку. Это действие связано с
уменьшением выброса интерлейкина-1 из
лейкоцитов, который стимулирует центр
теплопродукции в гипоталамусе.Глюкокортикоиды
оказывают противоаллергическое
действие. Это действие обусловлено
эффектами, лежащими в основе
противовоспалительного действия:
угнетение образования факторов,
усиливающих аллергическую реакцию,
снижение экссудации, стабилизация
лизосом. Повышение содержания
глюкокортикоидов в крови приводит к
уменьшению числа эозинофилов, концентрация
которых обычно увеличена при аллергических
реакциях.Глюкокортикоиды
угнетают как клеточный, так и гуморальный
иммунитет. Они снижают продукцию Т- и
В-лимфоцитов, уменьшают образование
антител, снижают иммунологический
надзор. При длительном приеме
глюкокортикоидов может возникнуть
инволюция тимуса и лимфоидной ткани.
Ослабление защитных иммунных реакций
организма является серьезным побочным
эффектом при длительном лечении
глюкокортикоидами, так как возрастает
вероятность присоединения вторичной
инфекции. Кроме того, усиливается и
опасность развития опухолевого процесса
из-за депрессии иммунологического
надзора. С другой стороны, эти эффекты
глюкокортикоидов позволяют рассматривать
их как активных иммунодепрессантов.Глюкокортикоиды
повышают чувствительность гладких
мышц сосудов к катехоламинам, что может
привести к возрастанию артериального
давления. Этому способствует и их
небольшое минералокортикоидное
действие: задержка натрия и воды в
организме.Глюкокортикоиды
стимулируют секрецию соляной кислоты.
Образование
глюкокортикоидов корой надпочечников
стимулируется АКТГ аденогипофиза.
Избыточное содержание глюкокортикоидов
в крови приводит к торможению синтеза
АКТГ и кортиколиберина гипоталамусом.
Таким образом, гипоталамус, аденогипофиз
и кора надпочечников объединены
функционально и поэтому выделяют единую
гипотоламо-гипофизарно-надпочечниковую
систему. При острых стрессовых ситуациях
быстро повышается уровень глюкокортикоидов
в крови. В связи с метаболическими
эффектами они быстро обеспечивают
организм энергетическим материалом.
Содержание
глюкокортикоидов в крови самое высокое
в 6-8 часов утра.
3.
Половые гормоны
– влияют на развитие вторичных половых
признаков, на развитие мышц, рост волос
и шерсти, регулируют белковый обмен.
Мозговой
слой надпочечников
вырабатывает катехоламины: адреналин
и норадреналин.
На долю адреналина приходится около
80%, на долю норадреналина – около 20%
гормональной секреции. Секреция
адреналина и норадреналина осуществляется
хромаффинными клетками из аминокислоты
тирозина (тирозин-ДОФА-дофамин-норадреналин-адреналин).
Инактивация осуществляется моноаминоксидазой
и катехоло-метилтрансферазой.
Адреналин
стимулирует деятельность сердца,
суживает сосуды, кроме коронарных,
сосудов легких, головного мозга,
работающих мышц, на которые он оказывает
сосудорасширяющее действие. Адреналин
расслабляет мышцы бронхов, тормозит
перистальтику и секрецию кишечника и
повышает тонус сфинктеров, расширяет
зрачок, уменьшает потоотделение,
усиливает процессы катаболизма и
образования энергии. Адреналин влияет
на углеводный обмен, усиливая расщепление
гликогена в печени и мышцах, в результате
чего повышается содержание глюкозы в
плазме крови. Адреналин активирует
липолиз. Катехоламины участвуют в
активации термогенеза.
Гипокортицизмбывает
двух видов:
1)
связанный с недостаточностью
минералокортикоидов – при
этом нарушается реабсорбция натрия в
почечных канальцах и как следствие
увеличивается выделение натрия, а также
хлора и воды. Это приводит к дегидратации
организма.
2)
связанный с недостатком глюкокортикоидов
– при этом
организм не в состоянии поддерживать
нормальный уровень сахара в крови
натощак.
Полное
удаление коры надпочечников быстро
приводит к смерти, т.к. нарушается
водно-солевой обмен.
Гиперкортицизм
– проявляется в виде гиперфункции
какого-то одного слоя коры и проявляется
такими заболеваниями:
Синдром
Кона – гиперальдостеронизм – мышечная
слабость, гипертония, отеки, полиурия.Синдром
Иценко-Кушинга – гипергликокортицизм
– патологическое ожирение, отеки,
адинамия, мышечная слабость.Повышение
секреции половых гормонов – феминизация
мужчин и маскулинизация женщин.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
