Гормоны образующиеся в эндокринной части поджелудочной железы регулируют обмен

Оглавление темы “Гормон околощитовидных желез. Гормоны эпифиза. Гормоны поджелудочной железы. Гормоны половых желез. Гормоны тимуса.”: Гормоны поджелудочной железы. Островки Лангерганса. Соматостатин. Амилин. Регуляторные функции гормонов поджелудочной железы.Эндокринную функцию в поджелудочной железе выполняют скопления клеток эпителиального происхождения, получившие название островков Лангерганса и составляющие всего 1 —2 % массы поджелудочной железы — экзокринного органа, образующего панкреатический пищеварительный сок. Количество островков в железе взрослого человека очень велико и составляет от 200 тысяч до полутора миллионов. В островках различают несколько типов клеток, продуцирующих гормоны: альфа-клетки образуют глюкагон, бета-клетки — инсулин, дельта-клетки — соматостатин, джи-клетки — гастрин и РР- или F-клетки — панкреатический полипептид. Помимо инсулина в бета-клетках синтезируется гормон амилин, обладающий противоположными инсулину эффектами. Кровоснабжение островков более интенсивно, чем основной паренхимы железы. Иннервация осуществляется постганлионарными симпатическими и парасимпатическими нервами, причем среди клеток островков расположены нервные клетки, образующие нейроинсулярные комплексы.
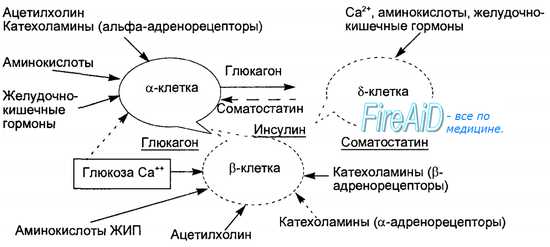
Инсулин синтезируется в эндоплазматическом ретикулуме бета-клеток вначале в виде пре-проинсулина, затем от него отщепляется 23-аминокис-лотная цепь и остающаяся молекула носит название проинсулина. В комплексе Гольджи проинсулин упаковывается в гранулы, в них осуществляется расщепление проинсулина на инсулин и соединительный пептид (С-пептид). В гранулах инсулин депонируется в виде полимера и частично в комплексе с цинком. Количество депонированного в гранулах инсулина почти в 10 раз превышает суточную потребность в гормоне. Секреция инсулина происходит путем экзоцитоза гранул, при этом в кровь поступает эквимолярное количество инсулина и С-пептида. Определение содержания последнего в крови является важным диагностическим тестом оценки секреторной способности (3-клеток. Секреция инсулина является кальцийзависимым процессом. Под влиянием стимула — повышенного уровня глюкозы в крови — мембрана бета-клеток деполяризуется, ионы кальция входят в клетки, что запускает процесс сокращения внутриклеточной микротубулярной системы и перемещение гранул к плазматической мембране с последующим их экзоцитозом. Секреторная функция разных клеток островков взаимосвязана, зависит от эффектов образуемых ими гормонов, в связи с чем островки рассматриваются как своеобразный «мини-орган» (рис. 6.21). Выделяют два вида секреции инсулина: базальную и стимулированную. Базальная секреция инсулина осуществляется постоянно, даже при голодании и уровне глюкозы крови ниже 4 ммоль/л. Стимулированная секреция инсулина представляет собой ответ бета-клеток островков на повышенный уровень D-глюкозы в притекающей к бета-клеткам крови. Под влиянием глюкозы активируется энергетический рецептор бета-клеток, что увеличивает транспорт в клетку ионов кальция, активирует аденилатциклазу и пул (фонд) цАМФ. Через эти посредники глюкоза стимулирует выброс инсулина в кровь из специфических секреторных гранул. Усиливает ответ бета-клеток на действие глюкозы гормон двенадцатиперстной кишки — желудочный ингибиторный пептид (ЖИП). В регуляции секреции инсулина определенную роль играет и вегетативная нервная система. Блуждающий нерв и ацетилхолин стимулируют секрецию инсулина, а симпатические нервы и норадреналин через альфа-адренорецепторы подавляют секрецию инсулина и стимулируют выброс глюкагона. Специфическим ингибитором продукции инсулина является гормон дельта-клеток островков — соматостатин. Этот гормон образуется и в кишечнике, где тормозит всасывание глюкозы и тем самым уменьшает ответную реакцию бета-клеток на глюкозный стимул. Образование в поджелудочной железе и кишечнике пептидов, аналогичных мосговым, например сомато-статина, подтверждает существование в организме единой APUD-системы. Секреция глюкагона стимулируется снижением уровня глюкозы в крови, гормонами желудочно-кишечного тракта (ЖИП гастрин, секретин, холе-цистокинин-панкреозимин) и при уменьшении в крови ионов Са2+. Подавляют секрецию глюкагона инсулин, соматостатин, глюкоза крови и Са2+. В эндокринных клетках кишечника образуется глюкагоноподобный пептид-1, стимулирующий всасывание глюкозы и секрецию инсулина после приема пищи. Клетки желудочно-кишечного тракта, продуцирующие гормоны, являются своеобразными «приборами раннего оповещения» клеток панкреатических островков о поступлении пищевых веществ в организм, требующих для утилизации и распределения участия панкреатических гормонов. Эта функциональная взаимосвязь нашла отражение в термине «гастро-энтеро-панкреатическая система». – Также рекомендуем “Инсулин. Физиологические эффекты инсулина. Схема транспорта глюкозы через клеточные мембраны. Основные эффекты инсулина.” |
Источник
Поджелудочная железа расположена на задней стенке брюшной полости, позади желудка, на уровне L1-L2 и простирается от двенадцатиперстной кишки до ворот селезенки. Длина ее составляет около 15 см, масса – около 100 г. В поджелудочной железе различают головку, располагающуюся в дуге двенадцатиперстной кишки, тело и хвост, достигающий ворот селезенки и лежащий ретроперитонеально. Кровоснабжение поджелудочной железы осуществляется селезеночной и верхней мезентериальной артерией. Венозная кровь поступает в селезеночную и верхнюю мезентериальную вены. Иннервируется поджелудочная железа симпатическими и парасимпатическими нервами, терминальные волокна которых контактируют с клеточной мембраной островковых клеток.
Поджелудочная железа обладает экзокринной и эндокринной функцией. Последняя осуществляется островками Лангерганса, которые составляют около 1-3 % массы железы (от 1 до 1,5 млн). Диаметр каждого – около 150 мкм. В одном островке содержится от 80 до 200 клеток. Различают несколько их видов по способности секретировать полипептидные гормоны. А-клетки продуцируют глюкагон, В-клетки – инсулин, D-клетки – соматостатин. Обнаружен еще ряд островковых клеток, которые предположительно могут продуцировать вазоактивный интерстициальный полипептид (ВИП), гастроинтестинальный пептид (ГИП) и панкреатический полипептид. В-клетки локализуются в центре островка, а остальные – по его периферии. Основную массу – 60 % клеток – составляют В-клетки, 25 % – А-клетки, 10 % – D-клетки, остальные – 5 % массы.
Инсулин образуется в В-клетках из его предшественника – проинсулина, который синтезируется на рибосомах грубой эндоплазматической сети. Проинсулин состоит из 3 пептидных цепей (А, В и С). А- и В-цепочки соединены дисульфидными мостиками, С-пептид связывает А- и В-цепи. Молекулярная масса проинсулина – 9000 дальтон. Синтезированный проинсулин поступает в аппарат Гольджи, где под влиянием протеолитических ферментов расщепляется на молекулу С-пептида с молекулярной массой 3000 дальтон и молекулу инсулина с молекулярной массой 6000 дальтон. А-цепь инсулина состоит из 21 аминокислотного остатка, В-цепь – из 30, а С-пептид – из 27-33. Предшественником проинсулина в процессе его биосинтеза является препроинсулин, который отличается от первого наличием еще одной пептидной цепочки, состоящей из 23 аминокислот и присоединяющейся к свободному концу В-цепи. Молекулярная масса препроинсулина – 11 500 дальтон. Он быстро превращается в проинсулин на полисомах. Из аппарата Гольджи (пластинчатый комплекс) инсулин, С-пептид и частично проинсулин поступают в везикулы, где первый связывается с цинком и депонируется в кристаллическом состоянии. Под влиянием различных стимулов везикулы продвигаются к цитоплазматической мембране и путем эмиоцитоза освобождают инсулин в растворенном виде в прекапиллярное пространство.
Самый мощный стимулятор его секреции – глюкоза, которая взаимодействует с рецепторами цитоплазматическои мембраны. Ответ инсулина на ее воздействие является двухфазным: первая фаза – быстрая – соответствует выбросу запасов синтезированного инсулина (1-й пул), вторая – медленная – характеризует скорость его синтеза (2-й пул). Сигнал от цитоплазматического фермента – аденилатциклазы – передается на систему цАМФ, мобилизующую из митохондрий кальций, который принимает участие в освобождении инсулина. Кроме глюкозы, стимулирующим влиянием на освобождение и секрецию инсулина обладают аминокислоты (аргинин, лейцин), глюкагон, гастрин, секретин, панкреозимин, желудочный ингибирующии полипептид, неиротензин, бомбезин, сульфаниламидные препараты, бета-адреностимуляторы, глюкокортикоиды, СТГ, АКТГ. Подавляют секрецию и освобождение инсулина гипогликемия, соматостатин, никотиновая кислота, диазоксид, альфа-адреностимуляция, фенитоин, фенотиазины.
Инсулин в крови находится в свободном (иммунореактивный инсулин, ИРИ) и связанном с белками плазмы состоянии. Деградация инсулина происходит в печени (до 80 %), почках и жировой ткани под влиянием глютатионтрансферазы и глютатионредуктазы (в печени), инсулиназы (в почках), протеолитических ферментов (в жировой ткани). Проинсулин и С-пептид также подвергаются деградации в печени, но значительно медленнее.
Инсулин дает множественный эффект на инсулинзависимые ткани (печень, мышцы, жировая ткань). На почечную и нервную ткани, хрусталик, эритроциты он не оказывает непосредственного действия. Инсулин является анаболическим гормоном, усиливающим синтез углеводов, белков, нуклеиновых кислот и жира. Его влияние на углеводный обмен выражается в увеличении транспорта глюкозы в клетки инсулинзависимых тканей, стимуляции синтеза гликогена в печени и подавлении глюконеогенеза, и гликогенолиза, что вызывает понижение уровня сахара в крови. Влияние инсулина на белковый обмен выражается в стимуляции транспорта аминокислот через цитоплазматическую мембрану клеток, синтеза белка и торможения его распада. Его участие в жировом обмене характеризуется включением жирных кислот в триглицериды жировой ткани, стимуляцией синтеза липидов и подавлением липолиза.
Биологический эффект инсулина обусловлен его способностью связываться со специфическими рецепторами клеточной цитоплазматическои мембраны. После соединения с ними сигнал через встроенный в оболочку клетки фермент – аденилатциклазу – передается на систему цАМФ, которая при участии кальция и магния регулирует синтез белка и утилизацию глюкозы.
Базальная концентрация инсулина, определяемая радиоиммунологически, составляет у здоровых 15-20 мкЕД/мл. После пероральной нагрузки глюкозой (100 г) уровень его через 1 ч повышается в 5-10 раз по сравнению с исходным. Скорость секреции инсулина натощак составляет 0,5-1 ЕД/ч, а после приема пищи увеличивается до 2,5-5 ЕД/ч. Секрецию инсулина увеличивает парасимпатическая и уменьшает симпатическая стимуляция.
Глюкагон является одноцепочечным полипептидом с молекулярной массой 3485 дальтон. Он состоит из 29 аминокислотных остатков. Расщепляется в организме при помощи протеолитических ферментов. Секрецию глюкагона регулируют глюкоза, аминокислоты, гастроинтестинальные гормоны и симпатическая нервная система. Ее усиливают гипогликемия, аргинин, гастроинтестинальные гормоны, особенно панкреозимин, факторы, стимулирующие симпатическую нервную систему (физическая нагрузка и др.), уменьшение содержания в крови СЖК.
Угнетают продукцию глюкагона соматостатин, гипергликемия, повышенный уровень СЖК в крови. Содержание глюкагона в крови повышается при декомпенси-рованном сахарном диабете, глюкагономе. Период полураспада глюкагона составляет 10 мин. Инактивируется он преимущественно в печени и почках путем расщепления на неактивные фрагменты под влиянием ферментов карбоксипептидазы, трипсина, хемотрипсина и др.
Основной механизм действия глюкагона характеризуется увеличением продукции глюкозы печенью путем стимуляции его распада и активации глюконеогенеза. Глюкагон связывается с рецепторами мембраны гепатоцитов и активирует фермент аденилатциклазу, которая стимулирует образование цАМФ. При этом происходит накопление активной формы фосфорилазы, участвующей в процессе глюконеогенеза. Кроме того, подавляется образование ключевых гликолитических ферментов и стимулируется выделение энзимов, участвующих в процессе глюконеогенеза. Другая глюкагонзависимая ткань – жировая. Связываясь с рецепторами адипоцитов, глюкагон способствует гидролизу триглицеридов с образованием глицерина и СЖК. Этот эффект осуществляется путем стимуляции цАМФ и активации гормоночувствительной липазы. Усиление липолиза сопровождается повышением в крови СЖК, включением их в печень и образованием кетокислот. Глюкагон стимулирует гликогенолиз в сердечной мышце, что способствует увеличению сердечного выброса, расширению артериол и уменьшению общего периферического сопротивления, уменьшает агрегацию тромбоцитов, секрецию гастри-на, панкреозимина и панкреатических ферментов. Образование инсулина, соматотропного гормона, кальцитонина, катехоламинов, выделение жидкости и электролитов с мочой под влиянием глюкагона увеличиваются. Его базальный уровень в плазме крови составляет 50-70 пг/мл. После приема белковой пищи, во время голодания, при хронических заболеваниях печени, хронической почечной недостаточности, глюкагономе содержание глюкагона увеличивается.
Соматостатин представляет собой тетрадекапептид с молекулярной массой 1600 дальтон, состоящий из 13 аминокислотных остатков с одним дисульфидным мостиком. Впервые соматостатин был обнаружен в переднем гипоталамусе, а затем – в нервных окончаниях, синаптических пузырьках, поджелудочной железе, желудочно-кишечном тракте, щитовидной железе, сетчатке. Наибольшее количество гормона образуется в переднем гипоталамусе и D-клетках поджелудочной железы. Биологическая роль соматостатина заключается в подавлении секреции соматотропного гормона, АКТГ, ТТГ, гастрина, глюкагона, инсулина, ренина, секретина, вазоактивного желудочного пептида (ВЖП), желудочного сока, панкреатических ферментов и электролитов. Он понижает абсорбцию ксилозы, сократимость желчного пузыря, кровоток внутренних органов (на 30-40 %), перистальтику кишечника, а также уменьшает освобождение ацетилхолина из нервных окончаний и электровозбудимость нервов. Период полураспада парентерально введенного соматостатина составляет 1-2 мин, что позволяет рассматривать его как гормон и нейротрансмиттер. Многие эффекты соматостатина опосредуются через его влияние на вышеперечисленные органы и ткани. Механизм же его действия на клеточном уровне пока неясен. Содержание соматостатина в плазме крови здоровых лиц составляет 10-25 пг/л и повышается у больных сахарным диабетом I типа, акромегалией и при D-клеточной опухоли поджелудочной железы (соматостатиноме).
Роль инсулина, глюкагона и соматостатина в гомеостазе. В энергетическом балансе организма основную роль играют инсулин и глюкагон, которые поддерживают его на определенном уровне при различных состояниях организма. Во время голодания уровень инсулина в крови понижается, а глюкагона – повышается, особенно на 3-5-й день голодания (примерно в 3-5 раз). Увеличение секреции глюкагона вызывает повышенный распад белка в мышцах и увеличивает процесс глюконеогенеза, что способствует пополнению запасов гликогена в печени. Таким образом, постоянный уровень глюкозы в крови, необходимый для функционирования мозга, эритроцитов, мозгового слоя почек, поддерживается за счет усиления глюконеогенеза, гликогенолиза, подавления утилизации глюкозы другими тканями под влиянием увеличения секреции глюкагона и уменьшения потребления глюкозы инсулинзависимыми тканями в результате снижения продукции Инсулина. В течение суток мозговая ткань поглощает от 100 до 150 г глюкозы. Гиперпродукция глюкагона стимулирует липолиз, что повышает в крови уровень СЖК, которые используются сердечной и другими мышцами, печенью, почками в качестве энергетического материала. При длительном голодании источником энергии становятся и кетокислоты, образующиеся в печени. При естественном голодании (в течение ночи) или при длительных перерывах в приеме пищи (6-12 ч) энергетические потребности инсулинзависимых тканей организма поддерживаются за счет жирных кислот, образующихся во время липолиза.
После приема пищи (углеводистой) наблюдаются быстрое повышение уровня инсулина и уменьшение содержания глюкагона в крови. Первый вызывает ускорение синтеза гликогена и утилизацию глюкозы инсулинзависимыми тканями. Белковая пища (например, 200 г мяса) стимулирует резкий подъем концентрации в крови глюкагона (на 50-100 %) и незначительный – инсулина, что способствует усилению глюконеогенеза и увеличению продукции глюкозы печенью.
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10]
Источник
Две части находятся в структуре поджелудочной железы, каждая из которых имеет свою функциональную задачу, и экзокринная. Экзокринная часть более объемная по сравнению с эндокринным собратом, и имеет в своем распоряжении 98% общего веса органа.
В этой части продуцируется панкреатический сок, который попадает в кишечник с пищей и помогает ее расщеплять, преобразуя в энергию нашего организма. 2% оставшегося объема железы имеют вкрапления клеток, именуемых панкреатическими островками или островками Лангерганса. В этих клетках синтезируются гормоны, регулирующие метаболизм, т. е. способствуют прохождению различных химических реакций с начала заброса в организм пищи до выброса конечных продуктов из него.

Гормоны участвуют в сложнейшем процессе перевода пищи в жизненную энергию организма. Клетки, вырабатывающие гормоны, не имеют специальных выводных путей. Их секрет сразу всасывается в кровь и разносится по всем органам. Поэтому гормоны поджелудочной железы и их функции важное информационное обеспечение человека необходимыми знаниями.
Клетки поджелудочной железы и продуцируемые ими гормоны
Клетки эндокринной части железы имеют различные виды и каждая из них отвечает за синтез своего гормона.
- альфа-клетки (Α-клетки) синтезируют глюкагон. Его действие в повышении уровня глюкозы в крови;
- бета-клетки (Β-клетки) продуцируют инсулин. Он занимается утилизацией глюкозы, удерживая ее подходящий уровень в крови;
- дельта клетки (Δ-клетки) представляют соматостатин, который является регулирующим гормоном. Он координирует внешнюю и внутреннюю секреторную деятельность железы;
- РР-клетки вырабатывают панкреатический полипептид, функциональность которого в регулировании желчеотделения, содействие белковому обмену;
- G-клетки продуцируют гастрин, который воздействует на качество желудочного сока, объема соляной кислоты и пепсина.
Механизм гормонального действия и функции
Вещество С-пептида, не относящееся к гормонам, представляет фрагмент молекулы инсулина. При ее синтезе он отрывается от родной клетки и попадает в кровеносную систему. Его объем эквивалентен объему инсулина.
Поскольку в нем отсутствуют химические реакции, признается наиболее верным показателем нахождения инсулина в крови. В современной медицине на его основе диагностируют диабеты инсулинозависимые и инсулиннезависимые, а также новообразования и печеночные патологии. Поджелудочная железа имеет задачи для всех гормонов, вырабатываемых в ее пределах:

Глюкагон
В задачи которого входит слежение за упадком глюкозы и ее повышением до нормы в крови. Механизм действия:
- глюкагон стимулирует повышение наличия глюкозы в кровяной системе в результате накапливания в печени и мышцах;
- глюкагон также стимулирует распад липидов, базирующихся в жировой ткани, благодаря чему появляется новый источник энергии;
- глюконеогенез, который приводит к рождению глюкозы из неуглеводных компонентов. Он необходим для многих участков, нуждающихся в глюкозе. Здесь можно назвать эритроциты и ткани нервной системы.

Инсулин
Который является ключевым гормоном поджелудочной железы. Его основная цель заключается в понижении глюкозы в составе крови. Понижение использует различные механизмы действия:
- чтобы донести молекулы глюкозы внутрь клеток, инсулин запускает в работу мембранныерецепторы;
- заброс излишек глюкозы в закрома печени в виде гликогена. Процесс поддерживается при помощи инсулина;
- угнетение глюконеогенеза, т. е. не позволяет расщепление из элементов неуглеводных источников глюкозы;
- инсулин способствует транспортировке в клетку полезных элементов магния, калия, аминокислот, фосфатов;
- увеличение биосинтеза белка, приглушение его гидролиза, что способствует отсутствию дефицита белка в организме, развитию полноценного иммунитета;
- инсулин с одной стороны синтезирует жирные кислоты для дальнейшей активации запасов жира, с другой стороны, запрещает их проникновение в кровь. Таким образом, уменьшается объем вредного холестерина, что является профилактикой атеросклероза.

Самотостатин
Поджелудочная железа имеет свой влиятельный тормоз в виде соматостатина на другие свои ферменты и гормоны. Этот гормон образовывается в клетках тонкого кишечника, гипоталамуса, нервной системы. Он поддерживает баланс пищеварения, регулируя этот процесс, благодаря следующим действиям:
- тормозит движение измельченного провианта из желудка в кишечный тракт;
- замедляет производство желудочной кислоты и гастрина;
- угнетает динамичностьподжелудочных ферментов;
- уменьшает циркуляцию крови в забрюшинном пространстве;
- подавляет засасывание углеводов из пептическоготракта;
- понижает уровень глюкагона.

Полипепдид
Поджелудочная железа среди PP-клеток секретирует панкреатический полипептид. По механизму действия он служит антагонистом холецистокина. Подавляя секреторную деятельность железы, стимулирует выработку желудочного сока. Гормон молодой по обнаружению и находится в стадии изучения. То, что уже известно:
- сдерживание всплеска выкидывания в кровь билирубина, желчи, трипсина;
- способность расслабления гладкой мускулатуры желчного пузыря;
- торможение выработки ферментов, участвующих в пищеварении.

Главная задача панкреатического полипептида вырисовывается как экономия пищеварительных ферментов, а также желчи, которая сберегается до следующей трапезы.
Гастрин
Это гормон 2 органов: желудка и поджелудочной железы. По его объему железа имеет в меньшем количестве. Он контролирует работу тех гормонов, которые участвуют в процессе усваивания пищи. Сбои его продуцирования сказываются на работе ЖКТ. Чтобы исключить язвы желудка сдается анализ на гастрин. Гастрин имеет 3 разновидности:
- большой, имеющий в своем распоряжении 34 аминокислоты;
- малый, состоящий из 17 аминокислот;
- гастрин микро, в своем наборе имеет 14 аминокислот.
Важность задач, поставленных перед гормонами
Гормоны вырабатываются помимо поджелудочной железы и другими органами. Всех их объединяет прямой вывод в кровь и распространение по органам совместно с кислородом и питательными элементами. Их необходимость в организме на одной ступеньке с кислородом и питанием. Жизненные процессы не обойдутся без их влияния:
- рост и регенерация клеток;
- обменные процессы и получение энергии из пищи;
- регулирование глюкозы, кальция в крови и другие моменты жизни организма.
Излишек или недостаток любого гормона приведет человека к болезни. Найти причину болезни, а потом еще и лечить, процесс, требующий напряжения усилий. В постановке диагноза поможет врач эндокринолог, который порекомендует пройти комплекс лабораторных анализов, среди которых обязателен биохимический анализ крови, а также анализ на гормоны.
Самый страшный и почти любому человеку знакомый диагноз сахарного диабета. Помимо него, существует немалый перечень патологий, которые тоже не придадут качества жизни. Поджелудочную железу надо беречь. Первым этапом ее патологии является воспаление, которое именуется панкреатит.
Его лечение во многом зависит от питания. Соблюдение диеты главенствует в лечении панкреатита. Если рекомендации по исцелению плохо выполнялись, то патология перейдет в хроническую форму. А дальнейшая судьба железы будет зависеть от владельца.
Если он осознает, к чему приводят ее патологии, во что могут перерасти сбои функционирования, то сможет спасти свой орган. Всегда надо помнить о двойственности задач поджелудочной железы. И нарушение в любой ее части: будь то ферменты или гормоны, незамедлительно скажутся на работе всего организма.
Источник