Гормонов секретируется островками лангерганса поджелудочной железы
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 апреля 2020; проверки требуют 3 правки.
Островки Лангерга́нса — скопления гормон-продуцирующих (эндокринных) клеток, преимущественно в хвостовой части поджелудочной железы. Открыты в 1869 году немецким патологоанатомом Паулем Лангергансом (1849—1888). Островки составляют приблизительно 1—2 % массы поджелудочной железы. Поджелудочная железа взрослого здорового человека насчитывает около 1 миллиона островков (общей массой от одного до полутора граммов), которые объединяют понятием орган эндокринной системы.
Историческая справка[править | править код]
Пауль Лангерганс, будучи студентом-медиком, работая у Рудольфа Вирхова, в 1869 году описал скопления клеток в поджелудочной железе, отличавшиеся от окружающей ткани, названные впоследствии его именем[2][3]. В 1881 году К. П. Улезко-Строганова впервые указала на эндокринную роль этих клеток[4]. Инкреаторная функция поджелудочной железы была доказана в Страсбурге (Германия) в клинике крупнейшего диабетолога Наунина Mering и Minkowski в 1889 году — открыт панкреатический диабет и впервые доказана роль поджелудочной железы в его патогенезе[3]. Русский учёный Л. В. Соболев (1876—1919) в диссертации «К морфологии поджелудочной железы при перевязке её протока при диабете и некоторых других условиях» показал, что перевязка выводного протока поджелудочной железы приводит ацинозный (экзокринный) отдел к полной атрофии, тогда как панкреатические островки остаются нетронутыми. На основании опытов Л. В. Соболев пришёл к выводу: «функцией панкреатических островков является регуляция углеводного обмена в организме. Гибель панкреатических островков и выпадение этой функции вызывает болезненное состояние — сахарное мочеизнурение»[3].
В дальнейшем благодаря ряду исследований, проведенных физиологами и патофизиологами в различных странах (проведение панкреатэктомии, получение избирательного некроза бета-клеток поджелудочной железы химическим соединением аллоксаном), получены новые сведения об инкреаторной функции поджелудочной железы.
В 1907 году Lane & Bersley (Чикагский университет) показали различие между двумя видами островковых клеток, которые они назвали тип A (альфа-клетки) и тип B (бета-клетки).
В 1909 году бельгийский исследователь Ян де Мейер предложил называть продукт секреции бета-клеток островков Лангерганса инсулином (от лат. insula — островок). Однако прямых доказательств продукции гормона, влияющего на углеводный обмен, обнаружить не удавалось[3].
В 1921 году в лаборатории физиологии профессора J. Macleod в Торонтском университете молодому канадскому хирургу Фредерику Бантингу и его ассистенту студенту-медику Чарлзу Бесту удалось выделить инсулин.
В 1955 году Сангеру и соавторам (Кембридж) удалось определить последовательность аминокислот и строение молекулы инсулина[3].
В 1962 году Марлин и соавторы обнаружили, что водные экстракты поджелудочной железы способны повышать гликемию. Вещество, вызывающее гипергликемию, назвали «гипергликемическим-гликогенолитическим фактором». Это был глюкагон — один из основных физиологических антагонистов инсулина[3].
В 1967 году Донатану Стейнеру и соавторам (Чикагский университет) удалось обнаружить белок-предшественник инсулина — проинсулин. Они показали, что синтез инсулина бета клетками начинается с образования молекулы проинсулина, от которой в последующем по мере необходимости отщепляется С-пептид и молекула инсулина[3].
В 1973 году Джоном Энсиком (Вашингтонский университет), а также рядом учёных Америки и Европы была проведена работа по очистке и синтезу глюкагона и соматостатина[3].
В 1976 году Gudworth & Bottaggo открыли генетический дефект молекулы инсулина, обнаружив два типа гормона: нормальный и аномальный. последний является антагонистом по отношению к нормальному инсулину[3].
В 1979 году благодаря исследованиям Lacy & Kemp и соавторов появилась возможность пересадки отдельных островков и бета-клеток, удалось отделить островки от экзокринной части поджелудочной железы и осуществить трансплантацию в эксперименте. В 1979—1980 гг. при трансплантации бета-клеток преодолён видоспецифический барьер (клетки здоровых лабораторных животных имплантированы больным животным другого вида)[3].
В 1990 году впервые выполнена пересадка панкреатических островковых клеток больному сахарным диабетом[3].
Типы клеток[править | править код]
Данная диаграмма демонстрирует структурные отличия между панкреатическими островками крысы (вверху) и человека (внизу) pars ventralis pancreas (брюшная часть) — слева; pars dorsalis pancreas (спинная часть) — справа. Различные типы клеток окрашены по-разному: альфа-клетки — красным, бета-клетки — синим, дельта-клетки — фиолетовым, ПП-клетки — зелёным, эпсилон-клетки — жёлтым. Бета-клетки грызуна, в отличие от человека сгруппированы в характерное инсулиновое ядро.
Альфа-клетки[править | править код]
- Альфа-клетки составляют 15…20 % пула островковых клеток — секретируют глюкагон (естественный антагонист инсулина).
Бета-клетки[править | править код]
- Бета-клетки составляют 75…80 % пула островковых клеток — секретируют инсулин (с помощью белков-рецепторов проводит глюкозу внутрь клеток организма, активизирует синтез гликогена в печени и мышцах, угнетает глюконеогенез).
Дельта-клетки[править | править код]
- Дельта-клетки составляют 3…10 % пула островковых клеток — секретируют соматостатин (угнетает секрецию многих желез);
ПП-клетки[править | править код]
- ПП-клетки составляют 3…5 % пула островковых клеток — секретируют панкреатический полипептид (подавляет секрецию поджелудочной железы и стимулирует секрецию желудочного сока).
Эпсилон-клетки[править | править код]
- Эпсилон-клетки составляют <1 % пула островковых клеток — секретируют грелин[5][6] («гормон голода» — возбуждает аппетит).
Строение островка[править | править код]
Панкреатический островок является сложно устроенным функциональным микроорганом с определённым размером, формой и характерным распределением эндокринных клеток. Клеточная архитектура островка влияет на межклеточное соединение и паракринную регуляцию, синхронизирует высвобождение инсулина.
Долгое время считалось, что островки человека и экспериментальных животных сходны как по строению, так и по клеточному составу. Работы последнего десятилетия показали, что у взрослых людей преобладающим типом строения островков является мозаичный, при котором клетки всех типов перемешаны по всему островку, в отличие от грызунов, для которых характерен плащевой тип строения клеток, при котором бета-клетки формируют сердцевину, а альфа-клетки находятся на периферии. Однако, эндокринная часть поджелудочной железы имеет несколько типов организации: это могут быть единичные эндокринные клетки, их небольшие скопления, небольшие островки (диаметром < 100 мкм) и крупные (зрелые) островки.
Небольшие островки имеют у человека и грызунов одинаковое строение. Зрелые островки Лангерганса человека обладают выраженной упорядоченной структурой. В составе такого островка, окруженного соединительнотканной оболочкой, можно выявить дольки, ограниченные кровеносными капиллярами. Сердцевину долек составляет массив бета-клеток, на периферии долек в непосредственной близости с кровеносными капиллярами находятся альфа- и дельта-клетки. Таким образом, клеточная композиция островка зависит от его размера: относительное число альфа-клеток увеличивается вместе с размером островка, в то время как относительное число бета-клеток уменьшается[7].
См. также[править | править код]
Примечания[править | править код]
- ↑ 1 2 Foundational Model of Anatomy
- ↑ Langerhans P. Beiträge zur mikroskopischen Anatomie der Bauchspeicheldrüse : Inaugural-Dissertation, zur Erlangung der Doctorwürde in der Medicine und Chirurgie vorgelegt der Medicinischen Facultät der Friedrich-Wilhelms-Universität zu Berlin und öffentlich zu vertheidigen am 18. Februar 1869 (нем.). — Berlin: Buchdruckerei von Gustav Lange, 1869.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Клиническая диабетология / Ефимов А. С., Скробонская Н. А. — 1-е изд. — К.: Здоровья, 1998. — 320 с. — 3000 экз. — ISBN 5-311-00917-9.
- ↑ Жуковский М. А. Детская эндокринология. — 3-е изд. — М.: Медицина, 1995. — 656 с. — 8000 экз. — ISBN 5-225-01167-5.
- ↑ K. M. Andralojc, A. Mercalli, K. W. Nowak. et al. Ghrelin-producing epsilon cells in the developing and adult human pancreas (англ.). (недоступная ссылка)
- ↑ Epsilon cells (Cytokines&Cells Encyclopedia) (англ.). Архивировано 26 октября 2012 года.
- ↑ Прощина А. Е., Савельев С. В. Иммуногистохимическое исследование распределения α- и β-клеток в разных типах островков Лангерганса поджелудочной железы человека // Бюллетень экспериментальной биологии и медицины. — Изд. РАМН, 2013. — Т. 155, № 6. — С. 763—767. Архивировано 25 ноября 2015 года.
Ссылки[править | править код]
Источник
Оглавление темы “Гормон околощитовидных желез. Гормоны эпифиза. Гормоны поджелудочной железы. Гормоны половых желез. Гормоны тимуса.”: Гормоны поджелудочной железы. Островки Лангерганса. Соматостатин. Амилин. Регуляторные функции гормонов поджелудочной железы.Эндокринную функцию в поджелудочной железе выполняют скопления клеток эпителиального происхождения, получившие название островков Лангерганса и составляющие всего 1 —2 % массы поджелудочной железы — экзокринного органа, образующего панкреатический пищеварительный сок. Количество островков в железе взрослого человека очень велико и составляет от 200 тысяч до полутора миллионов. В островках различают несколько типов клеток, продуцирующих гормоны: альфа-клетки образуют глюкагон, бета-клетки — инсулин, дельта-клетки — соматостатин, джи-клетки — гастрин и РР- или F-клетки — панкреатический полипептид. Помимо инсулина в бета-клетках синтезируется гормон амилин, обладающий противоположными инсулину эффектами. Кровоснабжение островков более интенсивно, чем основной паренхимы железы. Иннервация осуществляется постганлионарными симпатическими и парасимпатическими нервами, причем среди клеток островков расположены нервные клетки, образующие нейроинсулярные комплексы.
Инсулин синтезируется в эндоплазматическом ретикулуме бета-клеток вначале в виде пре-проинсулина, затем от него отщепляется 23-аминокис-лотная цепь и остающаяся молекула носит название проинсулина. В комплексе Гольджи проинсулин упаковывается в гранулы, в них осуществляется расщепление проинсулина на инсулин и соединительный пептид (С-пептид). В гранулах инсулин депонируется в виде полимера и частично в комплексе с цинком. Количество депонированного в гранулах инсулина почти в 10 раз превышает суточную потребность в гормоне. Секреция инсулина происходит путем экзоцитоза гранул, при этом в кровь поступает эквимолярное количество инсулина и С-пептида. Определение содержания последнего в крови является важным диагностическим тестом оценки секреторной способности (3-клеток. Секреция инсулина является кальцийзависимым процессом. Под влиянием стимула — повышенного уровня глюкозы в крови — мембрана бета-клеток деполяризуется, ионы кальция входят в клетки, что запускает процесс сокращения внутриклеточной микротубулярной системы и перемещение гранул к плазматической мембране с последующим их экзоцитозом. Секреторная функция разных клеток островков взаимосвязана, зависит от эффектов образуемых ими гормонов, в связи с чем островки рассматриваются как своеобразный «мини-орган» (рис. 6.21). Выделяют два вида секреции инсулина: базальную и стимулированную. Базальная секреция инсулина осуществляется постоянно, даже при голодании и уровне глюкозы крови ниже 4 ммоль/л. Стимулированная секреция инсулина представляет собой ответ бета-клеток островков на повышенный уровень D-глюкозы в притекающей к бета-клеткам крови. Под влиянием глюкозы активируется энергетический рецептор бета-клеток, что увеличивает транспорт в клетку ионов кальция, активирует аденилатциклазу и пул (фонд) цАМФ. Через эти посредники глюкоза стимулирует выброс инсулина в кровь из специфических секреторных гранул. Усиливает ответ бета-клеток на действие глюкозы гормон двенадцатиперстной кишки — желудочный ингибиторный пептид (ЖИП). В регуляции секреции инсулина определенную роль играет и вегетативная нервная система. Блуждающий нерв и ацетилхолин стимулируют секрецию инсулина, а симпатические нервы и норадреналин через альфа-адренорецепторы подавляют секрецию инсулина и стимулируют выброс глюкагона. Специфическим ингибитором продукции инсулина является гормон дельта-клеток островков — соматостатин. Этот гормон образуется и в кишечнике, где тормозит всасывание глюкозы и тем самым уменьшает ответную реакцию бета-клеток на глюкозный стимул. Образование в поджелудочной железе и кишечнике пептидов, аналогичных мосговым, например сомато-статина, подтверждает существование в организме единой APUD-системы. Секреция глюкагона стимулируется снижением уровня глюкозы в крови, гормонами желудочно-кишечного тракта (ЖИП гастрин, секретин, холе-цистокинин-панкреозимин) и при уменьшении в крови ионов Са2+. Подавляют секрецию глюкагона инсулин, соматостатин, глюкоза крови и Са2+. В эндокринных клетках кишечника образуется глюкагоноподобный пептид-1, стимулирующий всасывание глюкозы и секрецию инсулина после приема пищи. Клетки желудочно-кишечного тракта, продуцирующие гормоны, являются своеобразными «приборами раннего оповещения» клеток панкреатических островков о поступлении пищевых веществ в организм, требующих для утилизации и распределения участия панкреатических гормонов. Эта функциональная взаимосвязь нашла отражение в термине «гастро-энтеро-панкреатическая система». – Также рекомендуем “Инсулин. Физиологические эффекты инсулина. Схема транспорта глюкозы через клеточные мембраны. Основные эффекты инсулина.” |
Источник
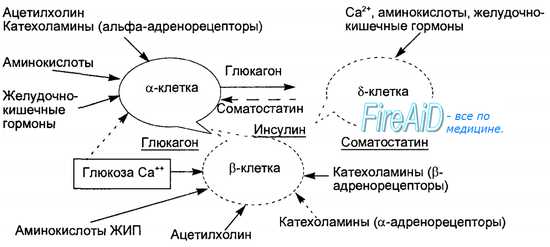
Островки Лангерганса поджелудочной железы состоят из:
- α-клеток – продуцируют глюкагон;
- β-клеток – продуцируют инсулин;
- δ-клеток– продуцируют соматостатин и др. гормоны (см. Приложения 1 и 2).
Эти гормоны, помимо системного действия, паракринно модулируют секрецию друг друга, работая как мини-орган: инсулин подавляет продукцию глюкагона, глюкагон стимулирует продукцию инсулина и соматостатина, а соматостатин подавляет продукцию и инсулина, и глюкагона.
Инсулин
Регуляция секреции
Основным стимулятором секреции инсулина является глюкоза, поступающая в кровь из желудочно-кишечного тракта при приеме пищи. Глюкоза стимулирует секрецию инсулина, действуя прямо на β-клетки, а также, увеличивая секрецию гормонов ЖКТ, стимулирующих продукцию инсулина (глюкагона, GLP-1, ГИП, гастрина, секретина, холецистокинина и др.). Помимо этого, продукцию инсулина повышают СТГ, плацентарный лактоген, эстрогены и прогестины. Во время беременности продукция инсулина также растет.
Секреция инсулина снижается на фоне голодания, физической нагрузки, стресса – ситуаций, сопровождаемых увеличенной потребностью в углеводах и жирах. При этом растет продукция глюкагона α-клетками и глюкагоноподобных пептидов кишечником. Гормон жировой ткани лептин и инсулин объединены реципрокными связями: лептин снижает продукцию инсулина, а инсулин, наоборот, повышает продукцию лептина жировой тканью. К веществам, подавляющим секрецию инсулина, также относятся соматостатин и катехоламины.
Структура и механизм действия
Инсулин и несколько родственных ему сигнальных соединений объединяют в «семейство инсулина». К нему относятся:
- Инсулин.
- Релаксин.
- Инсулиноподобные факторы роста (ИФР) 1 и 2.
Молекула инсулина состоит из двух аминокислотных цепей, A-цепи (21 а/к) и В-цепи (30 а/к), соединённых дисульфидными связями. В А-цепи имеется еще одна консервативная дисульфидная связь.
Рецептор
Рецептор инсулина относится к семейству гетеротетрамерных рецепторных тирозинкиназ. Он состоит из двух внеклеточных α-субъединиц и двух трансмембранных β-субъединиц (обладают тирозинкиназной активностью), соединенных дисульфидными связями. Связывание инсулина вызывает аутофосфорилирование рецептора по остаткам тирозина и фосфорилирование тирозиловых остатков других белков, включая белок-субстрат рецептора инсулина (IRS).
Функции
Инсулин – основной стимулятор утилизации и запасания углеводов:
- Облегчает поступление глюкозы в клетки мышечной и жировой ткани, индуцируя транслокацию GLUT4 из внутриклеточных везикул на ЦПМ.
- Активирует липогенез.
- Стимулирует синтез гликогена в печени и мышцах.
- Повышает экспрессию ферментов гликолиза.
- Снижает экспрессию ферментов
– глюконеогенеза и гликогенолиза – в печени;
– липолиза – в адипоцитах.
Усиление гликолиза под влиянием инсулина в скелетных мышцах и миокарде играет существенную роль в накоплении АТФ и обеспечении работоспособности миоцитов.
Биологический смысл утилизации углеводов под действием инсулина – их депонирование в форме жиров. Под действием гормона синтез триглицеридов многократно ускоряется благодаря одновременной активации липогенеза и ингибированию липолиза. Активный липогенез обеспечивается увеличенным поступлением глюкозы, а медленный липолиз – подавлением ГЧ-липазы инсулином и торможением гидролиза липидов продуктами расщепления глюкозы.
Помимо этого, инсулин увеличивает поступление ЖК в клетку за счет перемещения липопротеинлипазы (их транспортера) в ЦПМ. Во время действия инсулина, накапливаемые клеткой липиды не секретируются и происходит их депонирование до прекращения действия гормона или поступления других стимулов.Выступая в качестве ростового фактора, инсулин активирует синтез белка и препятствует его деградации. Это осуществляется, главным образом, благодаря фосфорилированию/дефосфорилированию факторов трансляции и белков рибосом.
Инсулин оказывает влияние на потребление пищи, повышая продукцию лептина (гормона насыщения) и снижая продукцию грелина (гормона голода). Поэтому при его низком уровне усиливается чувство голода и пищевое поведение, стимулируемые грелином. А сниженный уровень лептина ведет к сохранению энергетических запасов.
Нарушения работы инсулиновой оси приводят к развитию диабета. Диабет I типа (инсулинозависимый диабет) – заболевание, связанное с аутоиммунным повреждением β-клеток, продуцирующих инсулин. Это приводит к абсолютному дефициту инсулина и росту контринсулярных гормонов (глюкагона, адреналина, глюкокортикоидов).
Диабет II типа («инсулинонезависимый» диабет) – заболевание, первопричиной которого является развитие инсулинорезистетности на фоне генетической предрасположенности и неадекватного потребления углеводов, липидов. В этом случае уровень инсулина в крови компенсаторно растет в связи с толерантностью к инсулину (однако впоследствии снижается ниже нормы из-за истощения синтетической активности β-клеток), а концентрация контринсулярных гормонов падает.
ГИПЕРгликемическая кома:
Причина – недостаток инсулина
• Развивается медленно
• Кожа сухая, бледная
• Запах ацетона изо рта
• Дыхание редкое и глубокое
• Пульс частый, слабого наполнения
• Боли в животе
• Глазные яблоки мягкие
• Зрачки сужены
• Гипотермия
• Гипотония
Предвестники:
• Усиленная жажда
• Общая слабость
• Головокружение
• Сонливость
• Тошнота
Первая врачебная помощь:
• 0,9% NaCl в/в 1л/час
• Инсулин короткого действия 20 ЕД в/м
• Анализ гликемии (ежечасно до снижения < 13 мМ)
ГИПОгликемическая кома:
Причина – передозировка инсулина
• Развивается остро или подостро
• Дрожание конечностей и судороги
• Кожа влажная, бледная
• Дыхание поверхностное
• Зрачки расширены
• Пульс частый
• Гипотермия
• Гипотония
Предвестники:
• Дрожание конечностей
• Потливость
• Тахикардия
• Общая слабость
• Головокружение
• Сонливость
Первая врачебная помощь:
• Уложить на бок, освободить рот
• Нормализация гликемии
• 70 мл 40% раствора глюкозы в/в струйно
или
• Глюкагон 1 мг п/к или в/м
При неэффективности
• 5% раствор глюкозы в/в капельно
При сахарном диабете II типа в большинстве случаев нарушена система сигнализации через GLP-1. Сегодня в клиническую практику лечения СД II входят препараты, восстанавливающие работу этой системы.
Применяют:
• Синтетические аналоги GLP-1
• Лираглутид
• Эксенатид
• Ингибиторы DPP-IV*
• Видаглиптин
• Ситаглиптин
• Саксаглиптин
Подкожное введение этих препаратов позволяет повысить эффективность терапии и снизить дозы препаратов сульфонилмочевины, часто вызывающих гипогликемию.
*Дипептидилпептидаза-IV, фермент, разрушающий GLP-1
Глюкагон
Глюкагон – контринсулярный гормон, вырабатываемый α-клетками островков Лангерганса и энтероцитами (наряду с глюкагоноподобными пептидами). Активирует процессы липолиза и гликогенолиза, повышая концентрацию глюкозы и жирных кислот в крови.
Регуляция секреции
Продукция глюкагона возрастает при голодании и снижении уровня глюкозы в крови, а также при снижении уровня свободных жирных кислот. Продукцию глюкагона также стимулируют гормоны ЖКТ (гастрин, секретин, холецистокинин). Инсулин и соматостатин снижают продукцию глюкагона.
Структура и механизм действия
Глюкагон входит в большое семейство одноцепочечных пептидных гормонов ЖКТ, обладающих гомологичной структурой. Помимо глюкагона семейство включает глюкагоноподобные пептиды, соматолиберин, секретин, вазоактивный интестинальный пептид (ВИП), гастроингибирующий пептид и др.
Рецепторы всех гормонов этого семейства, в т.ч. глюкагона, сопряжены с Gs-белками. Передача сигнала происходит преимущественно по аденилатциклазному пути.
Функции
Глюкагон – гипергликемический гормон. Органами-мишенями для глюкагона являются печень, почки, кишечник, миокард и др. Этот гормон обеспечивает:
- Активацию энергозапасов
– глюконеогенез (печень);
– Гликогенолиз (печень);
– липолиз жирных кислот – в т.ч. с образованием кетоновых тел (печень и почки).
- Активацию синтеза и секреции ЖК
- Стимуляцию работы сердца
- Увеличение АД
- Ослабление моторики кишечника
- Снижение секреции HCl и грелина желудком
- Стимуляцию секреции инсулина и соматостатина.
В печени глюкагон активирует глюконеогенез и гликогенолиз, а также препятствует запасанию триглицеридов, делая их доступнее для других тканей. В печени и почке под его действием усиливаются липолиз и синтез ЖК, служащих источником энергии и субстратом для синтеза кетоновых тел. Действуя на миокард, этот гормон вызывает увеличение АД, частоты и силы сердечных сокращений. А глюкагон, продуцируемый в ЖКТ, ослабляет его моторную активность и секрецию HCl желудком.
При диабете I типа, сопровождающимся снижением продукции инсулина, продукция глюкагона существенно усиливается, увеличивая образование кетоновых тел и в тяжёлых случаях вызывая кетоацидоз.
Помимо этого, глюкагон повышает секрецию катехоламинов мозговым веществом надпочечников и чувствительность тканей к ним, стимулирует продукцию соматостатина и инсулина, снижает секрецию грелина желудком.
Соматстатин
Соматостатин δ-клеток – специфический ингибитор продукции инсулина и глюкагона. Этот гормон также образуется в гипоталамусе (см. главу Соматотропная ось), где подавляет продукцию СТГ (обладает гипергликимическими и липолитическими свойствами), и в кишечнике, где тормозит всасывание глюкозы, уменьшая ответную реакцию β-клеток. Кроме гормонов островкого аппарата поджелудочной железы в регуляции углеводного и липидного обмена принимает участие еще ряд гормонов.
Гормоны жировой ткани
Лептин – полипептидный гормон, продуцируемый главным образом адипоцитами. Его продукция растет пропорционально массе жировой ткани, а его интегральной функцией является мобилизация энергетических ресурсов для поддержания нормального объёма жировой ткани. Уровень лептина снижается при голодании и растет после приема пищи. Его избыточная продукция подавляет секрецию инсулина и вызывает резистентность ткани к его действию. Также этот гормон проявляет анорексигенные свойства, стимулируя центр насыщения, и угнетая секрецию орексигенного NPY и центр аппетита (см. рис. 65). В рамках целого организма это тормозит пищевое поведение и активирует центр теплопродукции.
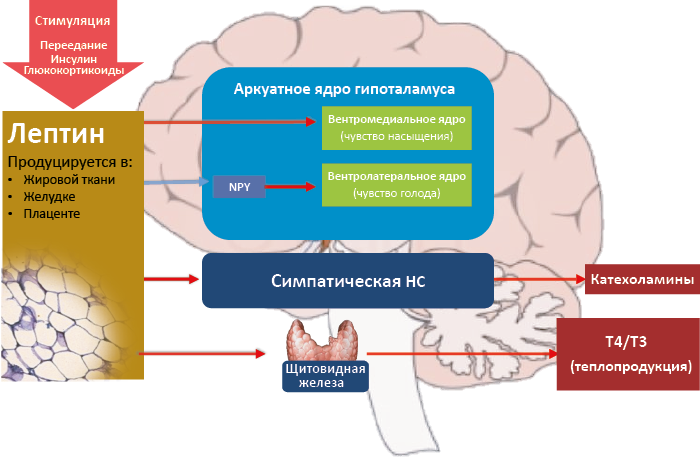
Рис. 65. Регуляция аппетита и термогенеза лептином
Адипонектин снижает уровни глюкозы и свободных ЖК в крови. Это происходит благодаря увеличению захвата глюкозы периферическими тканями, окисления жирных кислот в мышцах, а также усилению опосредованного инсулином торможения глюконеогенеза в печени.
Резистин способствует развитию резистентности тканей к действию инсулина и стимулирует продукцию глюкозы печенью.
Другие гормоны
Грелин – гормон желудка, стимулирующий аппетит, пищевое поведение положительный энергетический баланс и продукцию орексигенного NPY. Секреция растет при голодании.
Адреналин, действуя через β-адренорецепторы, оказывает гипергликемическое и гиперлипоацидемическое действие.
Алкоголь воздействует на липидный обмен подобно инсулину – блокирует липолиз и активирует липогенез (в отличии от инсулина также угнетает цикл Кребса). Поэтому диабетикам, принимающим алкоголь, во избежание гипогликемии следует уменьшать дозу инсулина либо увеличивать потребление сладкой пищи.
Для лечения сахарного диабета II типа традиционно использовались препараты сульфонилмочевины (применение ограничено из-за их способности вызывать гипогликемию). В настоящее время предпочтение отдаётся бигуанидинам (ЛС Метформин), избирательно повышающим чувствительность тканей к инсулину и средствам, воздействующим на систему GLP-1. Новыми препаратами для лечения инсулинорезистентности являются тиазолидиндионы (розиглитазон и др.), действующие через ядерные рецепторы PPAR, и увеличивающие чувствительность к инсулину в печени, жировой и мышечной ткани.
Так как глюкагон способен подобно β-адренорецепторам стимулировать аденилатциклазу, его используют при сердечной недостаточности, вызванной передозировкой β-блокаторов.
Лекарственный аналог соматостатина – Октреотид. Его применяют при гормонпродуцирующих опухолях гипофиза, когда другие препараты, например, D2-агонисты (напр. Бромокриптин), не эффективны. Однако со временем эффективность лечения снижается, так как Gi-субъединицы рецепторов соматостатина замещаются Gs-субъединицами, приводя к активации опухолевых клеток даже под действием тормозных лигандов.
Источник
