Фермент поджелудочной железы трипсин
Трёхмерная структура молекулы бычьего трипсина.
Трипсин — фермент класса гидролаз, расщепляющий пептиды и белки; обладает также эстеразной (гидролиз сложных эфиров) активностью.
Трипсин синтезируется в поджелудочной железе в виде неактивного предшественника (профермента) трипсиногена. Трипсины ряда животных получены в кристаллическом виде (впервые в 1932). Молекула бычьего трипсина (молекулярная масса около 24 кДа) состоит из 223 аминокислотных остатков, образующих одну полипептидную цепь, и содержит 6 дисульфидных связей. Изоэлектрическая точка трипсина лежит при pH 10,8, а оптимум каталитической активности — при pH 7,8—8,0.
Трипсины относятся к группе сериновых протеаз и содержат в активном центре остатки серина и гистидина. Трипсины легко подвергаются самоперевариванию (аутолизу), что приводит к загрязнению препаратов трипсинов неактивными продуктами (промышленный препарат содержит до 50 % неактивных примесей). Препараты трипсина высокой чистоты получают хроматографическими методами.
Физические свойства[править | править код]
Трипсин представляет собой бесцветное кристаллическое вещество с температурой плавления около 150 °C.
Биологические свойства и функции[править | править код]
Основной функцией является пищеварение. Катализирует гидролиз белков и пептидов. Может находиться в неактивном состоянии в виде трипсиногена. Активируется, в том числе кишечным ферментом энтеропептидазой, путём отщепления гексапептида. Катализирует также гидролиз восков-сложных эфиров.
Оптимум каталитической активности — при pH 7,8—8.
Активный центр имеет белковую природу и состоит в основном из серина и гистидина. Синтезируется в виде трипсиногена в поджелудочной железе и используется в кишечнике млекопитающих и рыб. Превращает остальные проферменты гидролаз в активные ферменты.
Применение[править | править код]
Трипсин используют для изготовления лекарств. Препараты трипсина обладают противовоспалительным и противоотёчным действием (при внутривенном и внутримышечном введении); способны избирательно расщеплять ткани, подвергшиеся некрозу. В медицине трипсин применяют для лечения ран, ожогов, тромбозов, часто в сочетании с другими ферментами и с антибиотиками. Используется при анализе первичной структуры белка, за счёт того, что он селективно гидролизует связи между остатками положительно заряженных аминокислот лизина и аргинина.
Родственные ферменты[править | править код]
«Ближайшие родственники» трипсина — трипсиноген, пепсин, химотрипсин[en]. У высших животных обнаружены анионные аналоги трипсина, у многих животных и растений — нейтральные.
Изменение гидролитических свойств[править | править код]
Активность трипсина подавляется фосфорорганическими соединениями, некоторыми металлами, а также рядом высокомолекулярных белковых веществ — ингибиторов трипсина, содержащихся в тканях животных, растений и микроорганизмов. Ионы Ca2+, Mg2+, Ba2+, Sr2+, Mn2+ повышают гидролитическую активность трипсина.
Литература[править | править код]
- Нортроп Д., Кунитц М., Херриотт Р. Кристаллические ферменты, пер. с англ., М., 1950.
- Мосолов В. В.. Протеолитические ферменты, М., 1971.
- В. И. Стручков, А. В. Григорян, В. К. Гостищев, С. В. Лохвицкий, Л. С. Тапинский Протеолитические ферменты в гнойной хирургии., М., 1970 г.
- К. Н. Веремеенко Протеолитические ферменты поджелудочной железы и их применение в клинике. Киев, 1967 г.
- Системная энзимотерапия. Опыт и перспективы / Под ред. В.И. Кулакова, В.А. Насоновой, В.С. Савельева. – СПб.: Интер-Медика. 2004. – 264 с.
Ссылки[править | править код]
- Трипсин (Trypsin): инструкция, применение и формула — Энциклопедия лекарств и товаров аптечного ассортимента.
Источник
ТРИПСИН — один из основных ферментов пищеварения. Секретируется поджелудочной железой в виде неактивного предшественника — трипсиногена, относится к пептид-гидролазам (КФ 3.4.21.4), гидролизует белки и пептиды. Появление активного Трипсина в ткани поджелудочной железы (см.) является одним из главных патогенетических факторов развития острого и хронического панкреатита (см.). Определение активности Трипсина и нек-рых других ферментов в дуоденальном содержимом используется для оценки функционального состояния поджелудочной железы и служит для дифференциальной диагностики панкреатита. Применение препарата трипсина в медицине в качестве лекарственного средства основано на способности Т. избирательно разрушать некротизированные ткани, разжижать мокроту и другие вязкие секреты, экссудат, сгустки крови, а также на его противовоспалительном и противоотечном действии и на способности этого фермента снижать резистентность гноеродной микрофлоры к антибиотикам. В связи с этим трипсин ускоряет процесс регенерации гнойных ран. При патологическом сокращении внешнесекреторной функции поджелудочной железы трипсин в составе панкреатина (см.) используют для заместительной терапии. Ключевое положение Т. в системе пищеварительных ферментов объясняется тем, что он не только участвует в расщеплении пищевых белков, но и активирует все проферменты, образуемые в поджелудочной железе, т. е. трипсиноген, химотрипсиногены А и В (см. Химотрипсин), прокарбоксипептидазы А и В (см. Карбоксипептидазы), проэластазу (см. Эластазы), профосфолипазу (см. Липазы). При попадании в кровяное русло и при недостаточности соответствующих ингибиторов Т. может активировать фактор Хагемана, плазминоген, пре-калликреин и запускать т. о. каскад реакций свертывающей системы крови (см. Свертывающая система крови), фибринолитпческой (см. Фибринолиз) и кининовой (см. Кинины) систем.
Трипсин был открыт в 1857 г. Ж. Корвизаром, а в 1867 г. Кюне (W. Kuhne) было предложено название «трипсин». В 1931 г. Нортропом (J. Н. Northrop) и др. фермент был получен в кристаллическом виде.
Трипсин обнаружен у позвоночных животных; фермент, аналогичный Т., найден у нек-рых беспозвоночных, микроорганизмов и высших растений. В поджелудочной железе человека и ряда млекопитающих обнаружены так наз. анионные Т., но свойствам похожие на Т., но изо-электрическая точка (см.) этих ферментов находится при более низких значениях pH. Наряду с пептидными связями Т. расщепляет также сложноэфирные и амидные связи, катализирует реакцию транспептидирования. Фермент характеризуется узкой субстратной специфичностью и избирательно гидролизует связи, образованные карбоксильными (COOH-) группами основных аминокислот аргинина (см.) и лизина (см.). Оптимальные значения pH для действия Т. 7,8—8,0.
Мол. вес (масса) Т. крупного рогатого скота равен 23 800; изоэлектрическая точка находится при pH 10,5. Молекула Т состоит из одной полипептидной цепи, построенной из 223 аминокислотных остатков и содержащей 6 дисульфидных связей. Третичная структура Т. также установлена. Т. относится к подклассу сериновых протеиназ, в активный центр фермента входят остатки серина (см.), гистидина (см.) и аспарагиновой кислоты (см.) в положении 183, 46 и 89 соответственно. Высокая специфичность Т. определяется присутствием в субстратсвязывающем участке активного центра остатка аспарагиновой к-ты в положении 177.
Активность Т. угнетается диизопропилфторфосфатом, фенилметилсульфонилфторидом, хлорметилкетоном N-тозил-L-лизина, лейпептином, нек-рыми металлами, 4-аминобензамидином и др., а также большим числом природных белковых ингибиторов, называемых иногда антитрипсинами, к-рые присутствуют в тканях животных, растений, микроорганизмов и предохраняют их от разрушения Т. Основными ингибиторами Т. в плазме крови являются альфа-1-протеиназный ингибитор (альфа-1-антитрипенн), альфа-2-макроглобулин и интер-альфа-ингибитор Т. В поджелудочной железе содержатся два ингибитора Т., один из к-рых секретируется в двенадцатиперстную кишку вместе с трипсиногеном и предохраняет его от преждевременной активации. Аналогичные секреторные ингибиторы Т. с мол. весом ок. 6000 обнаружены в секретах нек-рых желез. Препараты таких ингибиторов Т., выделенные из поджелудочной железы или легких,— контрикал, трасилол (см.) — используют в медицинской практике в качестве лечебных средств. С дефицитом или дефектом нек-рых ингибиторов Т. (напр., альфа-1-протеиназного ингибитора) связано развитие ряда патол. состояний.
Т. синтезируется бета-клетками поджелудочной железы в виде неактивного профермента трипсиногена (устаревшее и редко встречающееся название — претрипсин), к-рый в кишечнике превращается в Т. под влиянием фермента энтерокиназы (см.), а также самого Т. В процессе активации от N-концевого участка трипсиногена отщепляется гексапептид. При этом образуется так наз. бета-трипсин, к-рый в результате гидролиза еще одной пептидной связи превращается в альфа-трипсин, состоящий из двух пептидных цепей. В нейтральной и слабощелочной среде Т. легко подвергается аутолизу (самоперевариванию), что приводит к загрязнению препарата неактивными продуктами. Ионы Ca2+ способствуют активации трипсиногена и стабилизируют Т., предохраняя его от аутолиза. В щелочной среде Т. необратимо денатурируется, в кислой среде он стабилен. Т. термоустойчив: активность фермента сохраняется после кипячения в 0,01 М соляной к-те.
Т., получаемый из поджелудочной железы, очищают при помощи хроматографии (см.).
Для определения активности Т. предложены многочисленные методы. Широкое распространение получили метод Кунитца, основанный на расщеплении Т. казеина (см. Казеины) с последующим определением в безбелковом фильтрате содержания тирозина (cм.), и метод Эрлангера, в основе к-рого лежит применение синтетического субстрата n-нитроанилида N-бензотлm-D,L-аргинина (БАПН). Часто для определения активности Т. используют контролируемый спектрофотометрически гидролиз эфиров N-замещенного L-аргннина. Активность Т., определенная этим методом в дуоденальном содержимом человека, полученном тонким зондом, натощак, без применения специальных раздражителей, в норме составляет 100—150 миллиединиц (за единицу активности фермента принимают такую его активность, при к-рой происходит расщепление 1 мкмоль субстрата за 1 мин.). При остром и хроническом панкреатите в результате задержки выделения секрета происходит внутриорганная активация панкреатических ферментов и, в первую очередь, трипсина, к-рый активирует затем другие проферменты; это, в конечном счете, приводит к аутолизу паренхимы железы.
Трипсин как препарат
В качестве препарата в мед. практике используется гл. обр. Т. кристаллический, получаемый из поджелудочной железы крупного рогатого скота. Кроме того, Т. вместе с химотрипсином (см.) входит в состав препаратов панкреатина и химопсина (см.).
Трипсин кристаллический (Trypsinum crystallisatum) представляет собой порошок, белый или с легким желтоватым оттенком, без запаха. Легко растворим в воде и изотоническом растворе натрия хлорида; pH 0,2% водного раствора 3,0— 5,5. В нейтральных а щелочных растворах препарат быстро разрушается.
В хирургии Т. кристаллический используют для лечения гнойных и длительно незаживающих ран (см. Раны, ранения), остеомиелита (см.), трофических язв (см.), пролежней (см.) и ожогов (см.). В этих целях препарат применяют местно и внутримышечно. Местно препарат используют в виде 1—2,5% р-ров в изотоническом р-ре натрия хлорида для смачивания марлевых тампонов, вводимых в рану. При наличии жидкого гнойного отделяемого препарат можно вводить в рану в виде порошка (от 0,03 до 0,2 г). Внутримышечно препарат вводят взрослым по 0,005—0,01 г 1—2 раза в день, детям по 0,0025 г 1 раз в день. Непосредственно перед введением препарат растворяют в 1—2 мл стерильного изотонического р-ра натрия хлорида или 0,5—2% р-ра новокаина. Р-ры препарата необходимо вводить глубоко в верхний наружный квадрант ягодицы. Применение Т. при лечении гнойных ран позволяет в случае необходимости широко проводить пластические операции. При лечении хрон. остеомиелитов после вскрытия параоссальной флегмоны Т. применяют местно, а также используют его р-ры для промывания костных полостей и свищей.
Лечение трофических язв и длительно не заживающих ран с применением Т. проводят по той же методике, что и лечение гнойных ран. После очищения поверхности язв и ран от гнойно-некротических масс местное лечение Т. прекращают, а парентеральное введение препарата продолжают в течение нескольких (до 10) дней.
При гнойных заболеваниях легких р-ры Т. вводят ингаляционно (0,005—0,01 г препарата в 2—3 мл изотонического р-ра натрия хлорида) и внутримышечно, а при необходимости — путем эндотрахеального вливания (0,025—0,05 г препарата в 2—5 мл изотонического р-ра натрия хлорида). Т. как отхаркивающее средство (см.) прямого типа действия назначают обычно в ингаляциях и иногда внутримышечно при бронхитах, пневмониях и других заболеваниях легких, протекающих с образованием вязкой, трудно отделяющейся мокроты. При плевритах и эмпиеме плевры интраплеврально 1 раз в сутки вводят по 0,01—0,02 г препарата, растворенного в 20— 50 мл изотонического р-ра натрия хлорида.
Иногда Т. используют в комплексной терапии тромбофлебитов (см.) совместно с антикоагулянтами (см.), с этой целью его назначают внутримышечно в указанных выше дозах.
При пародонтозе (см.) и пародонтите в дополнение к внутримышечным инъекциям препарат вводят поднадкостнично (в область поражения).
В офтальмологии Т. кристаллический назначают внутримышечно и местно (в виде глазных капель и ванночек) при иритах, иридоциклитах (см.), кровоизлиянии в переднюю камеру глаза, посттравматическом и послеоперационном отеке окологлазных тканей. Для ванночек используют 0,2% р-ры препарата, а в качестве глазных капель — 0,25—1% р-ры, к-рые назначают по 3—4 раза в день в течение 2—3 дней.
Для внутримышечного введения применяют только Т. кристаллический. Для местного применения кроме него может использоваться также Т. аморфный.
Побочное действие Т. проявляется неодинаково в зависимости от путей введения. Так, после внутримышечного введения он может вызывать местную болезненность и гиперемию. После ингаляций Т. возможно появление признаков раздражения верхних дыхательных путей (охриплость голоса и др.). При парентеральном применении Т. может вызывать аллергические реакции, тахикардию и лихорадку. При возникновении аллергических реакций используют антигистаминные вещества (см.).
Препарат противопоказан при сердечной недостаточности, декомпенсированных формах туберкулеза легких, эмфиземе легких с дыхательной недостаточностью, циррозе печени, вирусном гепатите, панкреатите, заболеваниях почек и геморрагических диатезах. Препарат нельзя вводить в вену и наносить на изъязвленные поверхности злокачественных опухолей.
Форма выпуска: ампулы или флаконы, содержащие по 0,005 и 0,01 г трипсина кристаллического. Хранят в сухом, защищенном от света месте при температуре не выше 10°.
Библиогр.: Антонов В. К. Химия протеолиза, М., 1983; Богуш Л. К. и Шварцман Л. Я. Применение протеолитических ферментов при туберкулезе легких, М., 1970; Веремеенко К. Н. Ферменты протеолиза и их ингибиторы в медицинской практике, Киев, 1971; Гейтман И. Я., Кардаш Б. Е. и Кивман Г. Я. Изменение факторов гемокоагуляции под воздействием экзогенных протеиназ, Пробл. гематол. и перелив, крови, т. 27, № 10, с. 38, 1982; Клиническая фармакология, под ред. В. В. Закусова, с. 421, М., 1978; Машковский М. Д. Лекарственные средства, ч. 2, с. 20, М., 1977; Мосолов В. В. Протеолитические ферменты, М., 1971; Нортроп Д., Кунитц М. и Херриотт Р. Кристаллические ферменты, пер. с англ., М., 1950; Стручков В. И. и др. Протеолитические ферменты в гнойной хирургии, M, 1970; Ферменты в оториноларингологии, под ред. К. Н. Веремеенко, Киев, 1980; Townes P. L. Trypsinogen deficiency disease, J. Pediat., v. 66, p. 275, 1965; Townes P. L., Bryson M. F. a. Miller G. Further observations on trypsinogen deficiency disease, ibid., v. 71, p. 220, 1967.
Л. А. Локшина; В. К. Муратов (фарм.).
Источник
Если вы никогда не обращали внимания даже на умеренные боли в области желудка, можете легко пропустить воспалительный процесс в поджелудочной железе. И это, может дорого вам обойтись и в финансовом плане, и в перспективе выздоровления.
Если сказать коротко, по сути, воспалённая железа перестаёт вырабатывать ферменты, без которых не может протекать пищеварительный процесс. А без этого организм не переработает необходимые для его жизнедеятельности вещества, которые поступают с пищей: белки, жиры, углеводы.
И вот в таких случаях на помощь придут препараты, которые способны заменить ферменты поджелудочной железы и помогут вам поправить здоровье и жить дальше.
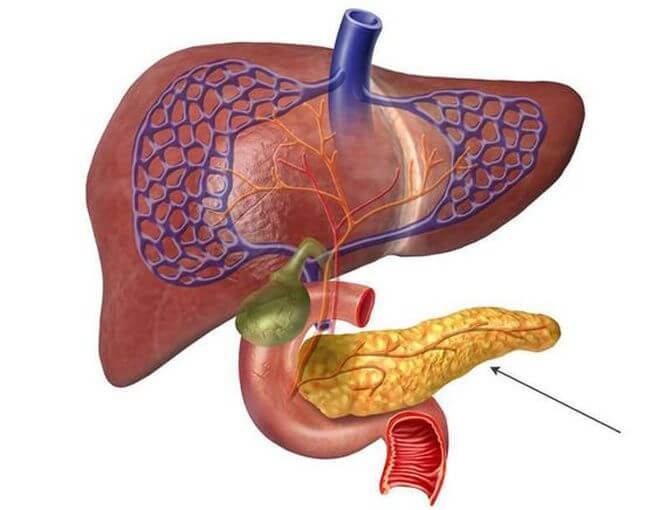
Поджелудочная железа (панкреас) и её ферменты
Этот небольшой по размерам орган располагается, как говорит, её название, в области желудка. И это неслучайно, поскольку ферментам железы надлежит продолжить пищеварение, начатое ещё в ротовой полости и продолженное в желудке.
Для этой цели секрет железы по специальному протоку стекает в начальный отдел кишечной трубки, двенадцатиперстную кишку. И такого секрета за 24 часа выделяется от половины до одного литра.
Ферменты поступают в кишечник внерабочем состоянии. Активация их происходит при соединении с соляной кислотой желудочного сока, которым обработана пища, поступившая из желудка. Другим активатором ферментов железы служит желчь, поступающая по своему протоку.
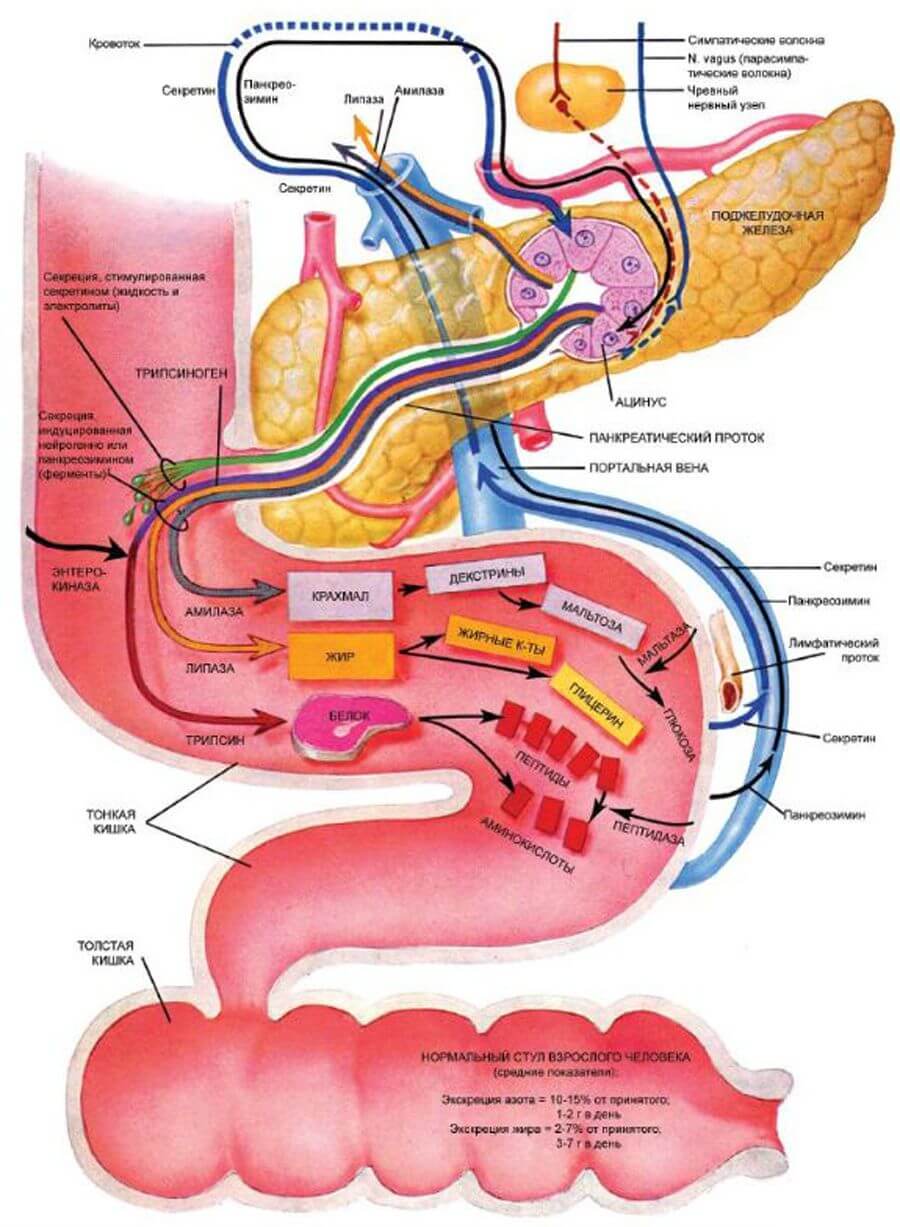
Ферменты для поджелудочной железы, что же это за ферменты:
| Амилаза | Служит для расщепления углеводов |
| Трипсин и химотрипсин | Без их участия не завершился бы процесс протеолиза (расщепления) белков, начавшийся в желуде |
| Липаза | Ей предстоит расщеплять жиры, начало чему положила желчь, поступившая из желчного пузыря |
Каких панкреатических ферментов больше, каких меньше выделяется с соком железы, зависит от характера поступающей в желудочно-кишечный тракт пищи.
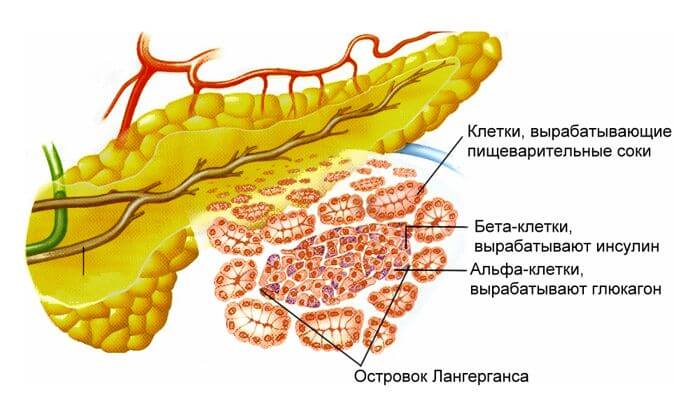
Кроме того железа выполняет работу по снабжению организма инсулином и глюкагоном, обеспечивающими углеводный обмен. Без инсулина глюкоза не могла бы попасть в клетки органов и тканей, лишая их тем самым получения быстрой энергии.

А при недостатке глюкозы в крови глюкагон повышает её содержание, расщепляя гликоген печени. И всё с организмом будет хорошо, пока поджелудочная железа способна беспрепятственно поставлять ферменты впрок. Но происходят и сбои.
По какой причине происходит процесс нарушения выделения секрета
Недостаточность выделительной функции органа может сопровождать человека с рождения (врождённая, наследственная) или приобретаться в процесс жизни. Она может быть первичной и вторичной. Различают также первичную и вторичную дисфункцию.
При первичной патологии имеет место заболевание самого органа:
- Рак.
- Жировая дистрофия и цирроз.
- Обструкция выводящего секрет протока.
- Алкогольная интоксикация.
- Атеросклероз.
- Образование камней в протоках.
- Сахарный диабет.
- Неправильное питание.
- Последствия операции на железе.
При вторичном нарушении функции железа вырабатывает ферменты в достаточном количестве, но они либо не активируются вообще, либо теряют активность впросвете кишечника.
Причины тому:
- Патология со стороны слизистой кишечника.
- Следствие операций на нём и на желудке.
- Калькулёзный холецистит с блокированием камнем выхода желчи в двенадцатиперстную кишку или забросом желчи в проток панкреас, где она и будет преждевременно активировать ферменты.
Когда приходит время для назначения ферментов
На помощь фармацевтическая отрасль приходит, когда необходимо пополнить или полностью заместить недостающие организму ферменты.
Постоянно их принимают при хронических заболеваниях железы, но лишь вне обострения и с соблюдением рекомендаций врача, поскольку чрезмерное, бессистемное их употребление может вообще, заставить железу прекратить выработку гормонов.
Обычно их пьют при тяжести в желудке, испытываемой после еды, при ощущении горечи во рту и неприятной тухлой отрыжке. Рекомендуются они и при плохой переносимости жирной пищи, жареных и копчёных продуктов.
Показанием также является вздутие живота и чередование поноса с запорами. Назначаются препараты и при комплексной терапии воспалительных заболеваний желудка и кишечника для лучшего переваривания пищи.
Классификация ферментов:
- Препараты, выработанные из слизистой желудка, содержащие пепсин. Применяются при сочетании панкреатита с атрофическим гастритом с низкой кислотностью желудочного сока.
- Собственно панкреатические ферменты без добавления желчи, несущие в своём составе амилазу, трипсин, липазу.
- Ферменты, в которые добавлена желчь.
Ферментативные препараты и требования к ним
Наиболее эффективными считаются лекарства, содержащие в себе все ингредиенты, необходимые для полного переваривания пищи. При этом они гарантированно не должны быть токсичными, иметь животное происхождение.
Основной «поставщик» такого материала – свинья, организм которой по строению близок к нашему. Оболочка лекарства должна разрешаться только в щелочной среде, то есть, быть устойчивой по отношению к соляной кислоте.
В количественном отношении препараты должны соответствовать объёму съеденной пищи и количеству ферментов, вырабатываемых здоровой поджелудочной железой. Учитывается при назначении средства и склонность к аллергии пациента на тот или иной ферментативный препарат.
Все препараты производятся на основе панкреатина.
Сразу следует оговориться. При воспалении поджелудочной железы не следует использовать ферменты, в которые добавлена желчь. Железе нужен покой, а эти препараты будут лишь усиливать её функцию.
К тому же их нежелательно принимать при гепатитах, язвенной болезни и других воспалительных заболеваниях желудочно-кишечного тракта. А вот людям здоровым Фестал, Энзистал, Нормоэнзим, другие помогут при погрешностях в питании.
Таблетки с панкреатином, применение
Их назначают для угнетения функции поджелудочной железы, когда имеет место сильная боль в связи с обострением панкреатита. Желчи они не содержат, могут безопасно применяться даже для детей.
Таблетированные препараты эффективнее снимают боль, чем капсулы. Тормозя активность железы, они купируют её отёчность, снижая тем давление в протоках. К этим препаратам относятся: Панкреатин, Мезим форте, Панзикам, другие.
Капсулы панкреатина, применение
Другой случай, когда воспаление железы длится продолжительное время, и она в недостаточной степени вырабатывает ферменты, обеспечивающие переваривание пищи. В таких случаях гормоны в виде лекарства назначаются с целью компенсации недостающих ферментов органа.
И здесь уделяется особое внимание тому, чтобы препараты, не перевариваясь в желудке, попадали вместе с пищей в кишечник, осуществляя свою деятельность там. Для этого и созданы капсульные формы панкреатина, которые начинают перевариваться лишь в двенадцатиперстной кишке. Секрецию ферментов самой железы при этом они не тормозят, способствуя лишь пищеварению, а устранение болевого фактора обеспечит панкреатин.
Среди многочисленных препаратов этой группы можно выделить Креон, Панзинорм, Микразим, другие. Но какой препарат принять в зависимости от недостаточности панкреас может порекомендовать только специалист.
Какие препараты считать лучшими, зависит от проблемы с железой:
| Панкреатин | Принесёт пользу после переедания и при неприятных ощущениях в желудке и кишечнике |
| Панкреазим, Гастал, Мезим | Служат для поддержки функций железы |
| Креон, Нормоэнзим и Дигестал | Решат проблемы, связанные с панкреас и желчным пузырём |
При тяжёлом течении панкреатита, когда собственные ферменты железы начинают переваривать клетки своего органа, применяются так называемые антиферменты или, по-другому, ингибиторы протеолитических ферментов.
Эти лекарства – Контрикал, Гордокс – вводятся внутривенно капельно медленно на физиологическом растворе. К сожалению, примерно в 10% случаях при их использовании отмечается аллергическая реакция. Наиболее тяжёлое осложнение – анафилактический шок.
Диагностика недостаточности поджелудочной железы
Симптомы полиморфны. У одних пациентов пропадает аппетит, и они заметно худеют. Другие, наоборот, страдают полифагией, то есть, неумеренным поглощением пищи.
Но в обоих случаях имеет место недостаточно оформленный стул или понос, который прекратится на фоне голодной диеты. Возможны рвоты. Часто по этим признакам ошибочно начинают подозревать заболевания кишечника. В таких случаях в помощь врачу приходит лаборатория.

Самым надёжным способом определения нарушенной функции панкреас считается оценка теста на ТПИ (трипсиноподобная иммунореактивность). При заболевании концентрация в плазме трипсиногена убывает значительно, что позволяет дифференцированию с заболеваниями тонкого кишечника.
Общий клинический анализ крови при воспалении покажет лейкоцитоз, ускоренную СОЭ (скорость оседания эритроцитов), увеличение количества тромбоцитов, и, не приведи господь, малокровие при раке.
Биохимическая лаборатория даст основания подозревать потерю клеток железы, показывая увеличение амилазы, трипсина, билирубина. Особенно показательно в этом плане будет увеличение амилазы в моче. Фиброз органа можно заподозрить, когда в крови определяется переизбыток глюкозы.
В кале находят картину не переваренных жиров и белков.
Для исключения (подтверждения) онкологии определяются онкомаркеры.
Проводится и ряд других тестовых анализов, которые правильно интерпретировать может только врач.
Но наиболее достоверные результаты дают исследования с помощью зондов. После стимуляции секреции железы секретином и холецистокинином с помощью зонда забирается ряд проб с интервалом в десять минут содержимого двенадцатиперстной кишки. Таким методом исследуется скорость, с которой железа секретирует ферменты. Степень прироста секрета в каждой забранной пробе скажет о состоянии органа.
Ферменты, предоставляемые флорой
Да, растительный мир предоставляет травы, способные стимулировать поджелудочную железу выполнять свои функции и даже повышать секрецию ферментов.
Но не стоит на этот метод очень рассчитывать, поскольку он многажды уступает в эффективности официальной медицине. Во всяком случае, если решили использовать травы, как средство для лечения, посоветуйтесь обязательно с врачом – железу загубить легко, выправить положение проблематично.
Если всё-таки решили рискнуть, из наиболее известных рецептов народных целителей чаще упоминаются спиртовая настойка ноготков, отвар корня лопуха, полынный отвар. Хороший эффект даёт расторопша. Есть рекомендация активировать железу вареньем из одуванчиков.
Источник
