Деструкция ткани поджелудочной железы
 Острый деструктивный панкреатит
Острый деструктивный панкреатитОстрый деструктивный панкреатит представляет собой один из тяжелейших недугов, которые встречаются у человека при расстройствах функционирования поджелудочной.
Панкреатиты представляют собой комплекс недугов, при которых фиксируется появление и развитие острого воспаления в тканях органа, сопровождающееся возникновением деструктивных процессов, связанных с патразрушением структуры и целостности клеток железы. В процессе прогрессирования острого деструктивного панкреатита клеточной мембраны наблюдается заполнение свободного межклеточного пространства ферментами, синтезируемыми клетками поджелудочной, что вызывает самопереваривание тканей.
Общая характеристика и фазы прогрессирования острой деструктивной формы панкреатита
В случае прогрессирования в 15-20% случаев болезнь приобретает деструктивные формы острого панкреатита. При развитии острой формы деструктивного панкреатита смертность составляет до 30% случаев. В случае развития тяжелой формы недуга летальность может достигать 100%.
При остром деструктивном панкреатите максимальная летальность наблюдается в первую, третью и четвертую недели с момента начала развития заболевания в организме. Смерть пациента при остром деструктивном панкреатите на второй неделе прогрессирования недуга фиксируется реже всего. Летальный исход на этой стадии характерен для людей в пожилом возрасте. Неблагоприятный исход на второй неделе течения заболевания может наступить в случае развития недуга у человека с ослабленным организмом.
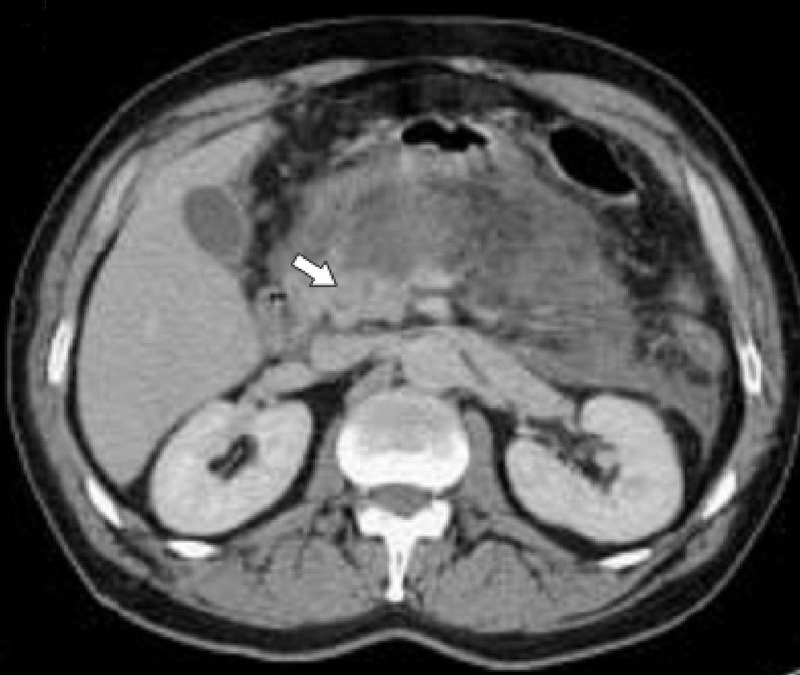
 Компьютерная томография деструктивного панкреатита
Компьютерная томография деструктивного панкреатита
При прогрессировании острой формы деструктивного панкреатита выделяются несколько фаз, для которых характерно проявление определенных изменений в тканях поджелудочной и тканях, окружающих орган.
Фазы заболевания:
- Первая фаза острого деструктивного панкреатита носит название ферментативной. Длительность этой фазы составляет до 3 суток с момента начала развития болезни, при этом наблюдается формирование участков некроза тканей поджелудочной. В конце ферментативной фазы наблюдается светлый промежуток, при котором происходит снижение проявлений симптомов болезни и переход ферментативной фазы в реактивную.
- Вторая фаза острой формы деструктивного панкреатита носит название реактивной, как правило, эта фаза недуга регистрируется со второй недели развития нарушения. Реактивная фаза является промежуточной и носит название фазы перипанкреатического инфильтрата.
- Третья фаза острого деструктивного панкреатита носит название стадии секвестрации. Эта фаза развивается с третьей недели течения болезни.
Третья фаза острого деструктивного панкреатита в своем прогрессировании может иметь 3 типа развития событий.
Первое направление характеризуется процессом рассасывания перипанкреатического инфильтрата и наступлением выздоровления пациента, такое течение недуга наблюдается в 35% случаев выявления болезни.
У 1/3 пациентов, заболевших острым деструктивным панкреатитом, наблюдается прогрессирование асептической секвестрации, которая заключается в осуществлении процесса отторжения некротизированного участка от тканей органа, сохранивших свою жизнеспособность. В случае развития недуга в этом направлении происходит формирование парапанкреатической кисты без нагноений.
У 30-35% пациентов наблюдается прогрессирование септической секвестрации, при которой происходит формирование гнойных и септических осложнений. Этот вариант третьей фазы является наиболее опасным для здоровья и жизни человека.
Причины и симптоматика развития острой формы деструктивного панкреатита
В соответствии с данными, полученными в результате научных исследований, которые проведены в последнее время, основными факторами острого деструктивного панкреатита являются:
- алкогольсодержащие напитки;
- недуги, связанные с нарушениями в работе желчевыводящих путей;
- заражение глистами;
- травмы брюшины;
- интоксикации различного генеза.
 При первых подозрениях на панкреатит пациента следует немедленно госпитализировать
При первых подозрениях на панкреатит пациента следует немедленно госпитализировать
При наличии соответствующего опыта любой медик без особых трудностей способен выявить у пациента прогрессирование острого деструктивного панкреатита. Заболевание легко определяется по наличию триады признаков:
- Сильные боли в области эпигастрия.
- Возникновение регулярных рвотных позывов.
- Сильный метеоризм.
Болевые ощущения чаще всего возникают внезапно и имеют высокую интенсивность и силу, очень часто наблюдаются при употреблении жирной пищи или алкоголя при остром деструктивном панкреатите. Болевые ощущения могут сопровождаться шоком, потерей сознания и частыми рвотными позывами. Частая и изнуряющая рвота ведет к прогрессированию обезвоживания.
Помимо указанных признаков у человека наблюдаются симптоматика, характерная для общей интоксикации – это повышение температуры тела, возникновение озноба, тахикардии, одышки и цианоза слизистых оболочек организма больного.
Особенности ощущаемых болей находятся в полной зависимости от формы недуга и причин его возникновения. Основными особенностями проявлениями болей считаются следующие:
- возникновение дискомфортных ощущений;
- впадение пациента в состояние коллапса;
- развитие острых болей в области эпигастрия;
- появление нестерпимых болевых ощущений.
Возникающая в процессе прогрессирования болезни рвота не приносит облегчения пациенту. Кожные покровы лица при этом приобретают красный оттенок, а при впадении человека в коллапс наблюдается побледнение кожного покрова.
Прогрессирующее заболевание приводит к повышению концентрации эластазы, которая провоцирует запуск процесса разрушения сосудов кровеносной системы, что приводит к возникновению кровотечений в органах, входящих в систему пищеварения.
Методики диагностирования острого деструктивного панкреатита у пациента
Важно! Для того чтобы лечение было максимально эффективным, необходимо оперативно и точно поставить диагноз.
При проведении диагностики заболевания особое внимание следует обращать на пациентов, которые имеют функциональные нарушения в работе поджелудочной.
При первых подозрениях на панкреатит пациента следует немедленно госпитализировать.
Внимание! Сложность заболевания заключается в том, что нарушения, возникающие в организме, способны очень быстро спровоцировать развитие коматозного состояния и других опасных для организма состояний.
Для выявления патологических изменений применяется ультразвуковое обследование пациента, которое позволяет выявить:
- наличие отека поджелудочной;
- прогрессирование некротических процессов;
- неравномерность структуры тканей органа.
 УЗИ брюшной полости позволяет выявить изменения в тканях поджелудочной
УЗИ брюшной полости позволяет выявить изменения в тканях поджелудочной
Помимо УЗИ применяются компьютерная томография и цилиакография.
Наиболее информативным методом обследования является лапароскопия. Применение этого метода позволяет провести дифференциацию диагноза, отличить панкреонекроз от холецистита, прободной язвы и некоторых других острых состояний организма, связанных с нарушениями в работе органов брюшной полости.
Современные методы проведения лечения
Чаще всего пациента госпитализируют с недугом, находящимся на стадии токсемии. Первичный диагноз лечащий врач устанавливает по характерным признакам. В дальнейшем диагноз требуется подтвердить или опровергнуть путем проведения инструментальной диагностики и лабораторных анализов.
Так как недуг способен развиваться непредсказуемо, то врач, занимающийся лечением, должен быть готов к развитию заболевания по любому сценарию. Лечебные мероприятия должны быть направлены на инактивирование ферментов, которые продуцируются поджелудочной. В процессе проведения лечебных мероприятий большое внимание следует уделить нормализации оттока секрета поджелудочной и очистке ее от образующихся токсичных соединений. Большое внимание в процессе лечения следует уделить купированию болевых ощущений.
Важно! Для пациента следует обеспечить голодание и полный эмоциональный покой.
 Наиболее информативным методом обследования является лапароскопия
Наиболее информативным методом обследования является лапароскопия
В процессе проведения лечебных процедур осуществляется промывание желудка при помощи холодной воды. Для этой цели используется зонд.
При осуществлении лечения проводится детоксикация. Это состояние достигается путем введения в организм мочегонных препаратов.
При правильном проведении лечебных процедур фаза токсемии завершается выздоровлением больного. В редких случаях она способна перерасти в фазу гнойных осложнений. При таком варианте течения болезни проводится хирургическое вмешательство, которое предполагает удаление пораженных участков органа.
Источник
Комментарии
Опубликовано в журнале:
Русский медицинский журнал. Том 13, № 27, 2005
Ю.В. Лузганов, Н.Е. Островская, В. А. Ягубова, К.С. Шкиря
Главный клинический госпиталь МВД РФ, Москва
В настоящее время в структуре экстренной хирургической патологии отмечается тенденция к росту количества острых панкреатитов, в том числе деструктивных и осложненных форм. Острый панкреатит является наиболее тяжелой и материально затратной патологией экстренной хирургии. Воспалительный и некротический процессы варьируют от интерстициального панкреатита до развития осложненных форм стерильного и инфицированного панкреонекроза.
Инфицированный панкреонекроз является наиболее грозным осложнением данной патологии, летальность при которой достигает 40% [Б.Р. Гельфанд, Ф.И. Филимонов, 2002 г.]. Деструктивные формы панкреатита развиваются у 30% больных с воспалением поджелудочной железы [В.К. Гостищев, В.А. Глушко, 2003 г.]. Панкреонекроз при присоединении инфекции является субстратом для развития гнойных осложнений, таких как панкреатогенный абсцесс, флегмона забрюшинного пространства, гнойный перитонит. Несмотря на распространенность заболевания, в тактике лечения до настоящего времени остается много спорных вопросов: отсутствует единая концепция к показаниям и объему оперативного лечения, нет общепринятых схем консервативной терапии.
Материалы и методы
За период с января 2002 г. по декабрь 2004 г. в Главном клиническом госпитале МВД РФ проходило лечение 89 пациентов с различными формами панкреатитов. Средний возраст составил 34 года, большая часть пациентов – мужчины – (84%), женщин – 16%.
При поступлении в стационар всем пациентам выполнялись следующие исследования:
- α-панкреатография с внутривенным контрастированием с использованием КТ – в 1-е и 5-е сутки. Оценивались размеры поджелудочной железы, степень изменения перфузии и глубина поражения ткани, состояние парапанкреатической клетчатки, наличие жидкости в плевральных полостях, наличие и топика жидкостных коллекторов в свободной брюшной полости.
Вероятность инфицирования оценивали по снижению эхогенности сигнала и плотности жидкости в жидкостных образованиях. - Динамическое УЗИ брюшной полости (также с первых суток) выполнялось для оценки состояния органов брюшной полости и своевременного выявления билиарной гипертензии, установления размеров поджелудочной железы и ее структурных изменений.
Лабораторная диагностика не имеет строгой специфичности для верификации стадии заболевания. Как указывает M. Sashi: «Если в будущем кто-то предложит систему, способную по одному или нескольким лабораторным показателям различать отечную и некротическую формы острого панкреатита, это будет означать решение проблемы классификации». Тем не менее в первые 48 ч от начала заболевания, проводится строгий лабораторный мониторинг специфичных для данной патологии показателей: амилаза крови; диастаза мочи; лейкоциты, формула; билирубин и его фракции; трансаминазы; гемоглобин, гематокрит; глюкоза крови, общий белок, фракции; электролиты. Единственным объективным критерием уровня поражения поджелудочной железы являлись данные компьютерной томографии.
Предложено много классификаций острого панкреатита, отражающих анамнестические данные, морфологические изменения поджелудочной железы и парапанкреатической клетчатки, уровень метаболизма, степень компенсации сердечно-сосудистой и респираторной систем организма.
В основу классификации больных с острым панкреатитом мы положили морфологические изменения поджелудочной железы и наличие осложнений. По данному принципу пациенты были разделены на три группы:
- Интерстициальный панкреатит – 41%.
- Деструктивный – 38%:
– асептический неосложненный панкреонекроз – 23%;
– асептический осложненный панкреонекроз (панкреатогенный перитонит, реактивный плеврит, парапанкреатит) – 15%. - Инфицированный панкреонекроз – 21%.
Данная классификация была положена в основу принципов терапии и определила различную тактику лечения пациентов вышеперечисленных групп.
Интерстициальный панкреатит
Клиническая картина характеризовалась острым началом, длительностью от начала заболевания 24-48 ч, триадой Мондора (болевой синдром, рвота, метеоризм), нарушениями гемодинамики: артериальной гипертензией, тахикардией. Лабораторно отмечалась гемоконцентрация, лейкоцитоз без сдвига лейкоцитарной формулы влево, повышение амилазы крови и диастазы мочи, электролитных нарушений отмечено не было, уровни билирубина, креатинина, азота мочевины были в пределах нормы, уровень трансаминаз повышен в 2-3 раза.
По данным КТ в первые сутки: отмечены отек и увеличение размеров поджелудочной железы (15-30%) без признаков деструкции ткани железы и парапанкреатической клетчатки, отсутствие жидкостных коллекторов в свободной брюшной полости и жидкости в плевральных полостях. По данным УЗИ были увеличены размеры головки, тела и хвоста поджелудочной железы, отмечался отек парапанкреатической клетчатки, признаки билиарной гипертензии отсутствовали.
Деструктивный панкреатит
Асептический мелкоочаговый неосложненный: Отличался появлением очагов деструкции ткани поджелудочной железы.
Клинически отмечалось острое начало, длительность заболевания более 48 ч, триада Мондора, артериальная гипертензия, тахикардия, гипертермия преимущественно гектического характера. Лабораторные показатели характеризовались наличием гемоконцентрации, лейкоцитозом с умеренным сдвигом лейкоцитарной формулы влево, повышением амилаземии, диастазурии, при этом уровень билирубина, азотистых шлаков, электролитов оставался в пределах нормы.
По данным КТ в первые сутки также отмечалось увеличение размеров поджелудочной железы, отек и инфильтрация парапанкреатической клетчатки, существенных скоплений жидкости в забрюшинной клетчатке, брюшной полости не выявлялось, жидкости в плевральных полостях не отмечено. По данным УЗИ наблюдалась картина острого деструктивного панкреатита с очагами деструкции преимущественно в области головки и (или) тела поджелудочной железы. Признаков билиарной гипертензии нет.
Асептический мелкоочаговый осложненный панкреонекроз: сопровождался присоединением реактивных изменений в брюшной и плевральной полостях, парапанкреатической клетчатке. (панкреатогенный перитонит, реактивный плеврит, парапанкреатит). Клиническая картина характеризовалась длительностью от начала заболевания более 48-72ч, наличием триады Мондора, изменениями гемодинамики: артериальной гипотензией, тахикардией. Лабораторно отмечалась анемия, лейкоцитоз с умеренным палочкоядерным сдвигом лейкоцитарной формулы влево, амилаземия, диастазурия, азотистые шлаки и электролиты оставались в пределах нормы, уровень билирубина был повышен за счет прямой фракции.
Также были отмечены: гипопротеинемия и повышение уровня трансаминаз (АСТ, АЛТ).
По данным КТ наблюдалась картина очагового инфильтративно-некротического панкреатита без признаков секвестрации фрагментов железы, одностороннее уплотнение фасции Герота в зависимости от локализации очагов поражения, расширение Вирсунгова протока. Определялись жидкостные коллекторы в парапанкреатической клетчатке, брюшной полости (преимущественно в сальниковой сумке), реактивный правосторонний плеврит. Масштаб деструктивных изменений 30-50%.
По данным УЗИ прослеживалась картина острого деструктивного панкреатита с диффузными изменениями поджелудочной железы, с наличием локальных деструктивных очагов, признаков билиарной гипертензии.
Инфицированный крупноочаговый панкреонекроз
Определялся наличием гнойного воспаления ткани железы и внепанкреатических жидкостных коллекторов.
Для данной формы заболевания были характерны: длительность от начала заболевания более 72 ч, наличие триады Мондора, гипертермия гектического характера, изменения гемодинамических показателей: (артериальная гипотензия, тахикардия). Лабораторно отмечались: анемия, лейкоцитоз с выраженным палочко-ядерным сдвигом лейкоцитарной формулы влево, амилаземия, диастазурия снижены, гиперкалиемия, повышение уровня билирубина за счет прямой и непрямой фракций, повышение уровня азотистых шлаков (креатинина, азота мочевины), повышение уровня трансаминаз (АСТ, АЛТ).
По данным КТ отмечались: неоднородность структуры поджелудочной железы с повышенной эхогенностью, отек, инфильтрация самой железы и парапанкреатической клетчатки, наличие некротических очагов в ткани железы (масштаб некротических изменений более 50%). Определялась жидкость в сальниковой сумке, жидкостные коллекторы в свободной брюшной полости повышенной плотности, наличие жидкости в плевральных полостях. При УЗИ визуализировались неоднородность структуры поджелудочной железы, жидкостные образования в проекции головки, тела и хвоста поджелудочной железы сниженной эхогенности, наличие билиарной гипертензии, жидкость в свободной брюшной полости, плевральных полостях.
Лечение
Базовая терапия при всех формах панкреатитов включала в себя: полное парентеральное питание с применением высококонцентрированных растворов глюкозы (20-40%), растворов аминокислот и жировых эмульсий, дипептивена. Интенсивная внутривенная инфузионная терапия и внутриартериальная в селективно установленные катетеры в чревный ствол. Активно применялись экстракорпоральные методы детоксикации: плазмаферез со 100%-ным плазмазамещением. На ранних этапах лечения, при высокой секреторной активности поджелудочной железы, с целью фармакологической блокады ее экзокринной функции использовались синтетические аналоги соматотропного гормона: октреотид, сандостатин в дозировках от 0,6 до 1,2 г. в сутки. Комбинированная антисекреторная терапия включала инфузию 80 мг в сутки омепразола (Лосек ВВ), что положительно сказывалось на сокращении желудочной секреции, одновременно защищая пациента от развития стресс-повреждений желудка.
В крайне тяжелых случаях при развитии РДСВ больные переводились на искусственную вентиляцию легких.
При осложненных формах панкреонекроза необходимо своевременное проведение оперативного лечения с максимально возможным использованием лапароскопической технологии.
При наличии гнойных осложнений до получения результатов микробиологического исследования антибактериальная терапия проводилась по принципам деэскалационной терапии карбапенемами, с последующим переходом к антибиотикам более узкого спектра действия в зависимости от результатов чувствительности микрофлоры. Обязательным являлось использование противогрибковых препаратов (флуконазол 400 мг в сутки).
Одним из важнейших составляющих комплексной терапии пациентов с острым панкреатитом является адекватное купирование болевого синдрома, так как некупируемый болевой синдром запускает каскад патофизиологических реакций, ускоряющих в итоге развитие полиорганной недостаточности. Учитывая, с одной стороны, неэффективность метамизол-содержащих анальгетиков, а с другой – усугубление пареза кишечника под действием наркотических анальгетиков, методом выбора стала продленная эпидуральная аналгезия.
Мы использовали следующую методику: после ка-тертеризации эпидурального пространства болюсно вводился 1% ропивакаин 6-8 мл, затем подключался ропивакаин 0,2%, 100 мл со скоростью 6-12 мл в час при помощи инфузомата. Постоянная эпидуральная аналгезия проводилась от 3 до 7 суток и имела следующие преимущества:
- достаточный уровень аналгезии с хорошей управляемостью в зависимости от скорости введения;
- отсутствие гемодинамических расстройств, ортостатических реакций, резорбтивного эффекта;
- хороший мышечный тонус в сочетании с достаточным уровнем аналгезии позволял проводить раннюю активизацию больных.
При интерстициальном панкреатите мы ограничивались проведением инфузионной терапии, без парентерального питания. Объем инфузии: 45-50 мл/кг/сут. Кристаллоидных растворов 52%, коллоидных – 44%, белковых препаратов (альбумин 20%) – 4%. С целью подавления секреторной функции поджелудочной железы использовались октреотид или сандостатин: в течение первых двух дней в дозировке 0,6 мг/сут. подкожно. При снижении уровня амилазы крови, диастазы мочи, уменьшении лейкоцитоза в последующие трое суток дозировка октреотида уменьшалась до 0,3 мг/сут. Во избежание «синдрома отмены» до 9 суток от начала, заболевания препарат вводился 0,2 мг/сут.
Длительная эпидуральная аналгезия проводилась ропивакаином 0,2% со скоростью 6-12 мл/ч до 7 суток.
При асептических мелкоочаговых неосложненных формах деструктивного панкреатита: с первых суток проводилось парентеральное питание с использованием концентрированных растворов глюкозы, растворов аминокислот и жировых эмульсий (Липовеноз, Интралипид 10%, 20%). Объем инфузионной терапии – 50 мл/кг/сут. Кристаллоидных р-ров 48%, коллоидных – 48%, белковых р-ров 4-6%. Октреотид применяли по 0,6 мг в течение 3-5 суток. Затем при нормализации показателей амилазы крови, диастазы мочи дозировка снижалась до 0,3 мг/сут. в течение 7-10 суток. При имеющейся энзимной токсемии в условиях повышенной сосудистой проницаемости, использовался ингибитор протеаз (апротинин 400-800 тыс. в сутки) в течение 5-7 дней.
Всем больным проводилась эпидуральная аналгезия ропивакаином 0,2% в течение 7 суток в вышеуказанных дозировках. В течение первых 2-3 суток на фоне выраженного пареза кишечника дважды в сутки через назогастральный зонд эвакуировалось желудочное содержимое в объеме от 600 мл до1800 мл.
В этой связи мы считаем нецелесообразным в ранние сроки постановку назоеюнального зонда для проведения энтерального питания, так как наличие инородного тела в желудке провоцирует желудочную секрецию.
При осложненных формах мелкоочагового панкреонекроза: выполнялась лапароскопическая дренирующая операция – холецистостомия с целью декомпрессии желчевыводящих путей, наложение оментобурсостомы, дренирование брюшной полости. В первые сутки селективно катетеризировалась аорта (чревный ствол) для проведения инфузионной и антибактериальной терапии. Плазмаферез со 100%-ным плазмазамещением проводился в 1-3 сутки. С первых суток применялось парентеральное питание. Объем инфузионной терапии 50-55 мл/кг/сут. Октреотид вводился в максимальных дозировках 1,2 мг /су-т. внутривенно в течение 3-5 суток. Комбинированная антибактериальная терапия включала в себя цефалоспорины 3 поколения в максимальных (до 8 г в сутки) дозировках в комбинации с аминогликозидами и метронидазолом. Вспомогательным методом терапии острого панкреатита (интерстициальной и деструктивных асептических форм) являлась гипербарическая оксигенация, проводимая со 2-х суток пребывания больного в отделении реанимации ежедневно в течение 5-7 дней.
При инфицированном панкреонекрозе: Выполнялись лапаротомия, холецистостомия, оментобурсостомия, некрсеквестрэктомия, дренирование брюшной полости и забрюшинного пространства. Программные санационные операции с некрсеквестрэктомией. Селективная катетеризация чревного ствола. Плазмаферез с 100% плазмазамещением в 1-3-5-е сутки. Обязательная продленная эпидуральная аналгезия 0,2% ропивакаином. Объем инфузионной терапии варьировал от 50 до 60 мл/кг/сут. Октреотид (сандостатин) – в максимальных дозировках 1,2 г внутриаортально в течение 5-7 суток со снижением дозировки до 0,6-0,3 г/сут. в течение 10-12 дней. Критериями отмены препарата являлись нормализация ферментемии, диастазурии, клинической картины заболевания и динамические изменения состояния поджелудочной железы и парапанкреатической клетчатки по данным компьютерной томографии. До получения результатов микробиологического исследования стартовая эмпирическая антибактериальная терапия проводилась карбапенемами (меропенем) 3 г/сут., в комбинации с ванкомицином 2 г/сут. Переход к антибиотикам узкого спектра действия проводился в зависимости от результатов чувствительности микрофлоры.
Выводы
- Наиболее достоверным методом определения степени тяжести острого панкреатита является КТ.
- Предложенная классификация позволяет стандартизировать лечение различных форм острого панкреатита.
- Стандартизированный подход к терапии позволяет своевременно оценить степень повреждения ПЖ и корректировать развивающиеся осложнения.
Системный подход к лечению острых панкреатитов позволил в 2002-2004 гг. избежать летальных исходов в группах неинфицированного панкреонекроза, а при формировании флегмоны забрюшинной клетчатки летальность не превысила 10%.
Литература
- Гостищев В.К., Глушко В А.. «Панкреонекроз и его осложнений, основные принципы хирургической тактики». Хирургия 3, 2003.
- Филимонов М.И., Гельфанд Б.Р., Бурневич С.З., Орлов Б.Б., Цыденжапов Е.Ц. Острый панкреатит. Москва 2002 г.
- Филимонов М.И., Гельфанд Б.Р., Бурневич С.З., Орлов Б.Б., Саганов В.П. «Опыт применения Октреотида при деструктивном панкреатите». Опыт клинического применения Октреотида. Москва. 2002 г.
- Sashi M., Ercke A. Klassifikationen der Acuten Pankreatitis aus Chirurgieher Sicht, Art Chir. 1993Г-28, 3, 95.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
