Бета клетки островков лангерганса поджелудочной железы

Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 апреля 2020; проверки требуют 3 правки.
Островки Лангерга́нса — скопления гормон-продуцирующих (эндокринных) клеток, преимущественно в хвостовой части поджелудочной железы. Открыты в 1869 году немецким патологоанатомом Паулем Лангергансом (1849—1888). Островки составляют приблизительно 1—2 % массы поджелудочной железы. Поджелудочная железа взрослого здорового человека насчитывает около 1 миллиона островков (общей массой от одного до полутора граммов), которые объединяют понятием орган эндокринной системы.
Историческая справка[править | править код]
Пауль Лангерганс, будучи студентом-медиком, работая у Рудольфа Вирхова, в 1869 году описал скопления клеток в поджелудочной железе, отличавшиеся от окружающей ткани, названные впоследствии его именем[2][3]. В 1881 году К. П. Улезко-Строганова впервые указала на эндокринную роль этих клеток[4]. Инкреаторная функция поджелудочной железы была доказана в Страсбурге (Германия) в клинике крупнейшего диабетолога Наунина Mering и Minkowski в 1889 году — открыт панкреатический диабет и впервые доказана роль поджелудочной железы в его патогенезе[3]. Русский учёный Л. В. Соболев (1876—1919) в диссертации «К морфологии поджелудочной железы при перевязке её протока при диабете и некоторых других условиях» показал, что перевязка выводного протока поджелудочной железы приводит ацинозный (экзокринный) отдел к полной атрофии, тогда как панкреатические островки остаются нетронутыми. На основании опытов Л. В. Соболев пришёл к выводу: «функцией панкреатических островков является регуляция углеводного обмена в организме. Гибель панкреатических островков и выпадение этой функции вызывает болезненное состояние — сахарное мочеизнурение»[3].
В дальнейшем благодаря ряду исследований, проведенных физиологами и патофизиологами в различных странах (проведение панкреатэктомии, получение избирательного некроза бета-клеток поджелудочной железы химическим соединением аллоксаном), получены новые сведения об инкреаторной функции поджелудочной железы.
В 1907 году Lane & Bersley (Чикагский университет) показали различие между двумя видами островковых клеток, которые они назвали тип A (альфа-клетки) и тип B (бета-клетки).
В 1909 году бельгийский исследователь Ян де Мейер предложил называть продукт секреции бета-клеток островков Лангерганса инсулином (от лат. insula — островок). Однако прямых доказательств продукции гормона, влияющего на углеводный обмен, обнаружить не удавалось[3].
В 1921 году в лаборатории физиологии профессора J. Macleod в Торонтском университете молодому канадскому хирургу Фредерику Бантингу и его ассистенту студенту-медику Чарлзу Бесту удалось выделить инсулин.
В 1955 году Сангеру и соавторам (Кембридж) удалось определить последовательность аминокислот и строение молекулы инсулина[3].
В 1962 году Марлин и соавторы обнаружили, что водные экстракты поджелудочной железы способны повышать гликемию. Вещество, вызывающее гипергликемию, назвали «гипергликемическим-гликогенолитическим фактором». Это был глюкагон — один из основных физиологических антагонистов инсулина[3].
В 1967 году Донатану Стейнеру и соавторам (Чикагский университет) удалось обнаружить белок-предшественник инсулина — проинсулин. Они показали, что синтез инсулина бета клетками начинается с образования молекулы проинсулина, от которой в последующем по мере необходимости отщепляется С-пептид и молекула инсулина[3].
В 1973 году Джоном Энсиком (Вашингтонский университет), а также рядом учёных Америки и Европы была проведена работа по очистке и синтезу глюкагона и соматостатина[3].
В 1976 году Gudworth & Bottaggo открыли генетический дефект молекулы инсулина, обнаружив два типа гормона: нормальный и аномальный. последний является антагонистом по отношению к нормальному инсулину[3].
В 1979 году благодаря исследованиям Lacy & Kemp и соавторов появилась возможность пересадки отдельных островков и бета-клеток, удалось отделить островки от экзокринной части поджелудочной железы и осуществить трансплантацию в эксперименте. В 1979—1980 гг. при трансплантации бета-клеток преодолён видоспецифический барьер (клетки здоровых лабораторных животных имплантированы больным животным другого вида)[3].
В 1990 году впервые выполнена пересадка панкреатических островковых клеток больному сахарным диабетом[3].
Типы клеток[править | править код]
Данная диаграмма демонстрирует структурные отличия между панкреатическими островками крысы (вверху) и человека (внизу) pars ventralis pancreas (брюшная часть) — слева; pars dorsalis pancreas (спинная часть) — справа. Различные типы клеток окрашены по-разному: альфа-клетки — красным, бета-клетки — синим, дельта-клетки — фиолетовым, ПП-клетки — зелёным, эпсилон-клетки — жёлтым. Бета-клетки грызуна, в отличие от человека сгруппированы в характерное инсулиновое ядро.
Альфа-клетки[править | править код]
- Альфа-клетки составляют 15…20 % пула островковых клеток — секретируют глюкагон (естественный антагонист инсулина).
Бета-клетки[править | править код]
- Бета-клетки составляют 75…80 % пула островковых клеток — секретируют инсулин (с помощью белков-рецепторов проводит глюкозу внутрь клеток организма, активизирует синтез гликогена в печени и мышцах, угнетает глюконеогенез).
Дельта-клетки[править | править код]
- Дельта-клетки составляют 3…10 % пула островковых клеток — секретируют соматостатин (угнетает секрецию многих желез);
ПП-клетки[править | править код]
- ПП-клетки составляют 3…5 % пула островковых клеток — секретируют панкреатический полипептид (подавляет секрецию поджелудочной железы и стимулирует секрецию желудочного сока).
Эпсилон-клетки[править | править код]
- Эпсилон-клетки составляют <1 % пула островковых клеток — секретируют грелин[5][6] («гормон голода» — возбуждает аппетит).
Строение островка[править | править код]
Панкреатический островок является сложно устроенным функциональным микроорганом с определённым размером, формой и характерным распределением эндокринных клеток. Клеточная архитектура островка влияет на межклеточное соединение и паракринную регуляцию, синхронизирует высвобождение инсулина.
Долгое время считалось, что островки человека и экспериментальных животных сходны как по строению, так и по клеточному составу. Работы последнего десятилетия показали, что у взрослых людей преобладающим типом строения островков является мозаичный, при котором клетки всех типов перемешаны по всему островку, в отличие от грызунов, для которых характерен плащевой тип строения клеток, при котором бета-клетки формируют сердцевину, а альфа-клетки находятся на периферии. Однако, эндокринная часть поджелудочной железы имеет несколько типов организации: это могут быть единичные эндокринные клетки, их небольшие скопления, небольшие островки (диаметром < 100 мкм) и крупные (зрелые) островки.
Небольшие островки имеют у человека и грызунов одинаковое строение. Зрелые островки Лангерганса человека обладают выраженной упорядоченной структурой. В составе такого островка, окруженного соединительнотканной оболочкой, можно выявить дольки, ограниченные кровеносными капиллярами. Сердцевину долек составляет массив бета-клеток, на периферии долек в непосредственной близости с кровеносными капиллярами находятся альфа- и дельта-клетки. Таким образом, клеточная композиция островка зависит от его размера: относительное число альфа-клеток увеличивается вместе с размером островка, в то время как относительное число бета-клеток уменьшается[7].
См. также[править | править код]
Примечания[править | править код]
- ↑ 1 2 Foundational Model of Anatomy
- ↑ Langerhans P. Beiträge zur mikroskopischen Anatomie der Bauchspeicheldrüse : Inaugural-Dissertation, zur Erlangung der Doctorwürde in der Medicine und Chirurgie vorgelegt der Medicinischen Facultät der Friedrich-Wilhelms-Universität zu Berlin und öffentlich zu vertheidigen am 18. Februar 1869 (нем.). — Berlin: Buchdruckerei von Gustav Lange, 1869.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Клиническая диабетология / Ефимов А. С., Скробонская Н. А. — 1-е изд. — К.: Здоровья, 1998. — 320 с. — 3000 экз. — ISBN 5-311-00917-9.
- ↑ Жуковский М. А. Детская эндокринология. — 3-е изд. — М.: Медицина, 1995. — 656 с. — 8000 экз. — ISBN 5-225-01167-5.
- ↑ K. M. Andralojc, A. Mercalli, K. W. Nowak. et al. Ghrelin-producing epsilon cells in the developing and adult human pancreas (англ.). (недоступная ссылка)
- ↑ Epsilon cells (Cytokines&Cells Encyclopedia) (англ.). Архивировано 26 октября 2012 года.
- ↑ Прощина А. Е., Савельев С. В. Иммуногистохимическое исследование распределения α- и β-клеток в разных типах островков Лангерганса поджелудочной железы человека // Бюллетень экспериментальной биологии и медицины. — Изд. РАМН, 2013. — Т. 155, № 6. — С. 763—767. Архивировано 25 ноября 2015 года.
Ссылки[править | править код]
Источник
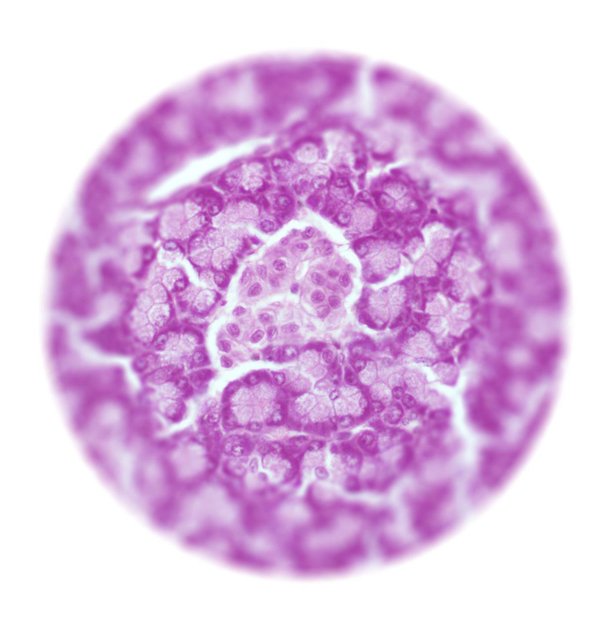 Островок Лангерганса под микроскопом
Островок Лангерганса под микроскопом1. Что такое островки Лангерганса?
В хвосте поджелудочной железы человека, словно островки в океане, разбросаны крошечные скопления особых клеток. Эти скопления и выглядят как островки, и названы так — островки Лангерганса, по имени берлинского врача, рассмотревшего их под микроскопом полтора века назад. По слогам: Лан-гер-гáнс.
Общая масса островков Лангерганса — около грамма, но это важнейший эндокринный орган, секретирующий пять жизненно необходимых гормонов, среди которых — инсулин. Insula, в переводе с латыни, означает «остров»; молекулы инсулина можно вообразить как островитян с тех самых островков Лангерганса.
Отправляясь в путь по организму, «островитяне» эти с Божественной точностью регулируют концентрацию глюкозы в крови, а глюкоза питает клетки тканей; она — основной источник энергии всех живых существ на Земле. Без инсулина глюкоза не будет усвоена, а не будучи усвоенной, в излишке, станет ядом.
2. Что происходит, когда инсулина нет
Инсулин отворяет клеточные мембраны, глюкоза проникает в клетки и потребляется ими, её уровень в крови снижается до нормы. При недостатке же инсулина мембраны прикрыты, ткани голодают, а неиспользованная глюкоза в крови собирается до критического уровня и, вместе с образующимся ацетоном, разрушает организм.
Представьте себе, что островки Лангерганса вдруг стали необитаемыми. Бета-клетки, продуцирующие инсулин, почему-то погибли, «островитян» не стало. Это смертельная ситуация, у больного есть несколько дней, возможно, неделя. Но около 20 тыс. человек в Беларуси и до 20 млн. в мире держатся годами. Как?
Оказывается, если нет своего инсулина, можно вколоть чужой. Но сколько? Введёшь мало → гипергликемия → нарастающий подрыв нервов и сосудов, повреждение зрения, почечная недостаточность; введёшь много или промажешь, уколóв вместо подкожной прослойки в мышцу → стремительная гипогликемия, кома…
Гипергликемия — избыток глюкозы в крови; гипогликемия — её недостаток. Оба состояния потенциально летальны. Между ними — норма — жизнь продолжается. Помните типичный, стрессующий зрителя, момент в фильмах, когда герой, обезвреживая мину, должен выбрать между двумя проводами — красным и синим?
Человек, у которого отказали островки Лангерганса, перманентно, днём и ночью, пребывает в таком стрессе — ошибиться нельзя! Но если герой в фильме, выбирая провод, просто гадает и ему везёт, то наш герой, дозируя инсулин, должен не гадать, а быстро (счёт на минуты) решать уравнения с несколькими переменными.
Многие из нас, зевая на уроках математики, думали: вряд ли это мне когда-то пригодится. А кому-то, вот, математика не просто пригодилась, а стала необходима, чтобы не умереть. И зевать не получится. И урок не прогулять. И «двойка в журнал» равнозначна приговору. Всегда у доски. Считай, считай… Чтобы жить.
3. Сложности контроля

Проблема ещё в том, что почти все заболевшие — дети. За них считают родители. Несколько дней могут посчитать врачи — больше не положено, учись сам. Какие-то моменты можно облегчить с помощью приложений/программ, приборов и систем, если хватает средств на их покупку (об этом ниже).
Божественная точность здорового углеводного обмена — не преувеличение. Наука, имея в распоряжении суперкомпьютеры, искусственный интеллект, миллиардные бюджеты, пока не может воспроизвести естественные алгоритмы подачи инсулина. Имеющиеся знания — уровень спасающего костыля.
Инсулин — самый исследованный гормон. Инсулинотерапии скоро 100 лет. Однако без подсчётов «вручную» всё ещё не обойтись. Говорят, есть уже квантовый телефон. Но нет пока гаджета, который повторил бы автоматически инсулин-продуцирующую функцию поджелудочной железы. А что же есть?
4. Технологии контроля и компенсации
Из продвинутого и дорогого:
1) системы непрерывного мониторинга уровня глюкозы с подкожным сенсором;
2) системы подачи инсулина частыми микродозами с подкожным катетером;
3) прототипы, интегрирующие обе системы под претенциозным и некорректным названием «искуственная поджелудочная железа».
Из доступного:
1) глюкометры с тест-полосками и ланцетами для забора крови;
2) обычные шприцы и слегка упрощающие инъекцию шприцы-ручки с ампулами инсулина.
Поёживаетесь, думая об анализе крови из пальца и об уколах в живот? А для кого-то это обыденность, многократный в течение суток ритуал.
Пальцы прокалывать приходится часто: перед каждым приёмом пищи и после, на ночь, ночью — выходит раз 10. Это минимум, если «сахарá» «послушные». Но при физических и умственных нагрузках, в пубертате и при простуде расход глюкозы предсказать трудно, поэтому количество замеров может удвоиться.
5.Почему людей с диабетом называют “сладкими”?
10 анализов в сутки, 20… Исколотые подушечки постепенно теряют чувствительность. «Сладкие» люди говорят, что уже не больно. Инъекции — больнее, но терпимо. Потерпеть надо 6-8 раз в сутки. Подкожная жировая клетчатка в местах травмирования может грубеть, деформироваться, это называется липодистрофией.
Почему эти люди «сладкие»? Потому что болезнь их по симптому — повышенному «сахару» в крови и моче — называется сахарным диабетом или, с латыни — диабетом медовым (diabetes mellītus). «Диабайно» — греческое слово, означает «протекаю», «прохожу сквозь». Что имели ввиду греки?
Согласно древним представлениям, сквозь диабетика без задержки протекала любая жидкость. Сколько бы он ни выпил — всё тут же выходило с мочой (полиурия), несчастного изнуряла неутолимая жажда. Если моча была сладкой — диабет сахарный, несладкой — несахарный (например, несахарный почечный).

6. Сколько у диабета обличий?
Несахарных диабетов — пять. Сахарных — тоже пять, они собраны в два типа: 1-го типа (T1D) — разрушены β-клетки поджелудочной железы, не продуцируется инсулин; 2-го типа (T2D) — инсулин продуцируется, но мембраны клеток в тканях воспринимают его ограниченно, сопротивляются (инсулинорезистентность).
Сахарный диабет 2-го типа ассоциирован с ожирением, злоупотреблением рафинированными продуктами, малоподвижным образом жизни; его называют бичом современности. А бичом для диабетиков 1-го типа является перенос на них представлений о причинах возникновения заболевания с диабетиков 2-го типа.
Между тем, природа T1D и T2D крайне разная. T1D — заболевание аутоимунное с преимущественно неясной этиологией, неизвестно, как его избегать; T2D — заболевание метаболическое с в основном понятной этиологией, как его избегать — известно.
7. Почему инсулинопродуцирующие клетки гибнут?
Почему же гибнут инсулоциты (β-клетки) в островках Лангерганса? Их, «сойдя с ума», атакует иммунная система. С высокой вероятностью, триггерами этого сбоя, на фоне генетической предрасположенности, являются факторы окружающей среды: вирусы, токсины. Отмечена статистическая связь T1D с питанием грудных детей продуктами из коровьего молока.
Обобщение T1D и T2D в бытовом восприятии — досаждающая проблема для людей с T1D, ведь T2D — обычно, болезнь образа жизни, её профилактика — здоровое питание/ЗОЖ. А профилактики T1D не существует, это фатальное стечение неразгаданных причин.
Приходится терпеть негативные намёки, укоры, объяснять и даже оправдываться.
Можно ли предотвратить T1D? Скорее нет, чем да. Аутоимунные болезни запускаются в неизвестный момент неизвестной комбинацией нескольких «кнопок»: например, «стресс + грипп + молоко», «токсин + наследственность + антибиотик», «вакцина + витамины + беременность» и другие гипотетические варианты.
Обойдя защиту, «хакер» может и не вскрыться, а затаиться на годы, перейти потомству. Больные и их близкие, озираясь назад, отматывая события, вдумываясь, копаясь в происшедшем, предполагают, догадываться о чём-то, но их выводы, как и гипотезы исследователей, просто подвергнуть сомнению.
Однако известны агенты, которые, попав в организм, точно разрушат β-клетки и вызовут T1D. Например, лекарственные препараты стрептозоцин, пентамидин, крысиные яды пиринурон, пириминил, вакор. Их опасность доказана, но производство и использование в некоторых странах продолжается!
Можно ли излечить T1D? Нет. Бета-клетки в островках Лангерганса не воскресить. Но чем качественнее компенсация инсулином извне, тем дольше можно протянуть. Медаль «Victory» вручается прожившим с диагнозом 50 лет (4 тыс. человек в мире), 75 лет (65 человек), 80 лет (один человек).
Источник
