Белок ферментами желудочного сока и поджелудочной железы разлагаются до
Оглавление по разделу: «Ответы на вопросы по биохимии»
Навигация
Биологическая роль и структура белков.
Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот.
Все природные белки состоят из небольшого числа
сравнительно простых структурных блоков, представленных мономерными молекулами
– аминокислотами, связанными друг с другом в полипептидные цепи.
Функции белков:
1) Структурная:
- в соединительной ткани – коллаген, эластин, кератин
- построение мембран и формирование цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности)
- построение органелл – рибосомы
2) Ферментативная:
Все ферменты являются белками
3) Гормональная:
Регуляция и согласование обмена
веществ в разных клетках организма – многие гормо-ны, например, инсулин и
глюкагон.
4) Рецепторная:
Избирательное связывание гормонов,
биологически активных веществ и медиаторов на поверхности мембран или внутри
клеток.
5) Транспортная:
Перенос веществ в крови – липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа) или через мембраны – Na+,К+-АТФаза (противоположный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки).
6) Резервная: производство и
накопление в яйце яичного альбумина.
7) Питательная: белки грудного
молока, белки мышц и печени при голодании.
8) Защитная: наличие в крови иммуноглобулинов, белков свертывания крови.
Переваривание белков в желудке: ферменты, система их активации, оптимум pH, специфичность, продукты переваривания.
В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, которые упрощенно называют пепсин и гастриксин. У грудных детей основным ферментом является реннин.
Регуляция желудочного пищеварения:
Осуществляется нервными (условные и
безусловные рефлексы) и гуморальными механизмами.
К гуморальным регуляторам желудочной секреции относятся гастрин и гистамин. Гастрин выделяется специфичными G-клетками:
- в ответ на раздражение механорецепторов,
- в ответ на раздражение хеморецепторов (продукты первичного гидролиза белков),
- под влиянием n.vagus.
Гастрин стимулирует главные, обкладочные и добавочные клетки, что вызывает секрецию желудочного сока, в большей мере соляной кислоты. Также гастрин обеспечивает секрецию гистамина.
Гистамин, образующийся в
энтерохромаффиноподобных клетках (ECL-клетки, принадлежат фундальным железам)
слизистой оболочки желудка, взаимодействует с Н2-рецепторами на
обкладочных клетках желудка, увеличивает в них синтез и выделение соляной
кислоты.
Закисление желудочного содержимого подавляет активность G-клеток и по механизму обратной отрицательной связи снижает секрецию гастрина и желудочного сока.
Пепсин
Пепсин – эндопептидаза, то есть расщепляет внутренние пептидные связи в
молекулах белков и пептидов.
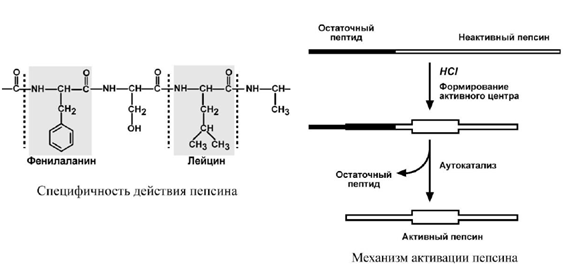
Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр»прикрыт» N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что «раскрывается» активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), блокирующий работу фермента, т.е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
Оптимум рН для пепсина 1,5-2,0.
Пепсин, не обладая высокой специфичностью, гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана), аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты и т.д.
Гастриксин
Его оптимум рН соответствует 3,2-3,5. Наибольшее значение этот фермент имеет при питании молочно-растительной пищей, слабо стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот.
Минуточку внимания! На сайте работает «Ночная тема». Нажмите на в меню сайта, чтобы перейти на темную цветовую схему.
Роль соляной кислоты в пищеварении
Одним из компонентов желудочного сока является соляная кислота. В образовании соляной кислоты принимают участие париетальные (обкладочные) клетки желудка, образующие ионы Н+ и переносящие ионы Сl– из крови в полость желудка.
Функции соляной кислоты:
- денатурация белков пищи,
- бактерицидное действие,
- высвобождение железа из комплекса с белками и перевод его в двухвалентную форму, что необходимо для его всасывания,
- превращение неактивного пепсиногена в активный пепсин,
- снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина,
- стимуляция секреции кишечного гормона секретина.
Переваривание белков в кишечнике: ферменты панкреатического и кишечного соков, система их активации, специфичность действия, продукты гидролиза белков.
Двенадцатиперстная кишка и тонкий кишечник в целом
Покинув
желудок, пища подвергается действию панкреатического сока, кишечного сока и
желчи.
Сок поджелудочной железы содержит проферменты–трипсиноген, химотрипсиноген, прокарбоксипептидазы, проэластазу. Проферменты в просвете кишечника активируются до трипсина, химотрипсина, карбоксипептидаз и эластазы соответственно. Указанные ферменты осуществляют основную работу по перевариванию белков.
В кишечном соке активны дипептидазы и аминопептидазы. Они заканчивают переваривание белков.
Регуляция кишечного пищеварения
В тонком кишечнике под влиянием низкого рН начинается секреция гормона секретина, который с током крови достигает поджелудочной железы и стимулирует выделение жидкой части панкреатического сока, богатого карбонат-ионами (HCO3–).
Также благодаря работе желудочных ферментов в химусе имеется некоторое количество аминокислот, вызывающих освобождение холецистокинина — панкреозимина. Он стимулирует секрецию другой, богатой проферментами, части поджелудочного сока, и секрецию желчи. В образовании желчи одновременно принимает участие секретин, стимулирующий продукцию бикарбонатов эпителием желчных протоков.
В целом нейтрализация кислого химуса в двенадцатиперстной кишке происходит при участии панкреатического сока и желчи. В результате его рН повышается до 7,0-7,5.
Трипсин
Выделяемый в pancreas трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клетками кишечного эпителия. От профермента отделяется гексапептид (Вал-Асп-Асп-Асп-Асп-Лиз), что приводит к формированию активного центра трипсина.
Трипсин специфичен к
пептидным связям, образованным с участием карбоксильных групп лизина и аргинина.
Трипсин может осуществлять аутокатализ, т.е. превращение последующих молекул трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока – химотрипсиноген, проэластазу, прокарбоксипептидазу. Также трипсин участвует в переваривании пищевых липидов, активируя фермент переваривания фосфолипидов – фосфолипазу А2, и колипазу фермента липазы, отвечающей за гидролиз три-ацилглицеролов.
Химотрипсин
Образуется из химотрипсиногена при участии трипсина и промежуточных, уже активных, форм химотрипсина, которые выстригают два дипептида из цепи профермента. Три образованных фрагмента удерживаются друг с другом посредством дисульфидных связей.
Фермент специфичен к пептидным связям, образованным с участием карбоксильных групп фенилаланина, тирозина и триптофана
Эластаза
Активируется в просвете кишечника трипсином из
проэластазы.
Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина.
Карбоксипептидазы
Карбоксипептидазы являются экзопептидазами, т.е. гидролизуют пептидные связи с С-конца пептидной цепи. Различают два типа карбоксипептидаз – карбоксипептидазы А и карбоксипептидазы В. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина.
Аминопептидазы
Являясь экзопептидазами, аминопептидазы отщепляют N-концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин.
Дипептидазы
Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов.
Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами.
Толстый кишечник
При богатой белками диете часть пептидов, не успевая расщепиться, достигает толстого кишечника и потребляется живущими там микроорганизмами.
Гниение белков в кишечнике: химизм, образование продуктов гниения и детоксикация ядовитых продуктов в печени
При ухудшении всасывания аминокислот, при избытке белковой пищи, при нарушении деятельности пищеварительных желез недопереваренные фрагменты белков достигают толстого кишечника, где подвергаются воздействию кишечной микрофлоры. Этот процесс получил название гниение белков в кишечнике. При этом образуются продукты разложения аминокислот, представляющие собой как токсины (кадаверин, путресцин, крезол, фенол, скатол, индол, пиперидин, пирролидин, сероводород, метилмеркаптан (СН3SН)), так и нейромедиаторы (серотонин, гистамин, октопамин, тирамин). Гниение белков также активируется при снижении перистальтики кишечника (запоры).
В печени происходит обезвреживание токсических веществ, поступающих из толстого кишечника, с помощью двух систем:
- система микросомального окисления,
- система конъюгации.
Цель и суть работы систем обезвреживания заключается в маскировке токсичных групп (например, в феноле токсична ОН-группа) и/или в придании гидрофильности молекуле, что способствует ее выведению с мочой и отсутствию накопления в нервной и жировой ткани.
Микросомальное окисление
Микросомальное окисление – это последовательность реакций с участием оксигеназ и НАДФН, приводящих к внедрению атома кислорода в состав неполярной молекулы и появлению у нее гидрофильности. Реакции осуществляются несколькими ферментами, расположенными на мембранах эндоплазматического ретикулума. Ферменты организуют короткую цепь, которая заканчивается цитохромом P450. Цитохром Р450 включает один атом кислорода в молекулу субстрата, а другой – в молекулу воды.
Субстрат окисления необязательно является чужеродным веществом (ксенобиотиком). Микросомальному окислению также подвергаются предшественники желчных кислот и стероидных гормонов и другие метаболиты.
Конъюгация
Для маскировки токсичных групп и придания большей гидрофильности молекуле существует процесс конъюгации, т.е. ее связывания с очень полярным соединением – таким соединением являются глутатион, серная, глюкуроновая, уксусная кислоты, глицин, глутамин. В клетках они часто находятся в связанном состоянии, например:
- серная кислота связана с 3′-фосфоаденозин-5′-фосфатом и образует фосфоаденозин-фосфосульфат (ФАФС),
- глюкуроновая кислота связана с уридилдифосфорной кислотой и образует уридил-дифосфоглюкуроновую кислоту (УДФГК),
- уксусная кислота находится в виде ацетил-S-KoA.
Образование животного индикана
Примером реакций обезвреживания веществ является превращение индола в животный индикан. Сначала индол окисляется с участием цитохрома Р450 до индоксила, затем конъюгирует с серной кислотой с образованием индоксилсульфата и далее калиевой соли – животного индикана.
При повышенном поступлении индола из толстого кишечника образование индикана в печени усиливается, далее он поступает в почки и выводится с мочой. По концентрации животного индикана в моче можно судить об интенсивности процессов гниения белка в кишечнике.
Пути всасывания аминокислот в кишечнике
Перенос аминокислот через мембраны клеток, как в кишечнике, так и в других тканях, осуществляется при помощи двух механизмов: вторичный активный транспорт и глутатионовая транспортная система.
Транспорт с использованием градиента концентрации натрия – вторичный активный транспорт.
В настоящее время выделяют 5 транспортных систем:
* для крупных нейтральных, в том числе алифатических и ароматических аминокислот,
* для малых нейтральных – аланина, серина, треонина,
* для основных аминокислот – аргинина и лизина, а также для кислых аминокислот – аспартата и глутамата,
* для малых аминокислот – глицина, пролина и оксипролина.
Вторичный активный транспорт основан на использовании низкой концентрации натрия внутри клеток, создаваемой Na+,K+-АТФазой. Специфический белок-транспортер связывает на апикальной поверхности энтероцитов аминокислоту и ион натрия. Используя движение натрия по градиенту концентрации, белок переносит аминокислоту в цитозоль.
Переносчиком некоторых аминокислот (обычно нейтральных) является трипептид глутатион (глутамилцистеилглицин). При взаимодействии глутатиона с амино-кислотой на внешней стороне клеточной мембраны при участии глутамилтрансферазы глутамильный остаток связывает аминокислоту и происходит ее перемещение внутрь клетки. Глутатион при этом распадается на составляющие. После отделения аминокислоты происходит ресинтез глутатиона.
Тканевой распад белков. Роль шаперонов и убиквинта в этом процессе.
Аминокислоты, образующиеся в результате переваривания белков в ЖКТ, поступают в кровь и доставляются в печень, где часть аминокислот используется для синтеза белков крови, а другая часть разносится кровью к разным тканям, органам и клеткам. Второй источник свободных аминокислот эндогенный гидролиз белков. Процесс обновления аминокислот в молекулах тканевых белков происходит с большой скоростью (белки крови — 18-45 суток). Распад тканевых белков осуществляется при участии активной системы протеолитических ферментов, объединенных под названием тканевых протеиназ или катепсинов. Но они не могут действовать в полную силу в организме животного, т.к. для этого необходима кислотная среда 4-5, а такая концентрация ионов Н, которая возникает в тканях после смерти или в очаге воспаления, что сопровождается самоперевариванием ткани. Но, тем не менее, активность протеиназ при рН 7,2-7,8 вполне обеспечивает постоянное самообновление белков.
В тканях различают протеиназы 1,2,3 и 4, которые по механизму действия близко стоят к соответствующим ферментам ЖКТ: 1-пепсин, 2-трипсин, 3-карбоксипептидаза, 4-аминопептидаза. Эти ферменты обеспечивают постоянный гидролиз белков и способствуют формированию фонда свободных аминокислот клеток, межклеточной жидкости и крови.
Шапероны
Шапероны – универсальные консервативные белки, которые связывают другие белки и стабилизируют их конформацию. Они могут исправлять недостатки белков как после их синтеза, так и в процессе синтеза на рибосомах, включатся в мультимерные комплексы или переходить через различные клеточные мембраны. Шапероны предотвращают агрегацию белка перед завершением свертывания и предотвращают образование нефункционирующих или непродуктивных конформаций во время этого процесса.
Убиквитин
В целом роль убиквитина выглядит так. Между убиквитином и белком-субстратом образуется ковалентная связь, возникающая между аминными группами остатков лизина белка и карбоксильной группой концевого остатка убиквитина. Образовавшиеся конъюгаты, которые содержат более чем одну молекулу убиквитина, могут быть деградированы протеиназами, в основном протеасомами. Узнавание белков, подлежащих протеолизу осуществляется так называемым убиктивиновым комплексом, способным взаимодействовать с отработанными или аномальными белками. АТФ расходуется как на стадии образования, так и на стадии деградации конъюгатов убиквитина с белком. Есть основания полагать, что убиквитин вызывает значительные конформационные изменения субстратного белка, что делает этот белок чувствительным к протеолизу. Связывание белка с убиквитином служит сигналом для «узнавания» этого белка протеиназами, что обеспечивает механизм избирательной деградации внутриклеточных белков.
Понятие клеточного метаболического пула аминокислот
Аминокислоты в клетке составляют динамичный пул, который непрерывно пополняется и так же непрерывно расходуется.
Существуют три источника аминокислот для пополнения этого пула:
- поступление из крови,
- распад собственных внутриклеточных белков
- синтез заменимых аминокислот.
Путь дальнейшего превращения каждой аминокислоты зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк.
Реакции превращения
аминокислот в клетке условно можно разделить на три части, в зависимости от
реагирующей группы:
- с участием аминогруппы — здесь подразумевается удаление от аминокислоты аминогруппы тем или иным способом, в результате чего остается углеводородный скелет,
- по боковой цепи (радикалу) — происходит использование углеродного скелета для синтеза глюкозы, жиров, или для образованеия энергии АТФ,
- по карбоксильной группе — связано с отщеплением карбоксильной группы.
Источник
Путь, который пища проделывает от входа в организм до выхода, длинный и извилистый. Чтобы человек получал все необходимые питательные вещества, внутри него неустанно работает завод по переработке под названием «Желудочно-кишечный тракт». Помните расхожую фразу: «Незаменимых не бывает»? Так вот этот не про пищеварительную систему. Здесь важен каждый элемент, и ни одному нет альтернативы. В этой статье мы рассказываем, как трудятся органы ЖКТ, чтобы еда из вашей тарелки превращалась в «молекулы жизни».
КАКИМ БЫВАЕТ ПИЩЕВАРЕНИЕ
Пищеварение – это процесс превращения больших молекул пищи в маленькие водорастворимые молекулы, способные попасть в кровь и транспортироваться с ней к различным органам. Так, углеводы становятся глюкозой, белки – аминокислотами, а жиры – жирными кислотами и глицерином.
Пищеварение делится на:
- механическое – когда пища физически разбивается на мелкие части (во время пережевывания);
- химическое – когда пища перерабатывается кислотами и ферментами.
По мере продвижения по желудочно-кишечному тракту еда «сталкивается» с полыми и плотными органами. Полые – это рот, пищевод, желудок, тонкая и толстая кишка, задний проход. Твёрдые органы – это поджелудочная железа, печень и желчный пузырь (они замешивают в пищевой комок различные вещества, работают как химическая лаборатория).
ДОЛГАЯ ДОРОГА ПО ЖЕЛУДОЧНО-КИШЕЧНОМУ ТРАКТУ
Длина желудочно-кишечного тракта взрослого человека составляет около восьми метров. Каждый кусочек пищи, который вы съедаете, «от» и «до» проходит этот долгий путь. А начинается пищеварение ещё до того, как вы успели положить еду в свой рот.
Рот
Запах или даже мысль о еде включает слюнные железы. Как только пища оказывается во рту, она увлажняется слюной – это первый этап химического пищеварения. В свою очередь, зубы и язык запускают процесс механического пищеварения.
Человеческая слюна на 98,5% состоит из воды, а также содержит муцин (формирует и склеивает пищевой комок), лизоцим (бактерицидный агент), ферменты амилазу и мальтазу, расщепляющие углеводы.
Когда вы закончите пережёвывать еду, она станет маленьким круглым шариком – болюсом. Болюс при помощи перистальтики пройдёт через глотку, верхний пищеводный сфинктер, пищевод и окажется в желудке.
Перистальтика — волнообразное сокращение стенок полых трубчатых органов (пищевода, желудка, кишечника и др.), способствующее продвижению их содержимого к выходным отверстиям.
Желудок
В желудке болюс подвергнется обработке желудочным соком, который состоит из двух основных компонентов:
- соляной кислоты – она убивает патогены, попавшие в организм вместе с пищей, и готовит болюс к перевариванию в кишечнике;
- пепсина – фермента, расщепляющего белки.
И соляная кислота, и пепсин могут повредить слизистую оболочку, поэтому природа защитила её плотным слоем слизи.
Перистальтика работает и в желудке: она помогает смешивать пищу с желудочным соком. Совсем немного соединений из пищи попадает в кровь на этом этапе пищеварения. Исключения – вода, алкоголь и нестероидные противовоспалительные препараты (НПВП). Если говорить о спиртном и НПВП, то исключение досадное, потому что они оказывают на желудок повреждающее воздействие.
В желудке пища проводит в среднем один-два часа. Можно сказать, что желудок дожёвывает еду. При переходе в кишечник она представляет собой густую пасту, которую называют химусом.
Тонкая кишка
Двенадцатиперстная кишка – это первый отдел тонкой кишки. Здесь химус смешивается с ферментами, желчью и кишечным соком:
- желчь – вырабатывается печенью, помогает расщеплять жиры и накапливается в желчном пузыре;
- панкреатический сок – содержит коктейль из ферментов, в том числе трипсиногена, эластазы и амилазы;
- кишечный сок – эта жидкость активирует некоторые ферменты в соке поджелудочной железы. Он также содержит другие ферменты, слизь и гормоны.
Продвигаясь по двенадцатиперстной, тощей и подвздошной кишке, химус постепенно разрушается и питательные вещества всасываются в кровь.
У людей основная часть питательных веществ всасывается в тонкой кишке.
Толстая кишка
В толстой кишке происходит всасывание остатков воды, солей и питательных веществ из химуса. В результате он обезвоживается и превращается в каловые массы. В толстой кишке, в отличие от стерильного желудка, существует огромное количество бактерий. Они утилизируют оставшиеся неусвоенными компоненты. В результате процессов микробного гниения выделяются органические кислоты, углекислый газ, метан, сероводород, токсичные вещества – за их обезвреживание отвечает печень.
Ещё одна ключевая функция толстой кишки – она проталкивает каловые массы в направлении анального отверстия. Причём для этого ей нужно сделать всего 3-4 сокращения в день.
Прямая кишка
Прямая кишка действительно почти прямая, в отличие от тонкой и толстой (хотя сама по сути является завершающим отделом толстой кишки). Это нужно для того, чтобы фекалии могли беспрепятственно покидать организм.
В прямой кишке пищеварительный процесс завершается: происходит окончательное формирование каловых масс и их подготовка к эвакуации из организма. Заканчивается прямая кишка анальным отверстием.
Несмотря на то, что весь кишечник активно всасывает воду их химуса, фекалии на 65-80% состоят из воды. Количество кала за сутки в среднем варьируется от 200 гр (если в питании преобладают животные белки) до 500 гр (если в рационе много овощей и фруктов).
Сухая часть кала наполовину состоит из бактерий, наполовину – из выделений толстой кишки, клеточных остатков из ЖКТ и небольшого количества непереваренной пищи (в основном это клетчатка).
Источник
